高三化学第一次月考
化 学
第I卷(共40分)
供参考的相对原子质量:
H:1 C:12 N:14 O:16 Na:23 Al:27 S:32 Ca:40 Fe:56
考生注意:请将答案写在答题纸上
选择题(本题共40分),1~5题每小题2分,6~15题每小题3分,只有一个正确选项。
1.下列化学名词正确的是
A.明凡 B. 苛性钠 C. 乙酸乙脂 D. 三溴笨酚
2.有关化学用语正确的是
A. 乙烯的最简式(实验式)C2H4 B. 乙醇的结构简式C2H6O
C. 四氯化碳的电子式
![]() D. 臭氧的分子式O3
D. 臭氧的分子式O3
3.已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10)如下图,则下列判断错误的是
 +
+
![]()
![]()
![]() +
+
![]()
E G L M
A G是最活泼的非金属单质 B M化学性质很活泼
C E能使红色石蕊试液变蓝色 D L分子中含有极性键
4.设阿伏加德常数为NA。则下列说法正确的是
A 常温常压下,11.2LCO2中含有的氧原子数为NA
B
标准状况下,1.8g D2O(D为![]() )中含有的中子数为NA
)中含有的中子数为NA
C 常温下,2.4g镁与足量的盐酸反应,失去的电子数为0.2NA
D 常温下,1L 0.1mol/L Na2CO3溶液中含CO32-数为0.1NA
5.下列离子方程式正确的是
A 碳酸氢钠溶液中加入盐酸:CO32-+2H+=CO2↑+H2O
B 硫化亚铁与盐酸反应:S2¯+2H+==H2S↑
C 苯酚钠溶于醋酸溶液:C6H5O¯+CH3COOH=C6H5OH+CH3COO¯
D 氯化亚铁溶液中通入少量氯气:Fe2++Cl2=Fe3++2Cl¯
6.下列说法错误的是
A 分子晶体中分子间作用力越大,分子越稳定
B 原子晶体中共价键越强,熔点越高
C 金属晶体通常具有良好的导电、导热性和延展性
D 除去淀粉胶体中混有的NaCl,可用渗析的方法
7.以下各种尾气吸收装置中,适合于吸收易溶性气体,而且能防止倒吸的是
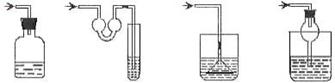
① ② ③ ④
A. ①② B. ②③ C. ②④ D. ③④
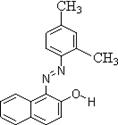
8.苏丹红是很多国家禁止用于食品生产的合成色素,有强烈的致癌作用,结构简式如右图。关于苏丹红说法错误的是
A 分子式为C18H16N2O B 属于芳香烃
C 能被酸性高锰酸钾溶液氧化 D 能溶于苯
9.已知某酸性溶液中存在较多的SO42-和NO3-,则该溶液中还可能大量共存的离子组是
A. Al3+、CO32-、Cl- B. Br-、Ba2+、Mg2+ C. Na+、Fe2+、Cl- D. Cl-、Cu2+、NH4+
 10.叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是
10.叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是
A N3¯与CO2含相等的电子数
B HN3与NH3作用生成的叠氮酸铵是属于分子晶体
C NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3¯)>c(OH¯)>c(H+)
D HN3水溶液中微粒浓度大小顺序为:c(HN3)>c(H+)>c(N3¯)>c(OH¯)
11.关于溶液的酸碱性说法正确的是
A. 水电离的c(H+)=1×10-10mol/L的溶液一定呈碱性
B. c(H+)=c(OH-)的溶液一定呈中性
C. 只含有NH4+、Cl-、H+、OH-的溶液一定呈酸性
D. 含CH3COOH分子的溶液一定呈酸性
12.把铝粉和氧化亚铁粉配成铝热剂,分成两等份:一份在高温下恰好完全反应后, 再与足量盐酸反应,一份直接放入足量的烧碱溶液中充分反应;前后两种情况下生成的气体质量比是
A. 1∶1 B. 2∶3 C. 3∶2 D. 28∶9
13.对于某些离子的检验及结论一定正确的是
A 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32-
B 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42-
C 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+
D 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
14.用pH均为2的盐酸和醋酸溶液,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗盐酸和醋酸溶液的体积分别为Vl和V2,则Vl和V2的关系正确的是
A.V1>V2 B.V1<V2 C.V1=V2 D.V1≤ V2
15.碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如右图装置),下列有关说法不正确的是
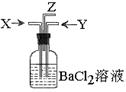 A 洗气瓶中产生的沉淀是碳酸钡
A 洗气瓶中产生的沉淀是碳酸钡
B 在Z导管出来的气体中有二氧化碳
C 洗气瓶中产生的沉淀是硫酸钡
D 在Z导管口有红棕色气体出现
第II卷(本卷共6题,共60分)
16.(本题共8分)
| A | B | C | D | ||||||||||||||
(1)在上面元素周期表中全部是金属元素的区域为 。(填序号)
(a) A (b) B (c) C (d) D
(2)有人认为形成化合物最多的元素不是IVA族的碳元素,而是另一种短周期元素,请你根据学过的化学知识判断这一元素是 。(填元素符号)
(3)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
②甲、乙两元素相比较,金属性较强的是 (填元素名称),可以验证该结论的实验是 。(填序号)
(a) 将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b) 将这两种元素的单质粉末分别和同浓度的盐酸反应
(c) 将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d) 比较这两种元素的气态氢化物的稳定性
17.(本题共10分)某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2
已知该反应中H2O2只发生如下过程:H2O2→O2
(1)该反应中的还原剂是 。
(2)该反应中,发生还原反应的过程是 → 。(填变化物质的化学式)
(3)写出该反应的化学方程式:
(4)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为 L。
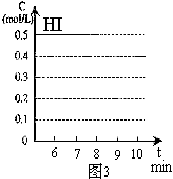
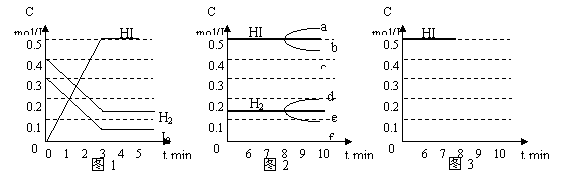
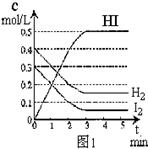
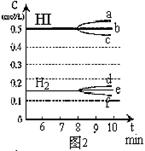
18.(本题共8分)在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:
H2(g)+I2(g) ![]() 2HI(g)
△H<0
2HI(g)
△H<0
反应中各物质的浓度随时间变化情况如图1:
(1)根据图1数据,反应开始至达到平衡时,平均速率v(HI)为 mol/L·min;
(2)反应达到平衡后,第8分钟时:
①若升高温度,HI浓度的变化正确的是 ;(用图2中a~c的编号回答)
②若加入I2蒸气,H2浓度的变化正确的是 。(用图2中d~f的编号回答)
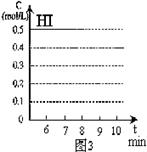
(3)反应达到平衡后,第8分钟时,若反容器的容积扩大一倍,请在图3中画出8分钟后HI浓度的变化情况。
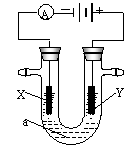
|
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时
在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 。在X极附近
观察到的实验现象是 。
②Y电极上的电极反应式为 。检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式为 。
②Y电极的材料是 ,电极反应式为 。
20.(本题共10分)已知: CH3-CH=CH2 + HBr → CH3-CHBr-CH3
1mol某烃A充分燃烧后可以得到8 mol CO2和4 mol H2O。该烃A 在不同条件下能发生下图所示的一系列变化。
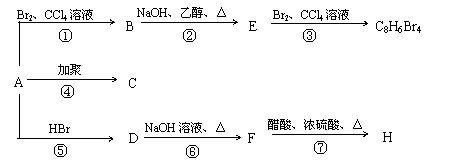 |
(1)上述反应中,反应①属于 反应,化合物F含有的官能团是 。
(2)写出C和H的结构简式:
C , H 。
(3)写出D → F反应的化学方程式 。
21.(8分)过氧化钙是一种安全无毒的物质,带有数量不等的结晶水,通常还含有部分CaO。
(1)称取0.542g过氧化钙样品,灼热时发生如下反应:
2CaO2·XH2O![]() 2CaO+O2↑+2XH2O,得到的O2在标准状况下体积为67.2mL,该样品中CaO2的物质的量为
mol。
2CaO+O2↑+2XH2O,得到的O2在标准状况下体积为67.2mL,该样品中CaO2的物质的量为
mol。
(2)另取同一样品0.542g,溶于适量的稀盐酸中,然后加入足量的Na2CO3溶液,将溶液中Ca2+全部转化为CaCO3沉淀,得到干燥的CaCO3 0.70g。
①试计算样品中CaO的质量。
②试计算样品中CaO2·XH2O的X值。
![]()
 答 题 纸
答 题 纸
| 题目 | 选择题 | 16 | 17 | 18 | 19 | 20 | 21 | 总分 |
| 得分 |
|
|
|
|
|
|
|
|
选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 得 分 | 评卷人 |
16.(本题共8分)
| A | B | C | D | ||||||||||||||||
| |||||||||||||||||||
(1)
(2)
(3)①
②
| 得 分 | 评卷人 |
17.(本题共10分)
| 得 分 | 评卷人 |
(1)
(2)
→
(3)
(4) L
18.(本题共8分)
(1) mol/L·min
|
| 得 分 | 评卷人 |
19.(本题共16分)
(1)① ,
② ,
(2)① ,
② ,
| 得 分 | 评卷人 |
20.(本题共10分)
(1) ,
(2)
C: H:
(3)
| 得 分 | 评卷人 |
21.(本题共8分)
(1) mol
(2)①
②
高三第一次月考化学试题参考答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| B | D | B | C | C | A | C | B | D | B | B | A | C | A | A |
| Mg | Al | ||||||||||||||||
| A | B | C | D | ||||||||||||||
16.(本题共8分,每个答案1分)
(1)b (2)H
(3)①
②镁 b c
17. (10分,每空2分)(1)H2O2 (2)H2CrO4
Cr(OH)3
(3)2H2CrO4+3H2O2=2Cr(OH)3+3O2↑+2H2O (4)3.36L
18.(8分,每空2分)(1)0.167 (2)①c ②f
(3)
19.(16分,每空2分)
(1)①2H++2e-=H2↑ 放出气体,溶液变红
②2Cl—2e-=Cl2↑ 把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色。
(2)①纯铜 Cu2++2e-=Cu ②粗铜 Cu—2e-=Cu2+
20.(10分)
(1)加成, 羟基 (各2分,共4分)
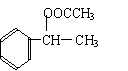
 (2)
(2)
C: H: (各2分,共4分)
(3)
(2分)
21.(8分)(1)0.006mol (2分)(2)①0.056g (3分)② X=1/2 (3分)