高三化学第一次月考试卷3
注意事项:
1.本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,第工卷1至4页,第Ⅱ卷5:至8页,共150分。考试时间120分钟。
2.请将第工卷的答案填在答题规定框图内。第Ⅱ卷的解答写在答题卷的指定栏目内。
可能用到的相对原子质量:
H-1 C-12 Li-7 O-16 Na-23 K-39 A1-27 Fe-56 Ba-137
第 Ⅰ 卷 (选择题,共74分)
一、 选择题 (本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.下列物质属于纯净物的是
A.漂白粉 B.胆矾
C.铝热剂 D.汽油
2.下列变化或过程属于物理变化的是
A.激光法蒸发石墨得C60 B.渗析法净化氢氧化铁胶体
C.鸡蛋白遇浓硝酸显黄色 D.直流电通过氯化钠水溶液
3.下列物质不能只用一步化合反应制取的
A.Fe(NO3)2 B.Fe(OH)3
C.NH4Cl D.H2SiO3
4.工业由粗硅制取纯硅有以下反应:
①Si(s)+3HCl(g)
![]() SiHCl3(g)+H2(g);△H= —318kJ·mol—l
SiHCl3(g)+H2(g);△H= —318kJ·mol—l
②SiHCl3(g)+
H2(g) ![]() Si(s) +3HCl(g);
Si(s) +3HCl(g);
下列关于上述反应的说法中不正确的是
A.反应①、②均为氧化还原反应 B.反应①、②均为置换反应
C.若反应①放热,则反应②一定吸热 D.欲提高SiHCl3产率,可减压或升温
5.在pH=1的溶液中,大量存在着的阳离子是NH4+、Mg2+、Al3+、Fe2+,则溶液中还可能大量存在的阴离子是
A.Cl— B.ClO—
C.HCO3— D.NO3—
6.下列热化学方程式中△H的绝对值能表示可燃物的燃烧热的是
A.H2(g)+Cl2(g)=2HCl(g);△H=-184.6kJ/mol
B.CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=-802.3kJ/mol
C.2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ/mol
D.CO(g)+1/2O2(g)=CO2(g);△H=-283kJ/mol
7.下列叙述中错误的是
A.化学反应中都伴随着能量变化
B.室温下钾、钠合金是液态,是原子反应堆的导热剂
C.钠是一种很强的还原剂,可以把钛、锆、钽等金属从它们的盐的溶液中还原出来
D.焰色反应是所有金属元素都有的化学性质
8.在FeCl3和AlCl3的混和液中,依次加入过量的NaI溶液和足量的Na2S,最后所得的沉淀是
A FeS、Al(OH)3 B Fe2S3、I2
C FeS、Al(OH)3、S D Fe(OH)3、Al(OH)3
二、 选择题(本题包括10小题,第9—16题每小题4分,第17、18小题每小题5分,共42分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题为0分)
9.根据下列反应判断有关物质的还原性由强到弱的顺序正确的是
①H2SO3+I2+H2O 2HI+H2SO4
②2FeCl3+2HI 2FeCl2+2HCl+I2
③3FeCl2+4HNO3 2FeCl3+NO↑+2H2O+Fe(NO3)3
A.H2SO3>I->Fe2+>NO B.I-> H2SO3> Fe2+>NO
C.Fe2+> I-> H2SO3>NO D.NO> Fe2+> H2SO3> I-
10.某固体物质只含有Na和O两种元素,它放在足量的水中产生两种气体,这
两种气体又可以在一定条件下相互反应生成水。则原固体物质的组成是
A.Na2O2与Na2O B.Na和NaOH
C.Na2O2和Na D.Na和Na2O
11.下列离子方程式正确的是
A.向Ba(OH)2溶液中滴加NH4HSO4溶液至沉淀刚好完全:
Ba2+ + 2OH- + 2H+ + SO42- = BaSO4↓+ 2 H2O
B.氨气溶于醋酸溶液:NH3 + H+ = NH4+
C.澄清石灰水与少量小苏打溶液混合:
Ca2+ + OH—+ HCO3— = CaCO3↓ + H2O
D.将少量SO2气体通入NaClO溶液中:SO2 + H2O + ClO—=SO42— + Cl— + 2H+
12.还原2.4×![]() 到X元素的低价态时,需消耗30mL0.2mol·
到X元素的低价态时,需消耗30mL0.2mol·![]() 的亚硫酸钠溶液,则在此反应中X元素的低价态为
的亚硫酸钠溶液,则在此反应中X元素的低价态为
A.0价 B.+1价
C.-1价 D.-2价
13.下列各组离子在相应的条件下一定能大量共存的是
A.在碱性溶液中:CO32—、K+、C1—、Na+
B.与铝粉反应放出氢气的无色溶液中:NO3—、Mg2+、Na+、SO42—
C.在c(H+)/c(OH—)==1×1013的溶液中:NH4+、Ca2+、C1—、K+
D.在中性溶液中:Fe3+、C1—、NO3—、A13+
14.xR2++yH++O2=mR3++nH2O的离子方程式中,对m和R3+的判断正确的是
A.m=4, R3+是氧化产物 B.m=n, R3+是氧化产物
C.m=2, R3+是还原产物 D.m=2n, R3+是还原产物
15.由钾和氧组成的某种离子晶体中,阳离子和阴离子的质量之比13:8.其中阴离子只有过氧根离子(O22-)和超过氧根离子(O2-)两种,在此晶体中过氧根离子和超过氧根离子的物质的量之比是
A 1:1 B 2:1
C 1:2 D 1:3
16.把一定量某碱金属与2.7g铝的混合物放人足量水中,金属全部溶解,收集到标准状况下气体5.6L,向所得溶液中通人过量二氧化碳,过滤,把滤液减压蒸发得固体20g,此碱金属相对原子质量为
A.7 B 23
C.39 D.85
17.在反应11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,7.5mo1 CuSO4可氧化的P 原子的物质的量为
A.1.5mol B.2.5mol
C.3mol D.5.5mol.
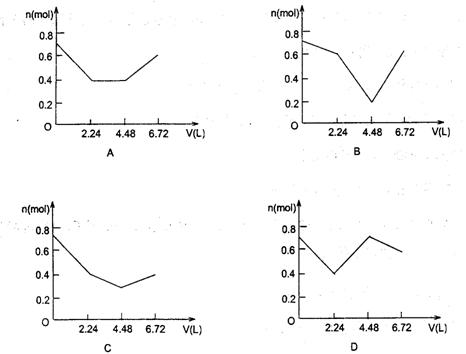
18.向0.2mol NaOH和0.1mo1 Ba(OH)2的溶液中持续稳定地通入6.72L(标准状况)CO2气体。下列表示溶液中离子的物质的量与通入CO2的体积关系的图象中,符合题意的是,(气体的溶解和离子的水解都忽略不计)
第 Ⅰ 卷 选择题答案(前8小题,每小题4分,共32分, 第9—16每小题4分,第17、18每小题5分,共42分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个,该小题就为0分。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
| 答案 | ||||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
第 Ⅱ 卷 (非选择题,共76分)
三、(本题包括两小题,共22分)
![]() 19某实验小组对中学课本中可生成H2的反应进行了研究,总结出四个可以生成H2的反应①Zn和盐酸
②钠和水 ③铝和氢氧化钠溶液 ④钠和无水乙醇.为点燃上述四个反应生成的氢气,他们设计了如图所示的装置:
19某实验小组对中学课本中可生成H2的反应进行了研究,总结出四个可以生成H2的反应①Zn和盐酸
②钠和水 ③铝和氢氧化钠溶液 ④钠和无水乙醇.为点燃上述四个反应生成的氢气,他们设计了如图所示的装置:
请回答下列问题:
⑴写出钠和水反应的化学方程式:
⑵在点燃之前必须先进行
方法是
⑶实验小组在点燃用上述装置制得的H2时①③④实验获得了成功.②却失败了.他们分析认为失败的原因是钠与水的太快,钠的用量太少.于是他们准备增加钠的用量,可教师说太危险.你认为产生危险的原因是
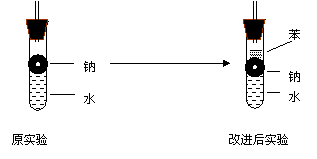 ⑷实验小组查阅钠 苯 水的密度分别是0.97g/ml 0.88
g/ml 1.00 g/ml并据此对实验进行了改进
⑷实验小组查阅钠 苯 水的密度分别是0.97g/ml 0.88
g/ml 1.00 g/ml并据此对实验进行了改进
反应速率在改进后的实验中,H2和生成速率减慢.原因是
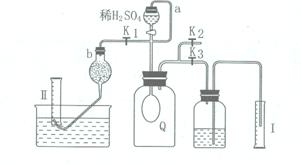 20.为测定可能部分变质的过氧化钠(含碳酸钠)的纯度,设计如右图所示的实验,其中Q为一开始无气体的气囊。取一定量的样品放于Q中,按图安装好实验装置,打开分液漏斗的活塞,将稀硫酸滴入气囊中充分反应(液体体积忽略不计)。
20.为测定可能部分变质的过氧化钠(含碳酸钠)的纯度,设计如右图所示的实验,其中Q为一开始无气体的气囊。取一定量的样品放于Q中,按图安装好实验装置,打开分液漏斗的活塞,将稀硫酸滴入气囊中充分反应(液体体积忽略不计)。
⑴ Q内发生反应生成___________种气体。
⑵ 为测出反应时生成气体的总体积,滴稀硫酸前必须关闭________(填“K1” 、“K2” 或“K3”,下同),打开________________。
⑶ 当上述反应停止,将K1 、K2、K3处于关闭状态,然后先打开K2,再缓缓打开K1。采取适当措施保证气囊内气体全部排尽且不使液体溢出。
上图b中装的试剂是________________________。
要缓慢打开K1的理由是____________________________________________________。
⑷ 实验结束时,量筒Ⅰ中有xmL水,量筒Ⅱ中收集到ymL气体(以上实验数据在同温同压下测定。),则原样品中过氧化钠的纯度是_________________(用含x、y的代数式表示)。
四、(本题包括四小题,共36分)
21.(8分)氢氧化钠又称 、 或 ,它极易溶于水,且 ,在空气中易吸收水蒸气,而发生 ,因此,氢氧化钠可作为一些气体的 ,对它必须 保存,且瓶塞要用 。
22.(10分)过氧化氢(H2O2)可作为采矿业废液消毒液,如消除采矿液中的氰化物(含CN—,其中N为—3价),反应方程式(已配平)如下:KCN+ H2O2 + H2O === A+ NH3↑。请回答:
⑴生成物A的化学式是________;
⑵该反应___________(填“是”或“不是”)属于氧化还原反应;若是,则被还原的元素是________(填物质的化学式)中的______;反应中被氧化的元素为______________;若不是,其理由是___________________________________________________。
⑶在标准状况下有0.448L氨气生成,则转移的电子为__________mol。
23.(10分)某无色溶液,其中有可能存在的离子如下:Na+、Ag+、Fe3+、Ba2+、Al3+、
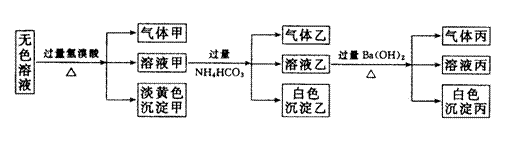 AlO2-、S2-、SO
AlO2-、S2-、SO![]() 、SO
、SO![]() ,现取该溶液进行有关实验,实验结如下:
,现取该溶液进行有关实验,实验结如下:
(1)沉淀甲是 (填化学式), 生成沉淀甲的离子方程式为
(2)沉淀乙是 (填化学式),由溶液甲生成沉淀乙的离子方程式为
(3)沉淀丙可能是 (填化学式)。
(4)气体甲的成分有哪几种可能,答:① ② ③
(有多少种就填多少种,可不填满。)
(5)综合上述信息,可以肯定存在的离子有
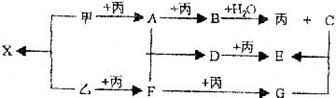 24(8分)已知甲、乙、丙常见单质,A、B、C、D、E、F、G、X均为常见的化合物;B和X的摩尔质量相同,E的式量比D的式量大16,在一定条件下,各物质的相互转化关系如下图所示:
24(8分)已知甲、乙、丙常见单质,A、B、C、D、E、F、G、X均为常见的化合物;B和X的摩尔质量相同,E的式量比D的式量大16,在一定条件下,各物质的相互转化关系如下图所示:
(1)写出X的电子式和G的化学式
X G
(2)完成下列有关变化的离子方程式
X的水溶液呈碱性:
过量的F与C溶液反应:
五、(本题包括2小题,共18分)
25.(8分) 将一定量的NaOH和NaHCO3的混合物放在密闭的容器中加热,充分反应后生成CO2的体积为V1(V1≠0)。将反应后的固体残渣Y与过量的稀盐酸反应,又生成V2体积的CO2(V1、V2)均为标准状况的体积)。试回答下列
(1)固体残渣成分是 ;
(2)若2 V1=V2,则原混合中NaOH和NaHCO3的物质的量之比为 。
26.(10分)加热100g Na2CO3和NaHCO3的混合物至质量不再变化,剩余固体的质量为87.6g,将产生的CO2和水蒸气的混合气体与足量的Na2O2充分反应后,固体质量增加了6g。计算:
(1)原混合物中Na2CO3的质量分数;
(2)混合气体与足量的Na2O2充分反应后,生成氧气的物质的量;
(3)若将a mol NaHCO3和b mol Na2O2混合,在密闭容器中加热至300℃使其充分反应,排出气体物质,最后容器中所得残留物是Na2CO3时,请推出a和b的关系式。