高三化学第一学期第二次调研测试
化 学 试 卷
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分150分,考试时间为120分钟。
可能用到的相对原子质量:H—1 C—12 N—14 O—16 Na—23 Mg—24 Al—27 Ca—40 S—32 Cl—35.5 K—39 Fe—56 Cu—64 Ba—137
第I卷(选择题,共72分)
一.选择题(每小题只有一个选项符合题意,每小题4分,共32分)
1.三峡工程是目前世界上最大的水利枢纽,它所提供的清洁、廉价或再生的水电,相当于每年5000万吨原煤的火力发电厂产生的电能,因此三峡工程的建成和使用有助于控制: ①氮氧化物的排放 ②酸雨的形成 ③臭氧空洞扩大 ④温室效应 ⑤白色污染
A.①②④ B. ②④ C. ③④ D.①②⑤
2.法国里昂的科学家最近发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也
有人称之为“零号元素”。下列有关“四中子”粒子的说法不正确的是 ( )
A.该粒子不显电性 B.该粒子质量数为4
C.在周期表中与氢元素占同一位置 D.该粒子质量比氢原子大
3.以下有关接触法制硫酸的论述错误的是
A.为提高反应速度和原料利用率,硫铁矿要在“沸腾”状态下燃烧
B.为防止催化剂中毒,气体在进接触室前要先净化
C.接触室中热交换器其主要作用是预热末反应的气体和冷却反应后的气体
D.吸收塔中SO3从下而上,水从上而喷下,剩余气体从上部出来放空
4.下列排列顺序中,错误的是
A、离子半径:O2->Na+>Al3+ B、稳定性:PH3>H2S>NH3
C、酸性:H3PO4<H2SO4<HClO4 D、还原性:HF<HCl<H2S
5.下列说法中正确的是
A.把SO2通入溴水中,溴水立即褪色,这是由于SO2具有漂白作用.
B.氢硫酸是弱酸,不能与强酸盐生成强酸.
C.稀硫酸不与铜反应,但把Cu片放在浓H2SO4中立即发生激烈反应.
D.硫化亚铁不能存在于盐酸中,而硫化铜能存在于盐酸中.
6.将一定量的铁粉和硫粉的混合物共热,充分反应后冷却,再加入足量的稀硫酸,得到标准状况下的气体11.2 L,则原混合物不可能的组成是(n代表物质的量)
A. n(Fe)< n(S) 总质量等于44g B. n(Fe)> n(S) 总质量等于44g
C. n(Fe) = n(S) 总质量大于44g D.n(Fe)> n(S) 总质量小于44g
7. 以NA表示阿伏加德罗常数,下列说法中正确的是
A、53g碳酸钠中含NA个CO32—
B、0.1mol—CH3含NA电子
C、常温常压下,46克NO2和N2O4平衡气体中含有3NA个原子。
D、标准状况下11.2L臭氧中含NA个氧原子
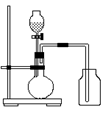 8.利用下列各组中物质作用制备和收集少量气体,能采用右图实验装置的是
8.利用下列各组中物质作用制备和收集少量气体,能采用右图实验装置的是
(1)锌和稀硫酸(2)电石和水(3)过氧化钠和水(4)亚硫酸钠和硫酸 (5)铜和稀硝酸(6)浓硫酸和浓盐酸
A.仅(3)、(4)、(6) B.(4)、(5)
C.仅(2)、(3)、(5)、(6) D.全部
二.选择题(每小题有一个或两个选项符合题意,每小题4分,共40分,选错不给分,漏选给2分)
9. 氯酸(HClO3)是一种强氧化性酸。若将铜粉投入氯酸溶液中,下列物质一定不可能生成的是
A.氯酸铜 B.高氯酸铜 C.氯化铜 D.氢气
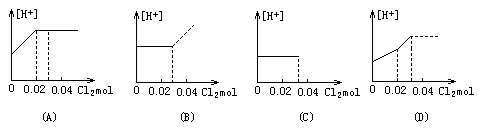
10.将0.03molCl2缓缓通入含0.02mol H2SO3和0.02mol HBr的混合溶液中,在此过程中,溶液的[H+]与Cl2用量的关系示意图是(溶液的体积示为不变)
11.经测定某溶液中只含NH4+、C1- 、H+、OH-四种离子,下列说法错误的是( )
A.溶液中四种粒子之间不可能满足:c(C1-)>c(H+)>c(NH4+)>c(OH-)
B.若溶液中粒子间满足:c(NH4+)>c(C1-)>c(OH-)>c(H+)则溶液中溶质一定为:NH4Cl和NH3·H20
C.若溶液中粒子间满足:c(C1-)>c(NH4+)>c(H+)>c(OH-)溶液中溶质一定只有NH4Cl
D.若溶液中c(NH4+)=c(Cl-),则该溶液一定显中性
12.下列离子方程式正确的是
A.Fe2O3溶于过量的氢碘酸中 Fe2O3+6H+=2Fe3++3H2O
B.次氯酸钠溶液中通入过量的二氧化硫 ClO-+SO2+H2O====HSO3-+HClO
C. FeBr2溶液中加入过量的氯水 2Fe2++4Br-+3Cl2====2Br2+2Fe3++6Cl-
D.澄清的石灰水中加入过量的NaHCO3溶液:
Ca2++2OH-+2HCO3-====CaCO3↓+2H2O+CO32-
13. 对下列实验现象的推测中,正确的是
A.将HBr通入酸性KMnO4溶液中溶液颜色由紫红色变成橙红色
B.![]() 溶液中存在平衡:
溶液中存在平衡:![]()
![]()
![]() ,加入少量稀盐酸后溶液浅绿色会加深
,加入少量稀盐酸后溶液浅绿色会加深
C.![]() 有漂白性,将
有漂白性,将![]() 通入石蕊试液中,溶液将先变红后褪色
通入石蕊试液中,溶液将先变红后褪色
D.硫酸铝溶液显酸性,次氯酸钠溶液显碱性,这两种溶液混合后会产生白色沉淀
14.下列各组中的离子能在同一溶液中大量共存,用足量盐酸酸化后,溶液仍然澄清透明且颜色无变化的是
A.K+ Ba2+ HCO![]() NO
NO![]() B.Na+ K+ OH-
AlO
B.Na+ K+ OH-
AlO![]()
C.Na+ Ca2+ Cl- HPO![]() D.Mg2+ NO
D.Mg2+ NO![]() SO
SO![]() Fe2+
Fe2+
15.镁铁混合物4.9g,溶解在过量某浓度的稀硝酸中,完全反应得到标况下气体2.24L(假设气体全为NO),则向反应后的溶液中加入足量的烧碱,则可生成沉淀的量是
A.6g B.8g C.10g D.12g
16.近年来,加“碘”食盐较多使用了碘酸钾,KIO3在工业上可用电解法制取,以石墨和铁为电极,以KI溶液为电解液在一定条件下电解,反应式为KI+H2O→KIO3+H2↑。下列有关说法中,正确的是
A.电解时,石墨做阳极,铁作阴极
B.电解时,在阳极上产生氢气
C.电解后得到KIO3产品的步骤有:过滤→浓缩→结晶→灼烧
D.电解中,每转移0.6mol电子,理论上可得到0.1mol无水KIO3晶体
17.已知反应① Cl2+2KBr=2KCl+Br2 ② KClO3+6HCl=3Cl2+KCl+3H2O
③ 2KBrO3+Cl2=Br2+2KClO3 , 下面说法正确的是
A.上述三个反应都有单质生成,所以都是置换反应
B.③中1mol还原剂反应,则氧化剂得电子的物质的量为2mol
C.反应②中还原剂与氧化剂的物质的量之比为5:1
D.氧化性由强到弱的顺序为KBrO3>KClO3>Cl2>Br2
18.amolFeS与bmolFeO投入到V L、c mol•L—1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为
A.(a+b)×63g
B.(a+b)×189g C.(a+b)mol D.(VC -![]() )mol
)mol
第Ⅱ卷(非选择题 共78分)
三.填空题(本题包括2小题,共16分)
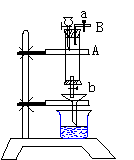 19(6分) 三氯化铁是中学化学实验中必不可少的重要试剂,某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3·6H2O,该同学设计的实验装置如右图所示,A中放有废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中滴加过量盐酸,此时溶液显浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿中加热,蒸发掉部分水并使多余的HNO3分解,再降温结晶得FeCl3·6H2O晶体,请填写下列空白:
19(6分) 三氯化铁是中学化学实验中必不可少的重要试剂,某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3·6H2O,该同学设计的实验装置如右图所示,A中放有废铁屑,烧杯中盛有过量的稀硝酸,实验时打开a,关闭b,从分液漏斗内向A中滴加过量盐酸,此时溶液显浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿中加热,蒸发掉部分水并使多余的HNO3分解,再降温结晶得FeCl3·6H2O晶体,请填写下列空白:
⑴从B导管收集产生的气体可采用的方法是__________________________________。
⑵滴加盐酸时,发现反应速率较之盐酸与纯铁粉反应要快,其原因是______________。
⑶整个实验过程中,活塞开关a都必须打开,原因之一是________________________;
二是_____________________________;三是_____________________________________。
⑷用降温结晶的方法制得FeCl3·6H2O,而不用直接蒸干
的方法来制得晶体的理由是____________________________。
20.(10分)为检验浓硫酸与木炭在加热条件下反应产生SO2和CO2气体,设计了如下图所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用I2和淀粉的蓝色溶液浸湿的脱脂棉。
|
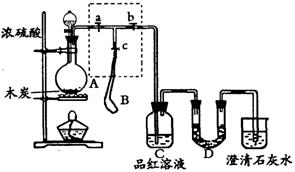
请回答下列问题:
(1)实验前欲检查装置A的气密性,可以采取的操作是
。
(2)此实验成败的关键在于控制反应产生气体的速率不能过快,由此设计了虚框部分的装置,则正确的操作顺序是 (用操作编号填写);
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
(3)实验时,装置C中的现象为 。
(4)当D中产生 (多选不得分)现象时,可以说明使E中澄清石灰水变浑的是CO2,而不是SO2;
A.进气口一端脱脂棉蓝色变浅,出气口一端脱脂棉蓝色不变
B.脱脂棉上蓝色均变浅
C.脱脂棉上蓝色褪去
则装置D的作用为 。
四.(本题包括2小题,共18分)
21.(8分)A、B、C、D为中学化学中常见的四种气体单质,在一定条件下,B可以分别和A、C、D化合分别生成甲、乙、丙,C和D化合生成化合物丁。已知甲、乙、丙的每个分子中含有的电子数相等,并且甲、乙、丙、丁有如下图所示关系:
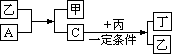
请填写下列空白:
(1)单质B的化学式是_____________,电子式为_____________。
(2)单质A与化合物乙发生反应的化学方程式是:___________________。
(3)化合物丙和丁若能反应,写出化学方程式,若不能反应说明理由__________________________________
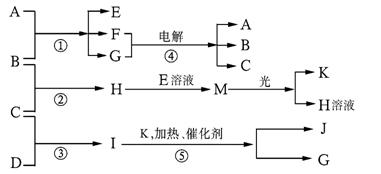
22.(10分)已知a、I、e为三种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
| 粒子代码 | a | I | e |
| 原子核数 | 单核 | 四核 | 双核 |
| 粒子的电荷数 | 一个单位正电荷 | 0 | 一个单位负电荷 |
物质A由a.e构成,B.C.D.K都是单质,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如下图所示:
请填写下列空白:
(1)写出下列物质的化学式:B , J ____________。
(2)写出下列反应的离子方程式:
①H+E(溶液)→M 。
②I溶于G 。
(3)在通常状况下,若1 g C气体在B气体中燃烧生成H气体时放出92.3 kJ热量,则2 mol H气体完全分解生成C气体和B气体的热化学方程式为___________________________。
五.(本题包括2小题,共28分)
23.(1) (8分)如图所示,温度不变时某容器分隔A、B两部分,A容积固定不变,B有可移动的活塞,现有A中充入![]() 和
和![]() ,在B中充入
,在B中充入![]() 和
和![]() ,在相同条件下发生可逆反应:
,在相同条件下发生可逆反应:![]()
![]()
![]() .
.
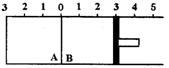
根据下列要求填写空白:
(a)若固定活塞位置在右侧的3处不动,达到平衡时,设A中压强为![]() ,B中压强为
,B中压强为![]() ,则
,则![]() 与
与![]() 的关系是
的关系是![]() _________
_________![]() (填“大于”、“小于”或“等于”).
(填“大于”、“小于”或“等于”).
(b)若要使A中与B中平衡状态相同,可移动活塞的位置应在________处.
(c)若活塞右移到5处,达到平衡后,B中![]() 为x mol,A中
为x mol,A中![]() 为y mol,则x和y的关系是y________x(填“大于”、“小于”或“等于”),理由是_____________________________________
为y mol,则x和y的关系是y________x(填“大于”、“小于”或“等于”),理由是_____________________________________
(2)(8分)氯酸是一种强酸,氯酸的浓度超过40%,就会迅速分解,产生比它的酸性更强的酸,同时放出气体,该气体混合物经干燥后,平均分子量为47.6,它可以使带火星的木条复燃,并可使润湿的淀粉一碘化钾试纸变蓝。试完成下列各题:
(a)该气体的组成是 ,气体混合物中各成分的物质的量比为 。
(b)写出氯酸分解方程配平: ,该反应的还原产物是 (写化学式)。
24.(12)我国首次载人航天飞船发射成功,标志着我国人民在攀登世界科技高峰的征程上又迈出了具有历史意义的一步。在长期载人太空飞行宇航器中每个宇航员平均每天消耗0.9kg02,呼出1.0kg CO2,为了能保持飞船座舱内空气成分的稳定,科学家进行大量的科学探索。
方法一:有的科学家提出“金属过氧化物处理系统”,即不断把座舱内的空气通过盛有金属过氧化物(以过氧化钠为例)的容器,并把处理后的气体充入座舱。
该方法的有关的化学方程式是
Ⅰ__________________________,Ⅱ__________________________。
方法二:有的科学家根据电解原理设计了飞船内空气更新实验系统。该系统结构示意
图如下:
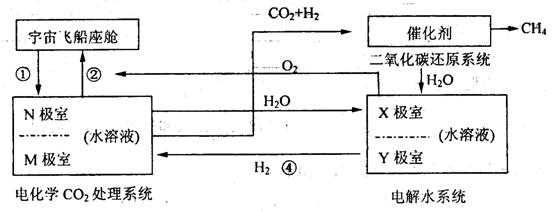
(1)管道①把飞船座舱中含较多CO2的潮湿空气通人“电化学CO2。处理系统”的N极室,通过该电极的反应可把CO2不断吸收,该电极的反应式为 __________________________,
其电解产物吸收C02的离子方程式为__________________________,在N极吸收C02后形成的离子会通过隔膜进入M极,通过M极的电极后应可使CO2从电解液中释放出来,并保持系统内的pH不变,该电极反应式为__________________________,
C02逸出的离子方程式为__________________________
(2)管道②是将处理后的空气混入“电解水系统”产生的新鲜氧气,然后通人飞船座舱内供宇航员呼吸用,在“电解水系统”中Y为__________极,X极的电解反应式为 __________________________
(3)逸出的C02没有排出飞船外,而是通过管道③进入“C02还原系统”。在该系统内,
C02跟H2在一定条件下反应,其产物有甲烷等气体,请评价这样处理的重要意义
六.(本题包括2小题,共16分)
25.(6分)已知有关物质的氧化性强弱顺序为:浓H2SO4>Fe3+>H+。现将30.0gFe粉(过量)与50.0mL浓H2SO4在加热条件下充分反应,共收集到11.2L(STP)气体(设生成的气体全部逸出),其质量为19.6g。试计算:
(1)浓H2SO4的物质的量浓度
(2)反应后剩余铁粉的质量
26.(10分)向某二价金属M的氢氧化物澄清溶液100mL中加入过量的NaHCO3溶液,生成MCO3沉淀,过滤,将沉淀置于足量盐酸中,在标况下收集到4.48L气体。将滤液加水稀释至250mL,取出25mL恰好与20mL盐酸完全反应,在标况下收集到1.12L气体。
⑴写出M的氢氧化物澄清溶液与过量NaHCO3溶液反应的化学方程式
。
⑵要计算M的相对原子质量,你认为还必须提供下列哪项数据(填序号)
a.M的氢氧化物溶液的物质的量浓度(设为2mol/L)
b.M的碳酸盐的质量(设为39.4 g)
c.与M的碳酸盐反应的盐酸的物质的量浓度
d.题设条件充足,不需要补充数据
⑶根据你的选择,计算M的相对原子质量和加入NaHCO3的溶液中含NaHCO3的质量。
高三化学参考答案
1B,2C,3D,4B,5D,6A,7C,8A,9BD,10A,11AC,12CD,13AD,14AB,15C,16AD,17CD,18BD。
19.(6分)(1)排水法或向下排空气 (1分)(2)形成Fe-Cu原电池反应(1分)
(3)之一是分液漏斗内外相通,之二是产生H2及时排出,之三是过滤时内外相通。(各1分)
(4)蒸干不能制得FeCl3·6H2O一是分解,FeCl3二是水解。(1分)
20.(1)关闭分液漏斗的活塞,打开止水夹a和b,关闭止水夹c,用手捂热(或微热)圆底烧瓶A,若C中有气泡冒出,移开手掌(或热源)后,C处导管内有水上升,则证明A装置的气密性良好。(2)③①② (3)品红溶液褪色 (4)A,除去SO2并检验SO2已被除净
21、[共8分] 每格2分 (1)H2,H∶H;
(2)2F2+2H2O=4HF+O2
(3)![]()
22.[共12分] (1)B.Cl2 J.NO(每格2分)
(2) ①H+ +ClO-= HClO(2分)
②NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH- (2分)
NH4++OH- (2分)
(3)2HCl(g)=H2(g)+Cl2(g);△H= +184.6 kJ·mol-1 (4分)
23.(1)< (2)右侧的3处(3)< B相当于减压了,减压后平衡向![]() 分解的方向移动,使B中
分解的方向移动,使B中![]() 的量减少了.(2)(a)O2、Cl2 ;n(O2):n(Cl2)=3/2 (b)8HClO3=4HClO4+2Cl2↑+3O2↑+2H2O
;Cl2
的量减少了.(2)(a)O2、Cl2 ;n(O2):n(Cl2)=3/2 (b)8HClO3=4HClO4+2Cl2↑+3O2↑+2H2O
;Cl2
24. 方法一:2Na202+2H20=NaOH+02↑ 2N0202+2C02=2Na2CO3+02↑
方法二:
(1)2H20+02+4e-=40H- CO2+2OH-=CO32-+H2O或C02+OH-=HCO3- 2H2 -4e-=4H+
CO32-+2H+=CO2↑+H20
(2)阴极:4OH--4e-=2H2O+02↑
(3)生成的甲烷可做飞船的气体燃料,体现了物质的循环使用和充分利用,同时保护宇宙环境。
25.(1)c(H2SO4)=(0.60mol+0.20mol)÷0.05L=16.0mol/L
(2)剩余m(Fe)=30.0g-56g/mol×(0.30mol+0.20mol)=2.0g.
26.(10分)( 1)M(OH)2+2NaHCO3=MCO3↓+Na2CO3+2H2O (2分)
(2)b (2分) (3)M=137 (3分); mNaHCO3=58.8g(3分)