高三第一次月考化学试题
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 Mg-24 P-31 S-32 Cl-35.5 Fe-56 Cu-64 Ag-108 I-127
一、选择题(每题仅一个正确答案,每题3分,共54分)
1. 人体内的O2- 离子对健康有害,能使人过早衰老,这是因为O2-离子在人体内释放出氧化性极强的活性氧的缘故,医学界试图用对人体无害的亚硒酸钠消除人体内的活性氧,这是利用了亚硒酸钠的 ( ) A.催化性 B.氧化性 C. 还原性 D.既有氧化性又有还原性
2. 若发现位于元素周期表第七横行、第十七纵行的元素的一种原子,该原子的质量数为280,则该原子核内的中子数为( ) A. 163 B.164 C. 165 D.166
3. 最近医学界通过放射性14C标记的C60,发现一种C60的羧酸衍生物在特定条件下可通过DNA杀死细胞,从而抑制艾滋病(AIDS)。下列有关14C的叙述中正确的是(
)
A. 与C60中普通碳原子的化学性质不同
B.与12C互为同位素
C. 是C60的同素异形体 D.与14N含的中子数相同
4. 用NA表示阿伏加德罗常数。下列叙述中正确的中 ( )
A. 0.1mol/L稀硫酸100mL中含有硫酸根离子个数为0.1NA
B. 1mol CH3+ 中含有电子数为10NA
C. 2.4 g金属镁与足量的盐酸反应,转移电子数为2NA
D. 12.4 g白磷中含有磷0.4NA原子,且含有0.6NA个P─P键
5. 下列叙述中正确的是 ( )
A. 同温同压下,相同体积的物质,它们的物质的量必相等
B. 任何条件下,等物质的量的乙烯和CO中所含分子数必相等
C. 1 L CO一定比1 L O2的质量小
D. 等体积等物质的量浓度的强酸中所含的H+数一定相等
6. 在同温同压下,下列各组热化学方程式中,满足Q2>Q1(单位:KJ/mol)的是( )
A. C(金刚石,s) + O2(g) =CO2(g); △H= -Q1 C(石墨,s) + O2(g) =CO2(g); △H= -Q2
B. S(g)+O2(g) =SO2(l); △H= -Q1 S(s)+O2(g) =SO2(g); △H= -Q2
C. H2(g)+Cl2(g) =2HCl(g); △H= -Q1 1/2 H2(g)+1/2Cl2(g) =HCl(g); △H= -Q2
D. 2H2(g)+O2(g) =2H2O(g); △H= -Q1 2H2(g)+O2(g) =2H2O(l); △H= -Q2
7. 200°C时,11.6g CO2和H2O的混合气体与足量的Na2O2充分反应,固体质量增加了3.6g,则原混合气体的平均相对分子质量为:( ) A. 5.8 B. 11.6 C.23.2 D.46.4
8. 下列各组离子一定能在指定环境中大量共存的是( )
A. 在c(HCO3-)= 0.1mol/L的溶液中:NH4+ 、Al3+、Cl-、NO3-
B. 在由水电离出的c(H+)= 1×10-12mol/L的溶液中:Fe3+、ClO-、Na+、SO42-
C. 在PH=1的溶液中:NO3-、SO42-、Na+、Fe2+
D. 在PH=13的溶液中:S2-、SO32-、Na+、K+
9. 两种短周期元素X和Y组成化合物XY3,在Y的原子序数为m时,X的原子序数为:① m-4
②m-2 ③m+4 ④m+6 ⑤m+8。其中正确的组合是( )
A. ①②③ B. ①③④
C. ②④⑤ D. ①②③④⑤
10. X元素属于金属元素,X元素和Y元素处于周期表中两个相邻的周期(Y 不属于稀有气体元
素).X与Y两原子核外电子总数之和为21.下列有关叙述错误的是( )
A. X、Y形成的常见化合物中,其化学式一定为XY2 B. X、Y可能形成的两性物质
C. X、Y形成的常见化合物中,其化学式不可能是XY D. Y形成的单质一定具有较强的氧化性
11. 已知HIO既能和酸又能和碱发生中和反应,则它与盐酸反应的产物是( )
A. ICl B.HClO C.HI D. IO-
12. 下列各组物质按性质增强顺序排列的是( )
A. 酸性: HIO4 HBrO4 HClO4 H2SO4 B. 氧化性:HClO HClO2 HClO3 HClO4
C. 溶解性:AgI AgBr AgCl AgF D. 还原必和稳定性:HF HCl HBr HI
13.下列反应的离子方程式书写正确的是:( )
A. 向沸水中滴入适量的饱和氯化铁溶液:Fe3+ +3H2O ![]() Fe(OH)3↓
+ 3H+
Fe(OH)3↓
+ 3H+
B. 向漂白精溶液中通往过量的二氧化碳:2ClO- +H2O+CO2=CaCO3↓ +2HClO
C. 硫酸氢钠溶液中加入少量氢氧化钡溶液:Ba2+ +SO42- =BaSO4↓
D. 铜片投稀硝酸中:3Cu+2NO3- +8H+=3Cu2+ +2NO↑+4H2O
E. 向含n mol FeBr2 的溶液中通入x mol Cl2,若x < 0.5n时: 2Fe2+ +4Br-+3Cl2=2Fe3+ +2Br2+6Cl-
14. 在100g物质的量浓度为18mol/L,密度为ρ 的浓硫酸中加入一定量的水稀释成9mol/L的硫酸,则加入的水的体积( ) A.小于100mL B. 等于100mL C.大于100mL D. 无法确定
15. 在CsCl晶体的最小重复单元中,已知2个最近的Cs+核间距为a cm,其化学式的式量为M,NA表示阿伏加德罗常数,则CsCl晶体的密度(单位:g/cm3)为( )
A. 8M / (NA a3) B. M a3/ (8NA) C. M / (NA a3) D. M a3/ NA
16. 有一未知浓度的硫酸溶液25mL,在加入0.5mol/L的Ba(NO3)2溶液25.0mL后,改加NaOH溶液,结果用去1.0mol/LNaOH溶液 50mL恰好完全中和,则硫酸的物质的量浓度为( )
A.0.5mol/L B.1.0mol/L C.1.5mol/L D.2.0mol/L
17. 将0.2molMnO2和50mL12.0mol/L盐酸混合缓缓加热(HCl无损失),反应完全后余下的溶液中加
入足量的AgNO3溶液,下列判断生成AgCl沉淀的物质的量正确的是( )
A.等于0.30mol B. 大于0.30mol C. 大于0.30mol,小于0.6mol D.以上结论都不正确
18. 由FeCl3固体配制250mL0.1mol/L FeCl3溶液,导致所配溶液物质的量浓度偏低的是( )
①把FeCl3放在纸上用天平(准确)称取所需物质质量后,倒入烧杯中溶解(发现纸上有红褐色斑点);
②把用干净烧杯准确称量的FeCl3先加入少量盐酸中溶解后,再加水稀释;
③在转移刚溶解稀释的FeCl3溶液时发现容量瓶中有少量水存在;
④烧杯和玻璃棒分别用30mL水洗涤3次,每次洗涤液均倒入容量瓶,并摇匀;
⑤在称量过程中,FeCl3固体已部分潮解,且固体表面已形成了少许溶液;
A. ①②③ B. ①⑤ C. ②④⑤ D. ①②③④⑤
二、填空题(每空1--2分,共48分)
19. 根据下列10种物质的化学式与序号填空:
①O2 ②Ne ③NH4Cl ④K2O2 ⑤HF ⑥CCl4 ⑦Cu ⑧NaF ⑨BF3 ⑩SiO2
⑴由非极性键形成的非极性分子是_____________;⑵由极性键形成的非极性分子是_____________;⑶由极性键形成的极性分子是_________________;⑷只由离子键形成的晶体是_________________;
⑸既有离子键又有非极性键的是_______________;⑹既有离子键又有极性键的是_______________;⑺仅以分子间作用力结合而成的晶体是_________;⑻仅以共价键相结合的晶体是_______________;
⑼分子中的原子未达到2个或8个电子稳定结构的是________;⑽在固态时也能导电的是_________。
20.甲、乙、丙、丁四种单质在点燃条件下反应生成X、Y、Z、W四种
化合物,转化关系如右图所示。又已知:①甲、乙、丙均为前三周期元
素的单质,常温下均为气体,丁是日常生活中的一种常见金属;②常温
下,X是无色液体,Y是黑色固体;③丙在乙中燃烧发出苍白色的火焰,
丁在乙中燃烧生成棕黄色的烟,W的水溶液呈黄色。请填空:
⑴丁在甲和X同时存在的条件下,可以被腐蚀,写出电极反应式:负极_________________________,正极__________________________;⑵将少量的W饱和溶液滴入到沸腾的X中,再插入连接有直流电源的两石墨电极,能看到___________________________________________________________(现象);⑶将Y看成碱性氧化物,Y与Z的溶液反应的离子方程式是:_________________________________;⑷若一定条件下丁分别与X、Z发生反应生成等物质的量的气体,则消耗丁的物质的量之比为_______。
 高三第一次月考化学试题答题卷
高三第一次月考化学试题答题卷
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
二、填空题(每空1--2分,共48分)
19. ⑴_____________;⑵_____________;⑶______________;⑷______________;⑸_____________;⑹_________________;⑺_____________;⑻______________;⑼_____________;⑽_____________。
20. ⑴负极_______________________________,正极__________________________________;
⑵能看到________________________________________________________________________(现象); ⑶离子方程式是:_________________________________________;⑷物质的量之比为_____________。
21. A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处于同一周期,A、C处于同一主族。C原子核内的质子数等于A、B原子核内的质子数之和,C原子最外层电子数是D原子最外层电子数的4倍。试回答:⑴这四种元素的名称分别是A_______ B_______ C_______ D______;
⑵这四种元素单质的熔点由高到低的顺序是______________________________(用物质化学式表示);
⑶ C的固态氧化物是__________晶体;⑷写出A、B、D组成的化合物与B、C组成的化合物相互反应的化学方程式:_________________________________________________。
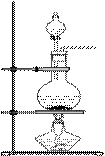 22. 根据右边的实验室制气体的装置图,回答下列问题:
22. 根据右边的实验室制气体的装置图,回答下列问题:
(1)当加热时,制取的一种单质是_____________,一种化合物是____________;
(2)当不加热时,制取的一种单质是___________,一种有机物是____________;
(3)若制取某气体化合物,它要标准状况下的密度是1.52 g/L时,就采取_________ (加热或不加热)的方法,用_________法收集它。若将该气体通入到FeCl3溶液中,则发生的反应的离子方程式是___________________________________________。
23. 某种仪器中盛有某种液体,在读取其体积时,若平视读数为 n mL,仰视读数为 x mL,俯视读数为 y mL,且x > n > y,则所使用的仪器可能是______________________。
24. 在NaCl晶体结构中,与每个Na+ 距离相等且最近的Cl- 所围成的空间几何构型是_____________。
三、计算题(8分)
25. 在室温下,向100mL Cu(IO3)2饱和溶液中加入足量的经酸化的KI溶液,发生如下的反应:
5I- +IO3- +6H+ =3I2 +3H2O ,2Cu2+ + 4 I- = 2CuI↓+ I2。反应完全后,用0.10 mol/L Na2S2O3溶液滴定,I2 +2S2O32- =2I- +S4O62- 消耗40mL Na2S2O3溶液,计算:(1)原饱和溶液中Cu(IO3)2的物质的量浓度。(2)若Cu(IO3)2 饱和溶液的密度为1.0 g/cm3 ,室温时Cu(IO3)2 的溶解度是多少?(提示:Cu(IO3)2属微溶物)
解: