高三第一学期化学期中考试
注意事项:
1.答题前,考生先将自己的姓名、考试证号等填写清楚,并认真核准答题卡表头及答题纸密封线内规定填写或填涂的项目。
2.第I卷选择题部分必须使用2B铅笔填涂在答题卡上;II卷非选择题部分必须使用0.5mm黑色签字笔书写在答题纸上,字体工整、笔迹清楚。
3.请按照题号顺序在各题目的答题区域内作答,书写不能超出横线或方格,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。
4.保持卡面和答题纸清洁,不折叠、不破损。
化 学
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,全卷满分150分,考试时间120分钟。
第I卷(选择题 共72分)
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Al-27 P-31 S-32 Cl-35.5 Ca-40 Fe-56 Cu-64
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.今年3月29 日,京沪高速淮安段,发生一起违章驾驶相撞,使槽罐车中32t液氯快速泄漏,造成大批人员伤亡、大片农田被毁和重大经济损失的恶性案件。对于在事故发生时的下列各种应急处理,你认为正确的是
A、附近居民切忌惊慌,用毛巾护住口鼻,朝顺风方向逃逸或向避风的沟塘低洼处转移
B、要快速地将翻落的氯槽罐安全起吊移至水池,进行碱液稀释中和
C、液氯的流淌速度很慢,居民不必惊慌,可以放心地撤退到家中,关紧门窗
D、检修或现场抢救时,如果没有防毒面具,可以佩戴用浓的烧碱溶液浸泡过的湿口罩
2.核裂变产生的核能可用于发电,![]() 是一种常用的核燃料,下列有关说法错误的是
是一种常用的核燃料,下列有关说法错误的是
A.![]() 与
与![]() 的质量比约为235:12 B.
的质量比约为235:12 B.![]() 中中子数比质子数多51
中中子数比质子数多51
C.U元素的近似相对原子质量为235 D.![]() 与
与![]() 属于同一种元素
属于同一种元素
3.下列有关物质分类或归类正确的是
①混合物:石炭酸、福尔马林、水玻璃、水银 ②化合物:CaCl2,烧碱、聚苯乙烯、HD
③电解质:明矾、胆矾、冰醋酸、硫酸钡 ④同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2;
⑤同素异形体:C60,C70,金刚石、石墨
A、①③④ B、③⑤ C、②③④ D、②④
4.在给定的四种溶液中,各离子能大量共存的是
A、滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl-.I-
B、所含溶质为NaNO3的溶液:K+、HSO4-、C1-、S2O32-
C、含有大量H+的无色溶液:Na+、Fe3+、NO3-、MnO4-
D、能使pH试纸变为蓝色的溶液:Na+、C1-、S2-、SO32-
5.在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢为原料制取氧气,当制得同温、同压下相同体积的氧气时,三个反应中转移的电子数之比为
A. 1︰1︰1 B. 2︰2︰1 C. 2︰3︰1 D. 4︰3︰2
6.中学化学教材中有大量数据,下列为某同学利用教材中的数据所做的判断,其中不正确的是
A.用溶解度数据,可判断煮沸Mg(HCO3)2溶液所得产物是Mg(OH)2还是MgCO3
B.用沸点数据,可推测能否将一些液体混合物用分馏的方法分离开来的可能性
C.用反应热数据的大小,可判断不同反应的反应速率的快慢
D.用原子半径数据,可推断某些原子氧化性或还原性的强弱
7.在实验室进行下列有关的物质制备中,理论上正确、操作上可行、经济上合理的是
![]()
![]()
![]() A、C
CO
CO2
Na2CO3
A、C
CO
CO2
Na2CO3
![]()
![]() B、Cu
Cu(NO3)2溶液
Cu(OH)2
B、Cu
Cu(NO3)2溶液
Cu(OH)2
![]()
![]()
![]()
![]() C、Fe
Fe2O3
Fe2(SO4)3溶液
C、Fe
Fe2O3
Fe2(SO4)3溶液
D、CaO Ca(OH)2溶液 NaOH溶液
8.下列说法正确的是
A.离子晶体中可能含有共价键,但不一定含有金属元素
B.分子晶体中一定含有共价键
C.非极性分子中一定存在非极性键
D.对于组成结构相似的分子晶体,一定是相对分子质量越大,熔沸点越高
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分)
9.设NA为阿伏加德罗常数。下列叙述正确的是 ( )
A.常温下,1molNaHCO3投入足量稀盐酸中,待反应结束后,可逸出NA个CO2分子
B.在含有NA个醋酸根离子(CH3COO-)的醋酸溶液中,氢离子(H+)数目略大于NA C.1molCH3+(碳正离子)中含电子数目为10NA
D.46gNO2和N2O4混合气体中含有原子数为3NA
10.用惰性电极实现电解,下列说法正确的是
A.电解稀硫酸溶液,实质上是电解水,故溶液p H不变
B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小
C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1:2
D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1
11.下列各组溶液中,不用任何其它试剂不能鉴别的是
A. NaOH FeCl3 MgCl2 K2SO4 B.HCl NaOH K2SO4 NaHCO3
C.NaAlO2 KHCO3 NaCl NaHSO4 D.Na2SO4 H2SO4 AlCl3 BaCl2
12.下列说法或表示方法中正确的是
A. 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(金刚石)→C(石墨);ΔH=+119KJ/mol 可知,金刚石比石墨稳定
C.在101Kpa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);ΔH=+285.8KJ/mol
D.在稀溶液中:H+(aq)+OH-(aq)=H2O(l);ΔH=-53.7KJ/mol ,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于53.7KJ/mol
13.下列反应的现象描述与离子方程式都正确的是
A. 金属镁与稀盐酸反应:有氢气产生;Mg+2H++2Cl- =MgCl2+H2↑
B. 氯化钡溶液与硫酸反应:有白色沉淀生成;Ba2+ +![]() =BaSO4¯
=BaSO4¯
C. 碳酸钠溶液与盐酸反应:有气泡生成:Na2CO3+2H+=2Na++CO2+H2O
D. 过量铁粉与氯化铁溶液反应:溶液变成浅绿色:Fe+Fe3+=2Fe2+
14.在一定条件下,固定容积的密闭容器中反应:2NO2(g)![]() O2(g)+2NO(g);DH>0,达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是
O2(g)+2NO(g);DH>0,达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是
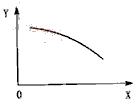
A. 当X表示温度时,Y表示NO2的物质的量
B. 当X表示压强时,Y表示NO2的转化率
C. 当X表示反应时间时,Y表示混合气体的密度
D. 当X表示NO2的物质的量,Y表示O2的物质的量
15.下列各选项所述的两个量,前者一定大于后者的是
①HF和HBr的沸点,②纯水在25℃和80℃时的pH,③同温下分别在100g水中最多能溶解的无水CuSO5和CuSO5·5H2O的质量,④25℃时,等体积的pH都等于3的盐酸和AlCl3溶液中,已电离的水分子数,⑤在NH3+NO→N2+H2O反应中,被氧化和被还原的N原子数,⑥耐火材料MgO和CaO的熔点,⑦H-和H+离子半径,⑧金刚石晶体和石墨晶体中,每个最小碳环里所含的实际碳原子数
A、①②⑥ B、①②③⑤ C、⑤⑥⑦ D、①②⑥⑦
16.在一密闭容器中,反应mA(g)+nB(s) ![]() 3C(g)达到平衡时,测得C(A)为0.5 mol/L在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得C(A)为0.3 mol/L,则下列判断正确的是
3C(g)达到平衡时,测得C(A)为0.5 mol/L在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得C(A)为0.3 mol/L,则下列判断正确的是
A、混合气体密度一定减小 B、平衡一定向逆反应方向移动
C、化学计量数:m+n>3 D、物质C的体积分数增加了
17.MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如右图所示。下列叙述中不正确的是
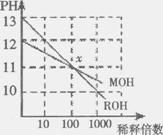 A、ROH是一种强碱
A、ROH是一种强碱
B、在x点,MOH完全电离
C、在x点,C(M+)=C(R+)
D、稀释前,C(ROH)=10C(MOH)
18.将质量为w1g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体V1 L。向溶液中逐滴加入浓度为a mol/L的HCl溶液,过程中有白色沉淀生成后又逐渐溶解,当沉淀恰好消失时所加HCl溶液体积为V2 L。将溶液蒸干灼烧得固体w2g。下列所列关系式中正确的是
A. 35.5a V2 =w2-w1 B. 23n(Na)+27n(Al)=w1
C. n(Na)+3n(Al)=![]() D. a V2 =
D. a V2 =![]()
第Ⅱ卷(非选择题 共78分)
三、(本题包括2小题,共20分)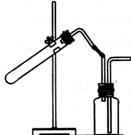
19.(8分)(1)右图是某学生设计的制取和收集某些气体的实验装置(可加热)。
若用排空气法收集,可使用该装置制备和收集的是_____________;若用排水法收集(集气瓶中充满水), 可使用该装置制备和收集的是____________(均填编号)。
A.用Zn与稀盐酸反应制H2 B.用MnO2与双氧水反应制O2
C.用MnO2与浓HCl反应制Cl2 D.用MnO2与KClO3反应制O2 E.用CaCO3与稀盐酸反应制CO2 F.用Cu与稀HNO3反应制NO G.用固体NH4C1和消石灰制NH3
(2) 下列仪器中:①漏斗②容量瓶③蒸馏烧瓶④天平⑤分液漏斗⑥滴定管⑦燃烧匙,常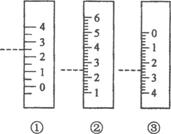 用于物质分离的是_________(填编号)。
用于物质分离的是_________(填编号)。
(3)右图是温度计、量筒、滴定管的一部分,下述读数(虚线刻度)及说法正确的是__________
A.①是量筒,读数为2.5mL
B.②是量筒,读数为2.5mL
C.③是滴定管,读数为2.5mL
D.②是温度计,读数是2.5℃
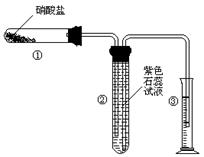 20.(12分)某校化学兴趣小组的同学对硝酸盐的受热分解进行探究。他们设计了如下装置分别加热了NaNO3、Cu(NO3)2、AgNO3。(加热及夹持装置未画出)
20.(12分)某校化学兴趣小组的同学对硝酸盐的受热分解进行探究。他们设计了如下装置分别加热了NaNO3、Cu(NO3)2、AgNO3。(加热及夹持装置未画出)
(1) 甲同学加热的是NaNO3。加热过程发现:装置②中产生气泡,部分石蕊试液被压至装置③中;用带火星的木条检验②中的气体,木条复燃;分析装置①中剩余的固体得知,剩余固体中含有N元素,且显+3价。请写出NaNO3受热分解的化学方程
式: ;
(2) 乙同学加热的是Cu(NO3)2。加热过程发现:装置②中也有气泡产生,但在上升的过程中消失。石蕊试液逐渐变为红色,液体几乎不被压至装置③中。装置①中的固体逐渐变为黑色。请写出Cu(NO3)2受热分解的化学方程
式: ;
(3)丙同学加热的是AgNO3。加热过程发现:装置②中也有气泡产生,但在上升的过程中气泡部分消失,剩余的气体也能使带火星的木条复燃。石蕊试液也逐渐变为红色,有少量液体被压至装置③中。装置①中的固体逐渐变为黑色。丙同学据此写出了AgNO3受热分解可能的两种化学方程式:
(Ⅰ)4AgNO3![]() 2Ag2O+4NO2↑+O2↑,(Ⅱ) 2AgNO3
2Ag2O+4NO2↑+O2↑,(Ⅱ) 2AgNO3![]() 2Ag+2NO2↑+O2↑。请你分析,可能正确的是哪一个并说明理
2Ag+2NO2↑+O2↑。请你分析,可能正确的是哪一个并说明理
由: ;
请你设计一个简单的实验证明你的结论是正确的:
;
(4)由上述3个实验的结果,请你推测:硝酸盐受热分解的产物可能与
有关。
四、(本题包括2小题,共22分)
21.(10分)
|
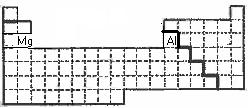
(1) 在上面元素周期表中画出金属元素与非金属元素的分界线。
(2)有人认为形成化合物最多的元素不是IVA族的碳元素,而是另一种短周期元素,请你根据学过的化学知识判断这一元素是 。
(3)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
① 用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
② 用反应方程式各举一例,甲、乙两元素分别与氧化物反应
, 。
22、(12分)2005年10月12日9时,我国在酒泉卫星发射中心成功的发射了“神舟”六号载人飞船。将两名航天员同时送上太空,并于10月17日凌晨成功返回,为我国的航天事业写下了新的篇章。
⑴火箭升空时,由于与大气层的剧烈摩擦,产生高温。为了防止火箭温度过高,在火箭表面涂上一种特殊的涂料,该涂料的性质最可能的是________;
A、在高温下不融化 B、在高温下可分解气化
C、在常温下就分解气化 D、该涂料不可能发生分解
⑵ 火箭升空需要高能的燃料,经常是用N2O4和N2H4作为燃料,其反应的方程式是: N2O4
+ N2H4 → N2 + H2O 。请配平该反应方程式:
————N2O4 + ————N2H4 → ————N2 + ————H2O
该反应中被氧化的原子与被还原的原子物质的量之比是 。
这个反应应用于火箭推进器,除释放大量的热和快速产生大量气体外,还有一个很大的优点是 _______________________________________________。
(3)右图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,
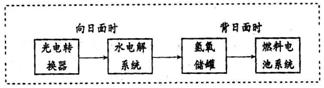 水电解系统中的阳极反应为:
水电解系统中的阳极反应为:
,
燃料电池放电时的负极反应:
。
 五、(本题包括2小题,共18分)
五、(本题包括2小题,共18分)
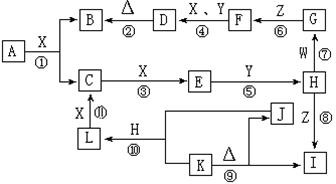
23.(12分)右图是中学化学中常见物质之间的相互转化关系。其中,X是气体单质,Y是液体化合物,Z是常见的碱且焰色反应为黄色;W、L是固体单质,K、I中含有相同的元素;反应①是高温下进行的工业上制取H的第一步反应。请按要求填空:
(1)G、H的化学式分别为
G 、 H ,Y、Z的电子式分别为
Y 、Z ;
(2)写出下列反应的化学方程式:
① ;
④ ;
⑨ ;
(3)反应⑩中生成 1molL时,转移的电子数为 。
24.(6分)目前世界上比较先进的电解制碱术是离子交换膜法。试回答下列问题:
(1)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙、Ca2+、Mg2+、Fe3+、SO42-杂质,不符合电解要求,因此必须经过精制。
除去SO42-可用钡试剂,该钡试剂可以是 。(选填a、b、c)
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(2)现有200mL食盐水,其中含有少量的NaOH,该溶液的pH等于10,用石墨电极电解,当阴极产生的气体体积为0.224L(标准状况)时停止电解。
阳极的电极反应式为 。
电解后溶液的pH约为(忽略溶液的体积变化) 。
六.(本题包括2小题,共18分)
25、(6分)某天然碱的组成为xNa2CO3•yNaHCO3•zH2O,将称取的4.56g样品于300℃加热分解至完全(300℃时Na2CO3不分解),得到残留固体3.71g,分解产生的气体通入足量饱和的澄清石灰水中,全部吸收后可得到0.500g沉淀。请计算:
(1)该样品中结晶水的质量分数。
(2)通过计算确定该天然碱的化学式。
26、(12分) 一定温度下,碳与水蒸气在容积不变的密闭容器中发生反应并建立化学平衡:
C(s) + H2O(g) ![]() CO(g) + H2(g); △H>0
CO(g) + H2(g); △H>0
(1)平衡混合气体的平均相对分子质量M1的取值范围为 < Ml < ;
(2)将平衡混合气体升高温度,混合气体平均相对分子质量 (填“增大”、“减小”或“不变”,下同),密度将 ;
(3)若使用等物质的量CO和H2从逆反应方向在相同条件下建立平衡,则混合气体的平均相对分子质量M2的取值范围 < M2 < ;若使用不同物质的量的CO 和H2从逆反应方向在相同条件下建立平衡,则平衡混合气体的平均相对分子质量 M3的取值范围
< M3 < 。
(4)若起始投料: l mol C(s)和1mol H2O(g)。在相同条件下反应达平衡,混合气体平均相对分子质量为M,下列哪组投料在相同条件下建立平衡后混合气体的平均相对分子质量不可能为M的是 。
A.C(s):2mol,H2O(g):lmol
B.CO(g):1mol,H2(g):1mol
C.C(s):0.5mol,H2O(g)0.4mol,CO(g):0.6mol,H2(g):0.6mol
D.C(s):0.9mol,H2O(g):0.9mol,CO(g)0.1mol
(5)若在一定温度下,在一个容积可变的密闭容器中同时投入C(s)、H2O(g)、CO(g)、H2(g),达到平衡时混合气体的平均相对分子质量 M0。若给平衡体系加压,则混合气体的平均相对分子质量M的变化情况为(请填写条件和结论)
。
第一学期启东市高三期中考试
化学参考答案
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1 B 2 C 3 B 4 D 5 B 6 C 7 D 8 A
二、选择题(本题包括10小题,每小题4分,共40分)
9 BD 10 D 11D 12BD 13B 14 AB 15D 16AB 17BD 18BC
三、(本题包括2小题,共20分)
19.(8分 每线2分) (1)A; A、B、F; (2)①、③、⑤; (3)B。
20.(12分)(1)2NaNO3 ![]() 2NaNO2+O2↑(2)2Cu(NO3)3
2NaNO2+O2↑(2)2Cu(NO3)3
![]() 2CuO+4NO2↑+O2↑
2CuO+4NO2↑+O2↑
(3)Ⅱ正确,如果Ⅰ正确,则装置②中的气泡应全部消失,不会有液体被压至装置 ③中 (以上每线2分)向装置①中的残留固体加入少量浓硝酸,产生红棕色气体(3分) (4)与硝酸盐中金属的活泼性(3分)
四、(本题包括2小题,共22分)
21、(10分,每个2分)
(1)右表中(2)H
(3)① 右表中
② 2Al+Fe2O3=2Al2O3+2Fe
2Mg+CO2=2MgO+C
22. (12分)(1) B (2分) (2)1、2、3、4 (2分) 2:1 (2分)
产物为氮气和水,不会污染环境 (2分) ⑶ 4OH-―4e-=2H2O+O2↑(2分) H2-2e-+2OH-=2H2O(2分)
![]()
![]() 五、(本题包括2小题,共18分)
五、(本题包括2小题,共18分)
23.(12分)(1)(每线1分)FeSO4 H2SO4 (2) (每线2分)①4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
④4Fe(OH)2+O2+2H2O=4Fe(OH)3 ⑨4Na2SO3![]() 3Na2SO4+Na2S (3)
3Na2SO4+Na2S (3)![]() NA
NA
24.(6分)(1)a c (2分)
(2)2Cl- - 2e- = Cl2↑(2分) 13 (2分)
六、(本题包括2小题,共18分)
25、(1)11.8% (2分) (2)3Na2CO3•NaHCO3•3H2O (4分)
26.(1) 15 < M1 < 18 (2) 减小 增大 (3)15 < M2 < 18 ; 2 < M3 < 28 (每线1分)
(4) D(2分)
(5)若M0<12,则M变小;若M0= 12,则M不变。若M0>12,则M变大(2分)