高三化学11月考试卷
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共150分。考试时间120分钟。
可能用到的相对原子质量:H-1,C-12,O-16,Cu-64
第Ⅰ卷(选择题,共72分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.市场上销售的“84”消毒液,其商品标识上有如下叙述:①本品为无色液体,呈碱性;②使用时加水稀释;③可对餐具、衣物进行消毒,可漂白浅色衣物。“84”消毒液的有效成分可能是( )
A.NaClO B.Cl2 C.SO2 D.KMnO4
2.下列化学式只表示一种纯净物的是( )
![]()
![]() A.P B.CH2Cl2 C.C2H4O2 D.[ CH2-CHCl ]n
A.P B.CH2Cl2 C.C2H4O2 D.[ CH2-CHCl ]n
3.一些家庭常用热碱水(纯碱溶液)来清洗厨房内的油污。下列叙述不符合其中的化学原理的是( )
A.Na2CO3能直接和油脂化合生成可溶性物质
B.Na2CO3溶液呈碱性,在碱性条件下可使油脂类物质发生水解
C.加热可促使Na2CO3水解,使溶液的碱性增强
D.加热有利于加大油脂水解的反应速度
4.下列说法正确的是( )
A.在合成氨的平衡体系中,有1molN≡N键断裂,必有6NA个N-H键同时断裂
B.中子数为1.5NA的重水(D216O)的质量为3g
C.64g铜与足量的硫反应失去2NA个电子
D.1L1mol/L的氢氟酸中含NA个氢离子
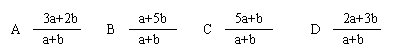 5.某温度下将Cl2通入NaOH溶液中,经测定反应后溶液中ClO-与ClO3-的物质的量浓度之比为a:b,则Cl2与NaOH溶液反应时,被还原的氯元素与被氧化的氯元素的物质的量之比是( )
5.某温度下将Cl2通入NaOH溶液中,经测定反应后溶液中ClO-与ClO3-的物质的量浓度之比为a:b,则Cl2与NaOH溶液反应时,被还原的氯元素与被氧化的氯元素的物质的量之比是( )
6.用惰性电极(如Pt、C)电解物质的量浓度为1mol/L的下列电解质溶液,一段时间后,电解质溶液的浓度增大,且溶液的PH不变的是( )
A.NaOH溶液 B.CuSO4溶液 C.Na2SO4溶液 D.NaCl溶液
7.用同一浓度的氨水分别与50ml醋酸和25ml盐酸完全中和时,都消耗20ml氨水,这表明醋酸和盐酸的关系是( )
A.醋酸的物质的量浓度是盐酸的物质的量浓度的1/2
B.50ml醋酸和25ml盐酸所含溶质微粒的物质的量相同
C.两种酸溶液的PH值相同
 D.完全反应后两溶液的PH值相同
D.完全反应后两溶液的PH值相同
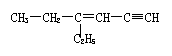
8.某烃的结构简式为
分子中饱和碳原子数为a,可能在同一直线上的碳原子数为b,可能在同一平面上的碳原子数最多为c,则a、b、c分别为( )
A.4、3、7 B.4、3、8 C.2、5、4 D.4、6、4
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或二个选项符合题意。若正确答案只包括一个选项,多选时该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分)
9.下列离子方程式正确的是( )
A.等物质的量的NH4HCO3与NaOH在溶液中反应:
NH4++HCO3-+2OH-=CO32-+NH3↑+2H2O
B.在蓝色的淀粉溶液中通入足量SO2后成无色溶液:
I2+SO2+2H2O=2I-+SO42-+4H+
C.四氧化铁粉末溶于足量的稀HNO3:
Fe3O4+8H+=2Fe2++Fe3++4H2O
D.向Ca(ClO)2溶液中通入足量的CO2气体:
Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
10.已知某溶液能溶解Al2O3、Al(OH)3等两性物质,则该溶液中一定不能大量共存的离子组是( )
A.K+、Fe2+、NO3- B.K+、Na+、SO42-
C.NH4+、Ba2+、Cl- D.K+、Na+、CO32-
11.在铁和铜的混合物中加入不足量的稀硝酸,反应后剩余金属m1g,再向其中改加一定量的稀硝酸,充分反应后剩余金属为m2g,则( )
A.m1一定大于m2 B.m1可能等于m2
C.m1一定等于m2 D.m1可能大于m2
12.A、B、C三种物质各15g,发生反应A+B+C=D,反应后生成30gD,然后在残留物中加入10gA后,反应又继续开始,待反应再次停止后,反应物中只余C。根据以上叙述推断下列说法中正确的是( )
A.第一次反应停止后B剩余9g B.第一次反应停止后C剩余6g
C.反应中A和C的质量比是5:3 D.第二次反应后C剩余5g
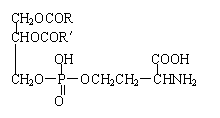 13.在对肿瘤、癌症患者进行化疗时,为了提高药物对病理部位的选择性和治疗的有效性,现代医学采用药物靶向治疗,作为磁性靶向药物的载体—磷脂酰丝氨酸,其结构为:
13.在对肿瘤、癌症患者进行化疗时,为了提高药物对病理部位的选择性和治疗的有效性,现代医学采用药物靶向治疗,作为磁性靶向药物的载体—磷脂酰丝氨酸,其结构为:
则其不可能具有( )
A.既显酸性,又显碱性 B.能发生水解反应
C.能发生缩聚反应 D.能发生加成反应
14.我国科学家合成出世界上最细的碳纳米管,直径仅有0.5nm,与C36分子直径相当。已知C36是由正五边形和正六边形构成的足球分子,在多面体中,棱边数=顶点数+面数-2。根据以上信息,下列有关推断不正确的是( )
A. 碳纳米管与金刚石互为同素异形体
B.这种碳纳米材料分散到适当分散剂中,一定能形成胶体
C.每个C36分子中有18个双键
D.C36分子中有12个正五边形,8个正六边形构成
15.将某些化学知识用数轴表示,可以收到直观现象、简明易记的效果。用数轴表示的下列化学知识中不正确的是( )
A.常温条件下,酚酞的变色范围:
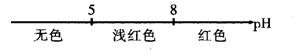
B.分散系的分类:
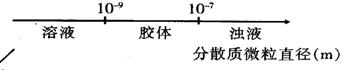
C.AlCl3和NaOH溶液反应后铝元素的存在形式:
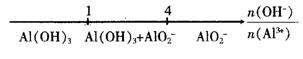
D.CO2与NaOH溶液反应的产物:
![]()
16.一定量混合气体在密闭容器中发生如下反应:xA(g)+yB(g) zC(g),达平衡后测得A气体的浓度为0.5mol/L,当恒温下将密闭容器的容积扩大两倍,再次达平衡。对上述变化的有关叙述正确的是( )
A.若A的浓度大于0.25mol/L,则x+y=z B.平衡一定向左移动
C.B的转化率一定降低 D.C的体积分数可能降低
17.有许多非金属氧化物在一定条件下都能与Na2O2反应,且反应极有规律。如:2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+SO3=2Na2SO4+O2。据此,你认为下列反应方程式中正确的是( )
A.2Na2O2+2SO2=2Na2SO3+O2 B.Na2O2+2NO2=2NaNO2+O2
C.2Na2O2+2Mn2O7=4NaMnO4+O2 D.2Na2O2+2N2O5=4NaNO3+O2
18.第七周期是不完全周期,若将来发现的元素把这一周期全部排满,则下列有关第七周期元素的推论可能错误的是( )
A.第七周期排满时有32中元素,全部是放射性元素
B.第七周期的最后一种元素形成的单质不与任何物质发生化学反应
C.第七周期第ⅦA族元素的原子序数为117,是一种金属元素
D.第七周期第ⅦA族元素的氢氧化物与Al(OH)3具有类似的化学性质
第Ⅱ卷(非选择题,共78分)
三、(本题包括2小题)
19.在加入了几滴酚酞试液的水中加入Na2O2,溶液显红色,几分钟后,红色突然褪去。回答下列问题:
(1)产生该现象的原因可能有:① ;② 。
(2)简述用简单实验证明红色褪去的原因是①或是②: 。
20.喷泉实验是中学化学的一个重要性质实验,同时喷泉也是一种自然现象。其产生原因是存在压强差。试根据下图,回答下列问题:
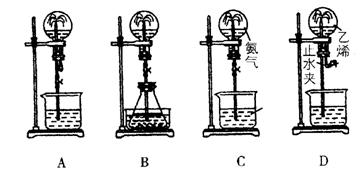
(1)在图A的烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有相同液体。下列组合中不可能形成喷泉的是 。
A.HCl和H2O B.NH3和H2O
C.Cl2和H2O D.CO2和NaOH溶液
(2)在图B的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是 ,这种方法产生喷泉的原理是 。
A.Cu与稀盐酸 B.NaHCO3与NaOH溶液
C.CaCO3与稀硫酸 D.NH4HCO3与稀盐酸
(3)在图B的锥形瓶外放一水槽,锥形瓶中加入酒精,水槽中加入冷水后,再加入足量的下列物质,结果也产生了喷泉。水槽中加入的物质可以是 。
A.浓硫酸 B.食盐 C.硝酸铵 D.硫酸铜
(4)城市中常见的人造喷泉及火山爆发的原理与上述 (填“图A”或“图B”)装置的原理相似。
(5)如果只提供如图C的装置,引发喷泉的方法是 。
(6)图D是用的排水取气法收集的一瓶乙烯,请你根据喷泉原理和乙烯的化学性质,在图D的基础上设计一个方案,使它产生喷泉,力求使水充满整个烧瓶。简述其操作: 。
四、(本题包括2小题)
21.X、Y、Z、W为常见的四种单质,常温下X是固体,Y是液体,Z是无色气体,W为黄绿色气体。其反应关系如下,其中B的溶液显强酸性。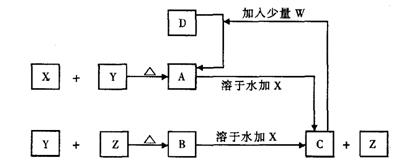
(1)根据反应推断X、Y、Z的化学式:X ,Y ,Z ;
(2)指出X的元素在元素周期表中的位置: ;
(3)写出A溶于水后加入X的离子方程式: ;
(4)写出C与过量W反应的离子方程式: 。
22.如图表示一些常见无机物之间的转化关系:
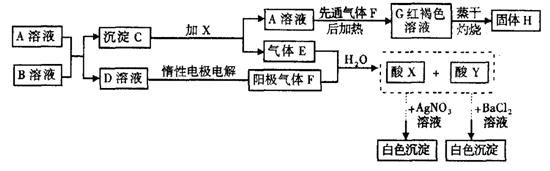
(1)请写出下列物质的化学式:
X ,Y ,H ;
(2)E与F等体积混合溶于水生成X+Y的离子方程式为 ,A与B反应的离子方程式为 ,电解D溶液的离子方程式为 。
五、(本题包括2小题)
23.今有化合物甲: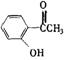 乙:
乙:![]() 丙:
丙:![]()
(1)请写出丙中含氧官能团的名称: ;
(2)请判别上述哪些化合物互为同分异构体: ;
(3)请分别写出鉴别甲、乙、丙三种化合物的方法(指明所选试剂及主要现象)
鉴别甲的方法: ;
鉴别乙的方法: ;
鉴别丙的方法: 。
(4)请按酸性由强到弱排列甲、乙、丙的顺序: 。
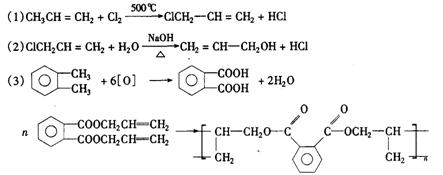
24.一种广泛用于电器、工业交通的工程塑料DAP的结构简式为:
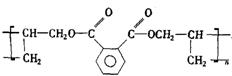
又知甲苯氧化可得苯甲酸,丙烯与氯气在高温条件下发生取代反应生成3-氯-1-丙烯,即:①![]()
②![]()
现以丙烯和邻二甲苯为有机原料,先制取两种有机化合物,再用它们制成DAP工程塑料单体和DAP工程塑料。请写出以丙烯、邻二甲苯为原料制取DAP工程塑料的单体的相关化学方程式。
六、(本题包括2小题)
25.分子中碳原子数不超过3个的有机物a mol在20mol O2中完全燃烧,产物只有CO2和H2O,已知燃烧前后总“物质的量”不发生变化。试回答下列问题:
(1)通过计算确定该有机物可能的分子式;
(2)a的最大值为多少?
26.现有Fe、Cu组成的合金,其中Fe、Cu的总物质的量为a mol,Cu的物质的量分数为x;研成粉末后全部投入含b molHNO3的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO。试回答下列问题:
(1)用微粒符号填写下列空格(列举出全部可能的情况)
| ① | ② | ③ | ④ | ⑤ | ⑥ | |
| 残留固体成分 | ||||||
| 溶液中的金属离子 |
(2)当溶液中金属离子只有Fe2+、Cu2+时,则b的取值范围是(用a、x表示) ;
(3)当x=0.5时,溶液中Fe3+与Fe2+的物质的量相等,在标准状况下共产生672mL 气体。求a、b的值。
参考答案
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
1.A;2.B;3.A;4.A;5.B;6.C;7.A;8.B。
二、选择题(本题包括10小题,每小题5分,共50分;每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且正确的给5分,但只要选错一个,该小题就为0分)
9.B;10.A;11.A;12.D;13.D;14.B;15.A;16.D;17.CD;18.B。
三、(本题包括2小题,共22分)
19.(6分)Na2O2具有漂白作用;空气中CO2与生成的NaOH反应2NaOH+CO2=Na2CO3+H2O,使溶液碱性减弱;往反应后的溶液中滴加NaOH溶液直至过量,若溶液又变为红色,则褪色的原因为②,若溶液不变红色,则褪色的原因为①。
20.(16分)C;D;NH4HCO3与稀盐酸反应产生大量的CO2,使锥形瓶内压强增加而产生喷泉;A;B;打开夹子,用手(或热毛巾等)将烧瓶捂热,NH3受热膨胀,赶出玻璃导管内的空气,NH3与水接触,即发生喷泉;先在一个气球内充入与烧瓶等体积的Cl2或HBr气体,打开止水夹K,从图中胶头滴管处将气球内气体缓缓送入烧瓶内,使其充分反应(其它合理答案也可)。
四、(本题包括2小题,共18分)
21.(9分)Fe;Br2;H2;第四周期第Ⅷ族;Fe+2Fe3+=3Fe2+;
2Fe2++4Br_+3Cl2=2Fe3++2Br2+6Cl-。
22.(9分)HCl;H2SO4;Fe2O3;SO2+Cl2+2H2O=4H++SO42-+2Cl-;
Fe2++SO32-=FeSO3↓;
2Cl-+2H2O 2OH-+H2↑+Cl2↑。
五、(本题包括2小题,共20分)
23.醛基,羟基,甲、乙、丙;与FeCl3溶液作用显色的是甲;与Na2CO3溶液作用有气泡的是乙;与银氨溶液共热会发生银镜反应的是丙;乙>甲>丙。
24.(8分)
六、(本题包括2小题,共16分)
25.(4分)CH2O;C2H6O;20。
26.(12分)
