高三化学 第四单元综合测试卷
一、单选题:(45分)
1.可以将反应Zn+Br2=ZnBr2设计成蓄电池,下列4个电极反应
①Br2+2e=2Br- ②2Br-—2e=Br2 ③Zn-2e=Zn2+ ④Zn2++2e=Zn
其中表示充电式的阳极反应和放电时的负极反应的分别是( )
A.②和③ B.②和① C.③和① D.④和①
2.关于电解NaCl水溶液,下列叙述正确的是( )(全国卷I)
A.电解时在阳极得到氯气,在阴极得到金属钠
B.若在阳极附近的溶液中滴入KI试液,溶液呈棕色
C.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
3.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是( )(天津)(已知:氧化性Fe2+<Ni2+<Cu2+)
A.阳极发生还原反应,其电极反应式:Ni2+ + 2e— == Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
 4.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为(江苏)
4.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为(江苏)
下列叙述不正确的是( )
A.放电时负极反应为:Zn—2e— +2OH—= Zn(OH)2
B.充电时阳极反应为:Fe(OH)3 —3e— + 5 OH— = FeO![]() + 4H2O
+ 4H2O
 C.放电时每转移3 mol电子,正极有1mol K2FeO4被氧化
C.放电时每转移3 mol电子,正极有1mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
5.关于如图所示装置的叙述,正确的是( )(上海)
A、铜是阳极,铜片上有气泡产生
B、铜片质量逐渐减少
C、电流从锌片经导线流向铜片
D、氢离子在铜片表面被还原
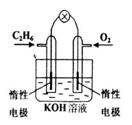 6.燃料电池是目前电池研究的热点之一,现有燃料电池如右图所示,下列有关判断正确的是( )
6.燃料电池是目前电池研究的热点之一,现有燃料电池如右图所示,下列有关判断正确的是( )
(A)通入氧气的电极是正极,该电极上发生还原反应
(B)通入氧气的电极是负极,该电极上发生氧化反应
(C)负极反应是O2 + 4 e—+ 2H2O = 4OH--
(D)正极反应是![]()
7.用惰性电极和串联电路电解下列物质浓溶液①HCl ②NaNO3 ③CuCl2
④AgNO3在相同时间内生成气体总体积(相同状况)在理论上由多到少的顺序是( )
A.④③②① B.①②③④ C.①③②④ D.③④①②
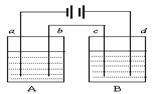 8.如图所示的A、B两个电解池中的电极均为铂,在A池中加入0.05 mol / L的CuCl2溶液,B池中加入0.1 mol / L的AgNO3溶液,进行电解。a、b、c、d四个电极上所析出的物质的物质的量之比是(
)
8.如图所示的A、B两个电解池中的电极均为铂,在A池中加入0.05 mol / L的CuCl2溶液,B池中加入0.1 mol / L的AgNO3溶液,进行电解。a、b、c、d四个电极上所析出的物质的物质的量之比是(
)
A. 2∶2∶4∶1 B. 1∶1∶2∶1
C. 2∶1∶1∶1 D. 2∶1∶2∶1
9.用惰性电极电解一段时间后(溶质都有剩余),甲、乙两池
串联且甲乙两池中溶液的pH值变化趋势相同,且四个电极上的反应产物的物质的量相等的是( )
| A | B | C | D | |
| 甲 池 | HCl(aq) | CuCl2(aq) | NaOH(aq) | H2SO4(aq) |
| 乙 池 | NaCl(aq) | K2SO4(aq) | CuSO4(aq) | AgNO3(aq) |
10.用惰性电极电解某溶液时,发现两极只有H2和O2生成,则电解一段时间后,若电解前后温度变化忽略不计,下列有关溶液叙述正确的有( )
①该溶液的pH可能增大②该溶液的pH可能减小③该溶液的pH可能不变④该溶液的浓度可能增大⑤该溶液的浓度可能不变
A.①②③④⑤ B.只有①②④⑤ C.只有①③⑤ D.只有②③④
11.实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:
负极:Pb+SO42- = PbSO4+2e-
正极:PbO2+4H++SO42-+2e- = PbSO4+2H2O
今若制得Cl2 0.050 mol,这时电池内消耗的H2SO4的物质的量至少是( )
A. 0.025 mol B. 0.050 mol C. 0.10 mol D. 0.20 mol
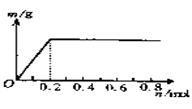 12.用Pt电极电解含有X3+和0.1molCu2+的溶液,阴极析出固体物质的质量m(g)与溶液中通过电子的物质的量n(mol)关系如图所示,则离子
12.用Pt电极电解含有X3+和0.1molCu2+的溶液,阴极析出固体物质的质量m(g)与溶液中通过电子的物质的量n(mol)关系如图所示,则离子
的氧化能力由大到小排列正确的是( )
A、Cu2+>X3+>H+ B、H+>X3+>Cu2+
C、X3+>H+>Cu2+ D、Cu2+>H+>X3+
13.以Pt作电极,用电源电解串联分装在两个烧杯里的300mL0.1mol/LNaCl溶液和200 mL0.3mol/L的AgNO3溶液,过一段时间取出电极,将两杯溶液混合,则对混合溶液的pH判断正确的是( )
A、小于7 B、大于7 C、等于7 D、等于或小于7
14.向电解质溶液中插入M、N电极,并连接直流电源进行电解,可以看到两电极上均有气泡产生。电解后测定电解液中的氢离子浓度无变化,符合这些条件的是( )
(A) 两个电极均为铁片,M是阴极,电解液是0.4%的氢氧化钠溶液
(B) 两个电极均为石墨,M是阳极,电解液是0.4%的硫酸溶液
(C) 两个电极均为石墨,M是阳极,电解液是0.4%的氢氧化钾溶液
(D) M是铁片,N是铂片,M是阴极,电解液是0.4%的硝酸钾溶液
15.将500 ml PH=5的硫酸铜溶液用惰性电极电解一段时间, 溶液PH变为2,若使溶液的浓度.PH与电解前相同,可采取的方法是 ( )
A 向溶液中加入0.245g Cu(OH)2 B 向溶液中加入0.31gCu
C 向溶液中加入0.0025 molH2SO4 D 向溶液中加入0.2gCuO
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 得分 |
第Ⅱ卷(非选择题 共55分)
二、(本题包括2小题,共21分)
16(9分)采用惰性电极从NO3— 、SO42— 、Cl— 、Cu2+、Ba2+、Ag+、H+中选出适当的离子组成电解质,并电解:
⑴若两极分别放出H2和O2,电解质可能为______________________________。
⑵若阴极析出金属,阳极放出O2,电解质可能为__________________________。
⑶若两极均放出气体,且体积比为1 : 1,电解质可能为______________________。
⑷若既无O2也无H2放出,则电解质可能为_________________。
17.(12分,每空2分)已知与外加电源正极相连的电极为电解池的阳极,与外加电源负极相连的电极为电解池的阴极,在以石墨为电极电解时,电解质溶液中的阴离子在阳极发生氧化反应,电解质溶液中的阳离子在阴极发生还原反应,又知阳离子得电子的能力与其对应金属的金属活动性顺序相反(注意:Fe3+>Cu2+>Fe2+ ),阴离子失电子的能力为S2->I->Br->Cl->OH->含氧酸根离子>F-。如图所示:以石墨为电极电解A的水溶液,并做下面一系列实验,试根据实验现象完成下列问题。电解质A的水溶液焰色反应呈浅紫色。
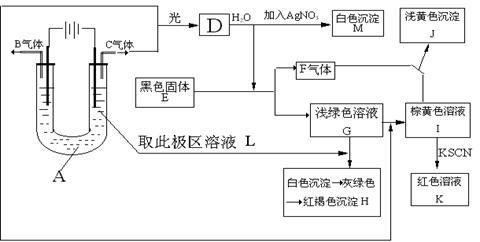
(1)、写出A的化学式为 ,E的名称为 。
(2)、I与F作用的离子方程式是
(3)、G加入L后产生的白色沉淀到生成红褐色沉淀H的化学方程式:
(4)、用两个最直接的离子方程式来证明Fe3+、Cu2+、Fe2+的氧化性强弱顺序是Fe3+>Cu2+>Fe2+
① ②
18.(共10分)据报道,最近摩托罗拉(MOTOROLA)公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用1个月才充电一次。假定放电过程中,甲醇完全氧化产生的CO2被充分吸收生成CO32-。
(1)该电池反应的总离子方程为 ;
(2)甲醇在 极发生反应(填正或负),电池在放电过程中溶液的pH将 (填“下降”或“上升”、“不变”);若有16克甲醇蒸汽被完全氧化产生电能,并利用该过程中释放的电能电解足量的CuSO4溶液,(假设整个过程中能量总利用率为80%),则将产生标准状况下的O2 升。
(3)最后,又有科学家制造出一种使用固体电解质的燃料电池,其效率更高。一个电极通入空气,另一个电极通入汽油蒸汽。其中固体电解质是掺杂了Y2O3(Y:钇)的ZrO2(Zr:锆)固体,它在高温下能传导O2-离子(其中氧化反应发生完全)。以丁烷(C4H10)代表汽油。
 ①电池的正极反应式为
;
①电池的正极反应式为
;
②放电时固体电解质里的O2-离子的移动方向是向 极移动
(填正 或负)。
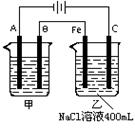
19.(10分)如图所示,为相互串联的甲乙两电解池, 试回答:
⑴甲池若为用电解原理精炼铜的装置,A是_______极,材料为
_______,电极反应为_______________________,B是_____极,
材料为_______,电极的主要反应为_________________________,
电解质溶液为________。
⑵乙池中若滴入少量酚酞试液,开始电解一段时间,Fe极附近呈 ________色。
⑶若甲槽阴极增重12.8g,则乙槽阳极放出气体在标准状况下的体积为_______。 ⑷若乙槽剩余液体为400mL,则电解后得到碱液的物质的量浓度为_______,pH为
三、计算题:
20.(8分) 20℃时食盐溶解度为36克,取一定量20℃的饱和食盐水用惰性电极进行电解,当电路中有2.5 mol电子转移时, 食盐完全电解,所得溶液密度为1.23g/ml,试计算:
(1) 电解时,所取饱和食盐水的质量
(2) 电解后溶液中NaOH的物质的量的浓度
(3) 要使溶液恢复原状态,需加入多少克什么物质?
21、(6分)电子工业常用FeCl3溶液腐蚀铜制线路板的反应为2FeCl3+Cu==2FeCl2+CuCl2,
现将一块铜线路板浸入120ml FeCl3溶液中,过一段时间,发现有9.6克铜被腐蚀掉,取出线路板,向溶液中加入8.4克铁粉,经充分反应后溶液中还在4.8克不溶物.试分析判断溶液中存在哪些金属离子,并求出其离子浓度(假定溶液体积不变).
参考答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| A | B | D | C | D | A | B | A |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | |
| A | A | C | D | A | D | D |
16. ⑴ H2SO4 HNO3 Ba(NO3)2 ⑵ CuSO4 Cu(NO3)2 Ag NO3 ⑶HCl BaCl2
⑷ CuCl2
17. (1)A:KCl(2分) E:硫化亚铁(2分)
(2)2Fe3++H2S=2Fe2++S↓+2H+(2分)
(3) 4Fe(OH)2+O2+2H2O=4Fe(OH)3 (2分)
(4)①2Fe3++Cu=2Fe2++Cu2+、(2分) Fe+Cu2+=Fe2++Cu↓(2分)
18.(1) 2CH3OH + 3O2 +4OH-
→2CO![]() + 6H2O
+ 6H2O
(2)负; 下降; 13.44
(3)① O2 + 4e = 2O2- ; ② 负
19.(1) 阴 纯铜片Cu2++2e-= Cu 阳 粗铜板 Cu-2e-= Cu2+、、 硫酸铜溶液 ⑵红 ⑶4.48L ⑷1mol/L 14
20.(1)552.5 g(2)6.67 mol/L(3)91.25 g
21. Fe2+ 5 mol/L Cu2+ 0.625 mol/L