高考化学速率和平衡图像分析
1.解题步骤(三步曲)
(1)看懂图像:看图像要五看。一看面,即看清横坐标和纵坐标的意义;二看线,即看线的走向和变化趋势;三看点,即看曲线的起点、终点、交点、拐点、原点、极值点等;四看辅助线,即要不要作辅助线,如等温线、等压线;五看量的变化,即定量图像中有关量的多少,如浓度变化、温度变化等。
(2)联想规律:即联想外界条件的改变对化学反应速率和化学平衡的影响规律。
(3)推理判断:根据给定的化学反应和图像中呈现的关系与所学规律相对比,作出符合题目要求的判断。
2.解题技巧
(1)“定一议二”:在含量-T/p曲线中,图像中出现三个量,先确定一个量不变(作等温线或等压线),再讨论另外两个量的变化关系(因平衡移动原理只适用于“单因素”的改变)。
(2)“先拐先平,温高压大”:在含量(或转化率)-时间曲线中,先出现拐点的曲线则先达到平衡,说明该曲线所表示的温度较高或压强较大。
3.常见类型
(1)平衡建立的过程图
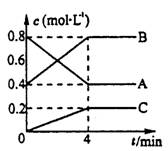 【例1】600℃时,A、B、C三种气体在密闭容器中浓度的变化情况如图所示,仅从图上分析不能得出有关A的结论的是( )
【例1】600℃时,A、B、C三种气体在密闭容器中浓度的变化情况如图所示,仅从图上分析不能得出有关A的结论的是( )
A.A是反应物
B.前4minA是分解速率是0.1 mol/(L·min)
C.4min后,若升高温度,A的转化率增大。
D.4min后,若增大压强,A的转化率减小。
(2)速率(v)-时间(t)图(简称v- t图)
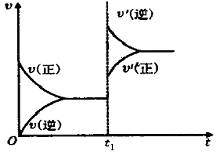 【例2】对于已达到平衡的可逆反应:N2(g)+3H2(g)
【例2】对于已达到平衡的可逆反应:N2(g)+3H2(g)![]() 2NH3(g);ΔH<0,为使正逆反应速率符合右图,应采取的措施是( )
2NH3(g);ΔH<0,为使正逆反应速率符合右图,应采取的措施是( )
A.增大N2的浓度
B.升高温度
C.增大压强
D.增大NH3的浓度
(3)量值-条件-时间图
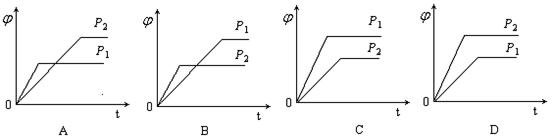
【例3】(lz2005-bj-7)在一定温度不同压强(p1<p2)下,可逆反应2X(g)![]() 2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(
2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(![]() )与反应时间(t)的关系有以下图示,正确的是
)与反应时间(t)的关系有以下图示,正确的是
(4)量值-条件图
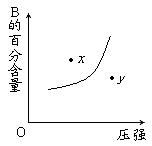 【例4】对于mA(s)+nB(g)
【例4】对于mA(s)+nB(g)![]() pC(g);ΔH<0的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是( )
pC(g);ΔH<0的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是( )
A.m+n<p
B.n>p
C.x点的状态是v正>v逆
D.x点比y点的反应速率慢
(5)量值-时间图
【例5】(hx2004-js-18)在容积固定的密闭容器中存在如下反应:A(g)+3B(g)![]() 2C(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
2C(g);ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
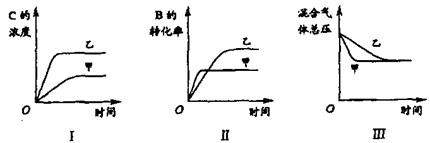
下列判断一定错误的是
A.图Ⅰ研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高
B.图Ⅱ研究的是压强对反应的影响,且甲的压强较高
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
(6)速率-条件图
【例6】图中C%表示某反应物在体系中的百分含量,v表示反应速率,p表示压强,t表示反应时间。图Ⅰ为温度一定时压强与反应速率的关系曲线;图Ⅱ为压强一定时,在不同时间C%与温度的关系曲线。同时符合以下两个图像的反应是( )
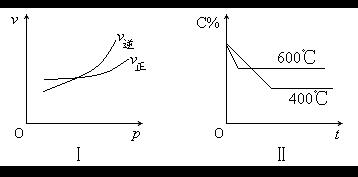
A.4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g);ΔH<0
4NO(g)+6H2O(g);ΔH<0
B.N2O3(g)![]() NO2(g)+NO(g);ΔH>0
NO2(g)+NO(g);ΔH>0
C.3NO2(g)+H2O(l)![]() 2HNO3(aq)+NO(g);ΔH<0
2HNO3(aq)+NO(g);ΔH<0
D.2CO(g)![]() CO2(g)+C(s);ΔH<0
CO2(g)+C(s);ΔH<0
答案:
1.C 2.B 3.B 4.CD 5.AB 6.A