高考化学选择题(一)
(全卷79分)
一、选择题(本题包括9小题,每小题3分,共27分。每小题只有一个选项符合题意。)
1. 下列溶液一定是碱性的是
A. 滴加甲基橙后溶液显红色 B. 滴加甲基橙后溶液显黄色
C. 溶液中含有OH-离子 D. 溶液中c (OH-)>c(H+)
2. 有机物A和B只由C、H、O中二种或三种元素组成;等物质的量的A和B完全燃烧时,消耗相等物质的量的氧气,则A和B的相对分子质量的差值(其中n为正整数)不可能为
A. 8n B. 14n C. 18n D. 44n
3. 已知铅蓄电池放电时发生如下反应:
负极:Pb+SO42-=PbSO4+2e-
正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O
实验室用铅蓄电池作电源,用惰性电极电解CuSO4溶液,当阴极析出2.4g铜
时,铅蓄电池内消耗H2SO4物质的量至少是
A. 0.050mol B. 0.075mol
C. 0.20mol D. 0.40mol
4. 要求设计实验证明,某种盐的水解是吸热的,下列回答正确的是
A. 将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的
B. 在盐酸中加入相同浓度的氨水,若混合液温度下降,说明盐类水解是吸热的
C. 在醋酸钠溶液中加入醋酸钠晶体,若溶液温度下降,说明盐类水解是吸热的
D. 在醋酸钠溶液中滴入酚酞试液,加热后若红色加深,说明盐类水解是吸热的
5.取n g某物质在氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量恰好也增加了ng。下列物质中不能满足上述结果的是
A.H2和CO的混合气 B.C2 H2O2
C.C3 H6O3 D. C6 H12O5
6.用惰性电极实现电解,下列说法正确的是
A、电解氢氧化钠溶液,要消耗OH一,故溶液pH减小
B、电解稀硫酸溶液,实质上是电解水,故溶液pH不变
C、电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1:2
D、电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1
7.在10 mL 0.1mol·L—1,NaOH溶液中加入同体积、同浓度的CH3COOH溶液,反应后溶液中粒子的浓度关系不正确的是
A.c(Na+)>c(CH3COO一)>c( OH一)>c(H+)
B.c(Na+)>c(CH3COO一)>c(H+)>c(OH一)
C. c(Na+)=c(CH3COO一)+c(CH3COOH)
D.c(Na+)+c(H+)=c(CH3COO一)+c(OH一)
8. 将一定体积的NaOH溶液分成两等份,一份用pH=2的一元酸HA溶液中和,消耗酸溶液的体积为V1;另一份用pH=2的一元酸HB溶液中和,消耗酸溶液的体积为V2;则下列叙述正确的是
A. 若V1>V2,则说明HA的酸性比HB的酸性强
B. 若V1>V2,则说明HA的酸性比HB的酸性弱
C. 因为两种酸溶液的pH相等,故V1一定等于V2
D. 若将两种酸溶液等体积混合,混合酸溶液的pH一定等于2
9. . 已知当物质的量浓度相同时,碳酸中c(CO32-)比偏铝酸中c(AlO2-)大得多,则下列推论中正确的是
A. 通入适量CO2于AlO2-溶液中,有CO32-生成
B. 含CO32-的溶液容易使Al(OH)3溶解变成AlO2-
C. HCO3-只能与Al3+反应而不能和AlO2-反应
D. NH4+、AlO2-和HCO3-能大量共存于同一溶液中
二、选择题(本题包括13小题,每小题4分,共52分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
10、NaH是离子化合物,与水反应可生成碱和氢气。现有NaH与Al粉混合物共m g,跟足量水反应共收集到H2的质量为n g,则原混合物中Al粉的质量为
A、 (36n-3m)g B、(12n-m)g C、(m-24n/5)g D、 (24m-5n)g
11、室温下,甲酸与氢氧化钠溶液反应后的溶液中满足以下关系:
c(HCOOH) > c(HCOO—) > c(Na+) > c(H+) > c(OH—) 的是
A、0.2mol/L甲酸溶液与0.1mol/L氢氧化钠溶液等体积混合
B、甲酸溶液与氢氧化钠溶液混合后,溶液呈中性
C、等浓度、等体积的甲酸溶液与氢氧化钠溶液混合
D、PH=2的甲酸溶液与PH=12的氢氧化钠溶液等体积混合
12、葡萄糖的分子式为C6H12O6,通过缩合反应把10个葡萄糖分子连接起来所形成的链状化合物的化学式为
A、C60H100O50 B、C60H120O60 C、C60H102O51 D、C60H112O51
13.用惰性电极电解某溶液时,发现两极只有H2和O2生成。则电解一段时间后,下列有关该溶液(与电解前同温度)的说法中,正确的有
(1)该溶液的PH值可能增大; (2)该溶液的PH值可能减小;
(3)该溶液的PH值可能不变; (4)该溶液的浓度可能增大;
(5)该溶液的浓度可能不变; (6)该溶液的浓度可能减小。
A、三种 B、四种 C、五种 D、六种
14. A、B、C均为短周期元素,A、B同周期, A、C的最低价离子分别为A2-和C-,B2+和C-具有相同的电子层结构,下列说法中正确的是
A.原子序数:A>B>C B.原子半径:A>B>C
C.离子半径:A2->C->B2+ D.原子核外最外层电子数:A>C>B
15.下列离子方程式书写正确的是
A.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:
Ba2+ + OH- + H+ + SO42- == BaSO4↓+ H2O
B.将过量的NaOH溶液滴入同浓度的少量Ca(HCO3)2溶液
Ca2+ + 2HCO3—+2OH—====CaCO3↓+ 2H2O + CO32—
C.醋酸钡溶液和硫酸反应:Ba2++SO42-== BaSO4↓
D.向酸性FeSO4溶液中加H2O2溶液:
2Fe2+ + 2H2O2 + 4H+ ==2Fe3+ + 4H2O
16.容积相同的甲、乙密闭容器,甲为恒容、乙为恒压,分别充入2 molSO2和1 mol O2,同时发生反应: 2SO2(g)+O2(g)=2SO3(g),同温度下分别达到平衡,测得甲中SO2的转化率为25%,下列说法中正确的是
A.反应过程中甲容器中的反应速率比乙中的大
B.甲容器反应达到平衡时所需时间比乙容器少
C.乙容器中SO2的转化率大于25%
D.平衡时,乙容器中SO2、O2、SO3的浓度之比一定为2:1:2
17.除去下列物质中所含杂质(括号内为杂质),选用的试剂或分离方法正确的是
序号 混合物 试剂 分离方法
A. 亚硫酸钠(硫酸钠) BaCl2溶液 过滤
B. 二氧化碳(氯化氢) 饱和NaHCO3溶液 洗气
C. 乙酸乙酯(乙酸) NaOH溶液 蒸馏
D. 淀粉(氯化钠) 蒸馏水 渗析
18.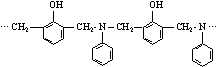 下列结构的化合物,具有较好的耐热性、耐
下列结构的化合物,具有较好的耐热性、耐
水性和高绝缘性。用缩聚反应制取它时,所用的单体不需要有的是
A.![]() B.CH3OH C.
B.CH3OH C.![]() D.HCHO
D.HCHO
19.pH相同的盐酸和醋酸溶液分别和锌反应,若最后锌都已完全溶解,但放出的气体一样多,则下列判断正确的是
A.整个反应阶段平均反应速率:醋酸>盐酸
B.反应所需时间:醋酸>盐酸
C.参加反应的锌的质量:醋酸=盐酸
D.开始反应速率:盐酸>醋酸
20.常温下,在溶液中可以发生反应:X+2Y3+=2Y2++X2+,则下列叙述①X被氧化;②X是氧化剂;③X具有还原性;④Y2+是氧化产物;⑤Y2+具有还原性;⑥Y3+的氧化性比X2+的氧化性强。以下叙述中正确的是
A.②④⑥ B.①③④ C.①③⑤⑥ D.②⑤
21.A、B为短周期元素,二者可以组合成多种中学生所熟悉的物质,在这些化合物中A与B的原子个数比为1︰1,已知A的原子叙述为n,B的原子序数为是①n+7 ②n+5
③n+8 ④n+6 ⑤n-2 ⑥n+1 ⑦n-3, 其中可能的是
A.只有①②③ B.只有④⑤⑥⑦ C. 只有①③⑤⑦ D.全部
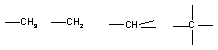
22.在烷烃分子中的基团中的碳原子分别称为
伯、仲、叔、季碳原子,数目分别用n1、n2、n3、n4表示,例如:
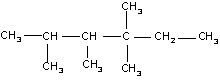
n1=6 n2=1 n3=2 n4=1设n0为分子中的氢原子,则下列说法不正确的是
A.n0=2(n1+ n2 + n3+n4) B. n0=3n1+ 2n2 + n3
C.n1= n3+2n4+2 D.n1= n2 + n3+n4