高考化学选择题测试(六)
命题:王军
(本试卷已获得相关保护,没有wjchzx授权不得上传和转载,否则后果自负)
注意事项:
1.答卷前,考生务必用黑色字迹的钢笔或签字笔将自己的姓名和考生号填写在答题卡上,用2B铅笔将试卷类型在答题卡上填涂为A。
2.每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案。
4.考生必须保持答题卡的整洁。考试结束后,将本试卷和答题卡、答题纸一并交回。
(全卷82分)
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意的)
1..下列对生产、生活有关化学问题的分析正确的是
A.液氯罐中的液氯泄漏时,可将其移入水塘中,并向水塘中加入生石灰
B.铝合金的大量使用归功于人们能用焦炭等还原剂从氧化铝中获取铝
C.面粉生产车间不允许吸烟的原因是防止面粉被尼古丁污染
D.发现矿井中瓦斯超标时应继续生产,不要吸烟
2.下列说法中正确的是
A.极易溶于水的气体在水中均能与水分子形成氢键
B.离子化合物在熔融状态下与在水中电离成的离子完全相同
C.含有极性键的分子一定是极性分子
D.在NaCl的晶体中与中心Na+等距离的Na+有12个
3.烧过莱的铁锅未及时洗涤(残液中含NaCl等),第二天便出现红棕色锈斑[Fe2O3·XH2O失水的产物]。下列反应表示整个过程可能发生的变化,其中不符合事实的是
①2H2O+O2+4e- = 4OH- ②Fe— 3e-= Fe3+ ③Fe2++2OH-= Fe(OH)2
④4Fe(OH)2+O2+2H2O=4 Fe(OH)3 ⑤2Fe3++Fe=3Fe2+
⑥2 Fe(OH)3=Fe2O3·XH2O+(3—x)H2O
A.①③ B.②⑤ C.④⑥ D.①⑥
4.下列各组溶液在只有水和试管的情况下,达不到鉴别目的的是
A.溴乙烷、乙醇、乙酸乙酯 B.CaCO3、NaHSO4、CaC2、Mg(OH)2四种固体
C.Na2O2、CaCl2、CuSO4、硫磺 D.NaCl、Na2SO4、AlCl3、Mg3N2四种固体
5.金属元素R的两种含氧酸中,其中最高价氧化物的水化物分子式为HxROy,另一种为HxROy-1。则下列叙述中错误的是
A.R的族序数为2y-x B.当y=4时,R的最低价氢化物为HxR
C.酸性:HxROy>HxROy-1 D.前者与后者中R的化合价相差y-x
6.下列关于反应能量的说法正确的是
A.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s);△H = -216kJ.mol-1,E反应物>E 生成物B.CaCO3(s)=CaO(s)+CO2(g); △H = +178.5kJ.mol-1, E生成物>E反应物
C.HI(g)=![]() H2(g)+
H2(g)+![]() I2(s); △H = -26.5kJ.mol-1
I2(s); △H = -26.5kJ.mol-1
1molHI在密闭器中分解达平衡后放出26.5kJ的能量
D.H+(aq)+OH-j(aq)=H2O(l); △H = -57.2kJ.mol-1
含1L 1mol/L的NaOH溶液与含0.5molH2SO4的浓硫酸混合后放热57.2kJ
7.充分燃烧一定质量的C4H10放出的热量大小为Q,生成的CO2恰好能被50mL、10mol/L的NaOH所吸收,设1mol C4H10完全燃烧放出的热量为x,下列说法一定正确的是
A.x=8Q B. x=16Q C. 8Q≤x≤16 Q D. 8Q<x<16 Q
8.图示是某种含有C、H、O、N的有机物简易球棍模型。关于该有机物的说法不正确的是
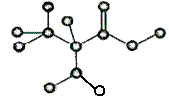 A.化学式为C3H7NO2
A.化学式为C3H7NO2
B.可通过缩合反应生成高分子
C.不能和盐酸反应
D.能和NaHCO3溶液反应生成CO2
9.下列实验中,仪器的下端必须插入液面下的是
①制备氢气的简易装置中的长颈漏斗; ②制备氯气装置中的分液漏斗;
③制备Fe(OH)2操作中的胶头滴管; ④将氯化氢气体溶于水时的导管
⑤用乙醇制取乙烯时的温度计; ⑥分馏石油时的温度计
A. ①③④⑤ B. ②④⑥ C. ①③⑤ D. 全部
10.向pH=1的某酸溶液和pH=13的氢氧化钠溶液中,加入足量的铝片,放出H2的物质的量之比为3: 1其原因可能是
A.两溶液的体积相同,酸是多元强酸
B.若酸为一元强酸,酸溶液的体积是碱溶液体积的3倍
C.两溶液的体积相同,酸是弱酸
D.酸是强酸,且酸溶液的浓度比NaOH溶液浓度大
二、选择题(本题包括13小题,每小题4分,共52分。每小题有一个或两个选项符合题
意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
11.在25℃时,浓度均为1 mol/L 的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2(硫酸亚铁铵)三种溶液中,测得其中c(NH4+)分别为 a、b、c(mol/L),则下列判断正确的是
A.a>b>c B.c>a>b C.b>a>c D.a>c>b
12.经X射线证明,PCl5在晶体状态时,由分别是正四面体和正八面体的两种离子构成,关于PCl5在晶体的推断正确的是
A.由[ PCl3 ]2+ 和[ PCl7 ]2-离子构成,且数目之比为1:1
B.由[ PCl4 ]+ 和[ PCl6 ]—离子构成,且数目之比为1:1
C.PCl5固体是离子晶体
D.PCl5晶体具有良好的导电性
13.把质量分别为mg的三根铜丝灼烧变黑后做如下处理,下列说法不正确的是
A.分别放入硫酸、硝酸、盐酸溶液中一段时间,固体质量小于mg
B.分别用乙醇、氢气、一氧化碳还原后,固体质量为mg
C.分别放入烧碱、CaCl2溶液、FeSO4溶液中一段时间,固体质量等于mg
D.分别放入浓硫酸、浓硝酸、浓FeCl3溶液中一段时间,固体质量小于mg
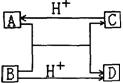 14.已知A, B, C, D四种不同粒子,它们之间存在如右图关系,若
14.已知A, B, C, D四种不同粒子,它们之间存在如右图关系,若
A、 B、C、D均为10电子的粒子,则下列说法不正确的是
B.微粒A与Na+的核外电子数和质子数相同
C.微粒C、D分子之间可以形成氢键
D.微粒C溶于微粒D中会有微粒A和B存在
D.微粒D与Na+的核外电子数和质子数相同
15.下列各溶液中,微粒的物质的量浓度关系正确的是:
A.10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合:
c(Cl-)>c(Na+)>c(H+)>c(OH-)
B.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
D.c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:
c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl)
16..已知卤代烃在碱性条件下,易水解。某有机物的结构简式如下:
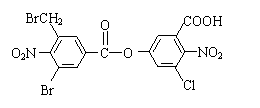
lmol该有机物与足量的NaOH溶液混合共热,充分反应最多可消耗amolNaOH,将所得溶液蒸干后再与足量的碱石灰共热,又消耗bmolNaOH,则a与b的值分别是
A.5mol,10mol B.6mol,2mol C.8mol,4mol D.8mol,2mol
17.1.92gCu投入一定量的浓硝酸溶液中,铜完全溶解,生成气体的颜色越来越浅,共收集到S、P、T时672mL气体。将盛有此气体的容器倒扣在水中,通入标况下一定量体积的氧气恰好使气体完全溶于水,则通入氧气的体积是
A.504mL B.168mL C.224mL D.336mL
18.某含结晶水的无色透明晶体,可能是明矾或草酸晶体,为确定其成分,某校化学兴趣小组的同学设计了几种方法:①检验K+;②溶于水检验Al3+;③溶于水利用胶体性质进行检验;④溶于水用石蕊试液检验;⑤与浓硫酸混合共热,将产生的气体用澄清石灰水检验;⑥溶于水再用碳酸钠溶液检验;⑦溶于水再用酸化的高锰酸钾溶液检验。你认为其中正确的是:
A.全部正确 B.有6个正确
C.有5个正确 D.有4个正确
19.如图,Ⅰ是恒压密闭容器,Ⅱ是恒容密闭容器。其它条件相同时,在Ⅰ、Ⅱ中分别加入3mol Z,起始时容器体积均为V L,发生如下反应并达到平衡(X、Y状态未知):aX(?)+2Y(?)![]() 3Z(g)。此时Ⅱ中X、Y、Z的物质的量之比为3:2:2,则下列说法一定正确的是
3Z(g)。此时Ⅱ中X、Y、Z的物质的量之比为3:2:2,则下列说法一定正确的是
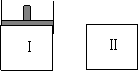
A.若X、Y均为气态,则平衡时气体平均摩尔质量:Ⅰ>Ⅱ
B.若X、Y不均为气态,则平衡时X的产率:Ⅰ>Ⅱ
C.若X、Y均为气态,则从起始到平衡所需时间:Ⅰ>Ⅱ
D.若X为固态,Y为气态,到达平衡后若在Ⅱ中再加入1molZ,则新平衡时Z的体积
分数变小
20.一定状况下,8gA和17gB的混合气体的体积为672mL,相同状况下,4gA和14gB的混合气体的体积为448mL,A、B可能是下列各组中的
A.乙烯和乙炔 B.乙炔和苯 C.甲烷和甲醇 D.环己烷和1—丁烯
21.室温时,容积为amL的试管里充满NO2气体,然后倒置在水中到管内水面不在上升为止,在通入bmLO2,则管内液面又继续上升。测得管内最后剩余气体为cmL,且该气体不能支持燃烧。则下列关系正确的是
A.a=4b+3c B.a=4c+b C.a=4b D.3a=4b
22.2005年度的诺贝尔化学奖分别奖给美国和法国的三位科学家,表彰他们对“烯烃复分解”反应研究方面作出的贡献。“烯烃复分解”是指在金属钨或钼等催化剂的作用下,碳碳双键断裂并重新组合的过程。例如:
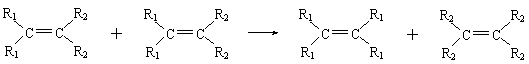 |
则对于有机物CH2=CHCH2CH=CH2发生烯烃复分解反应时可能生成产物的判断中正确的是
![]()
![]() ① ;②CH2=CH2;③
;④CH2=C=CH2
① ;②CH2=CH2;③
;④CH2=C=CH2
A.只有①②③ B.只有①② C.只有③ D.只有③④
23.常温下,A和B两种气体混合而成的混合气体(A的式量大于B的式量),经分析,已知只含有碳和氧两种元素,而且无论A和B以何种比例混合,氧和碳元素的质量比总是大于8/3。若上述混合气体氧、碳元素质量比为8/1,则A和B的分子个数比是:
①1 :1 ②1 :2 ③2 :1 ④4 :1 ⑤4 :3
A.①② B.②③ C.②④ D.③⑤