高考化学中涉及新课标的部分考点信息题
1.电离能
电离能是指1mol气态原子(或阳离子)失去1mol电子形成1mol气态阳离子(或更高价阳离子)所需吸收的能量。现有核电荷数小于20的元素A,其电离能数据如下:(I1表示原子失去第1个电子的电离能;In表示原子失去第n个电子的电离能。单位:eV)
| 序 号 | I1 | I2 | I3 | I4 | I5 | I6 |
| 电离能 | 7.644 | 15.03 | 80.12 | 109.3 | 141.2 | 186.5 |
| 序 号 | I7 | I8 | I9 | I10 | I11 | …… |
| 电离能 | 224.9 | 266.0 | 327.9 | 367.4 | 1761 | …… |
(1) 外层电子离核越远,能量越高,电离能越__________(填“大”或“小”);阳离子电荷数越高,再失去电子时,电离能越__________。(填“大”或“小”)
(2) 上述11个电子分属几个电子层?____________________。
(3) 失去了11个电子后,该元素还有__________个电子。
(4) 该元素最高价氧化物对应水化物的化学式是:______________________________。
答案:(1)小 ;大 (2)3 (3)1 (4)Mg(OH)2
N
2.电负性
1932年美国化学家鲍林(L.Pauling)首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
请仔细分析,回答下列有关问题:
(1)预测周期表中电负性最大的元素应为______;估计钙元素的电负性的取值范围:
____<X<____。
(2)根据表中的所给数据分析,同主族内的不同元素X的值变化的规律是____________
______________________________;简述元素电负性X的大小与元素金属性、非金属性之间的关系__________________________________________________________________。
(3)经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为________,其理由是______________________________________________________。
答案:(1)F 0.8<X<1.2 (2)从上向下X值减小 元素电负性越大,非金属性越强,金属越弱;反之亦然 (3)共价键 因为AlCl3中Cl和Al的电负性差值为1.5,而Br的电负性小于Cl,所以AlBr3中两元素的电负性差值小于1.5
3.元素化合物
向100mLBaCl2、AlCl3和FeCl3的混合溶液A中,逐滴加入NaSO4和NaOH的混合溶液B,产生的沉淀和加入溶液B的体积关系如右图所示:
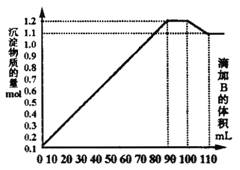
(1)当加入B溶液110 mL时,溶液中的沉淀是________________(填化学式).
(2)溶液B中NaSO4与NaOH的物质的量浓度之比________________;从90 mL至100 mL之间加入10 mL B溶液时所发生的离子反应方程式是________________.
(3)将A、B溶液中各溶质的物质的量浓度填入下表:
| 溶质 | NaSO4 | NaOH | BaCl2 | AlCl3 | FeCl3 |
| 浓度mol/L |
(4)O—V1阶段总反应的离子方程式为_________.
(5)O--V3阶段反应的离子方程式为________.
(6)V1—V2阶段总反应的离子方程式为________.
解析:①溶液中Fe3+被完全沉淀出后,Al3+才开始沉淀.图中曲线第二段为平行直线,沉淀总物质的量没有增减.故这段是因Al(OH)3的溶解和BaSO4的继续生成导致,且溶解的Al(OH)3的物质的量和生成的BaSO4物质的量相等.故加入的物质:[NaOH]=[NaSO4]这段的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O Ba2++SO42_=BaSO4
②第一段生成的沉淀为BaSO4、Fe(OH)3和Al(OH)3,且B为90 mL时,Fe3+、AL3+恰好沉淀完全.这段反应的离子方程式为:Ba2++SO42_=BaSO4,Fe3++3OH_ = Fe(OH)3,AL3++3OH_= Al(OH)3
③图中曲线第三段(100-110 mL),B为100 mL时Ba2+恰好沉淀完全.这段中Al(OH)3继续溶解,B为110 mL时,沉淀中Al(OH)3已完全溶解.这段中溶解了0.O1mol Al(OH)3,消耗了10 mL NaOH,故[NaOH]=1mol/L,则100 mL时,共加入NaSO4为0.1 mol,共生成BaSO4O.1mol,故A溶液中[Ba2+]=1mol/L.这段Al(OH)3溶解的离子方程式为:
Al(OH)3+OH-=AlO2-+2H2O
④图中曲线第四段中,沉淀为Fe(OH)3、BaSO4共0.11 mol,则为Fe(OH)30.11 mol,A中[Fe3+]=0.1mol/L.
⑤第二、三段间共消耗NaOH20mL,则共溶解的为Al(OH)30.02 mol,则A中[Al3+]=0.2mol/L.