高三化学第一学期期中考试3
基本概念和基本理论
考试时间120分钟 满分150分
可能用到的相对原子质量:H=1 C=12 O=16
一、选择题(共9小题,每小题3分,共27分,每小题只有一个选项符合题意)
1.从20世纪20年代起,就有人预言可能存在由4个氧原子构成的氧分子,但一直没有得到证实。最近,意大利一所大学的科学家使用普通氧分子和带正电的氧离子制造出了它存在的证据。若该氧分子具有空间对称结构,你认为该氧分子是
A.氧元素的一种同位素 B.臭氧的同素异形体
C.一种新的氧化物 D.可能是极性键构成的极性分子
2.若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化。在变化的各阶段被破坏的粒子间的相互作用依次是
A.氢键; 分子间作用力; 非极性键
B.氢键; 氢键; 极性键
C.氢键; 极性键; 分子间作用力
D.分子间作用力; 氢键; 非极性键
3.下列物质中,酸性由强到弱错误的是( )
A. HClO4 H2SO4 H3PO4 HSiO4
B.HClO4 HClO3 HClO2 HClO
C.H2SO4 H2SO3 HNO3 HNO2
D.HClO4 H2SO4 H2SO3 H2CO3
4.下列过程中,共价键被破坏的是
A.碘升华 B.溴蒸气被木炭吸附
C.蔗糖溶于水 D.SO2气体溶于水
![]() 5.下列表达式错误的是
5.下列表达式错误的是
![]()
A.甲烷的电子式:
B.氮原子的L层电子轨道表示式:
C.硫离子的核外电子排布式:1s22s22p63s23p4
D.碳-12原子:12 6C
6.已知水分子结构可看为H—OH ,根据“相似相溶”原理,常温下在水中的溶解性最好的是
A.苯酚 B.甲醇 C.丁醇 D.乙烯
7.在25℃、101kPa下,1g乙醇完全燃烧生成CO2和液态水时放热29.72kJ,下列热化学方
程式正确的是 ( )
A.CH3CH2OH(l)+3O2(g)=2CO2(g)+ 3H2O(l);△H=+1367kJ/mol
B.2CH3CH2OH(l)+6O2(g)=4CO2(g)+ 6H2O(l);△H=-2734kJ/mol
C.2CH3CH2OH(l)+6O2(g)=4CO2(g)+ 6H2O(l);△H=-1367kJ/mol
D.2CH3CH2OH(l)+6O2(g)=4CO2(g)+ 6H2O(l);△H=+2734kJ/mol
8.一定条件下反应N2(g)+3H2(g)
![]() 2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内N2的反应速率为
2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内N2的反应速率为
A.1.2mol/(L·min) B.1mol/(L·min)
C.0.6mol/(L·min) D.0.4mol/(L·min)
9.已知450℃时,反应H2(g)+I2(g)
![]() 2HI(g)的K=50,由此推测在450℃时,反应2HI(g)
2HI(g)的K=50,由此推测在450℃时,反应2HI(g)
![]() H2(g)+I2(g)的化学平衡常数为
H2(g)+I2(g)的化学平衡常数为
A.50 B.0.02 C.100 D.无法确定
二、选择题(本题包括10小题,每小题4分,共40分,每小题有一个或两个选项符合题意)10、阿伏加德罗常数约为6.02×1023mol-1。下列叙述中正确的是
A、常温常压下,0.1mol Ne含有的电子数约为6.02×1023
B、标准状况下,11.2L SO3所含硫原子个数约为3.01×1023
C、由2H和18O所组成的水11g,其中所含的中子数为2.408×1024
D、1mol Cl2与足量水反应,转移的电子数为1.204×1024
11、7.下列指定微粒数目之比不是1:1的是
A.Na2O2晶体中的阴离子和阳离子
B.NaHCO3溶液中的钠离子和碳酸氢根离子
C.24 12Mg2+ 离子中的质子数和中子数 D.氯化钠溶液中的钠离子和氯离子
12.下列离子组能够在溶液中大量共存,加入NaOH溶液有沉淀生成,加入稀盐酸有气体放出的是 ( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
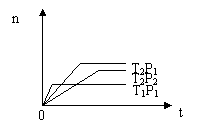 13.应2X(g)+Y(g)
13.应2X(g)+Y(g)![]() 2Z(g);△H<0(正反应为放热反应)。在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量[n(Z)]与反应时间(t)的关系如图所示。则下列判断正确的是 ( )
2Z(g);△H<0(正反应为放热反应)。在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量[n(Z)]与反应时间(t)的关系如图所示。则下列判断正确的是 ( )
、 A.T1<T2,P1<P2
B.T1<T2,P1>P2
C.T1>T2,P1>P2
D.T1>T2,P1<P2
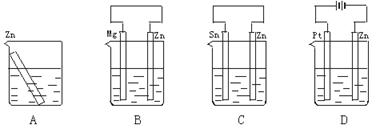
14.分别放置在图4—10所示装置(都盛有0.1 mol·L-1的H2SO4溶液)中的四个相同的纯锌片,腐蚀最慢的是
15.2003年10月15日我国成功发射了第一艘载人航天飞船——“神州五号”。从此我国进入了航天大国和航天强国行列。发射“神五”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。已知:N2(g) + 2O2(g) = 2NO2(g);△H = + 67.7kJ/mol。 N2H4(g) + O2(g) = N2(g) + 2H2O(g);△H = – 534kJ/mol。下列关于肼和NO2反应的热化学方程式中,正确的是 ( )
A.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(l);△H = – 1135.7kJ/mol
B.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H = – 1000.3kJ/mol
C.N2H4(g) + NO2(g) = 3/2N2(g) + 2H2O(l);△H = – 1135.7kJ/mol
D.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H = – 1135.7kJ/mol。
16.向0.1mol/L CH3COOH溶液中加入CH3COONa晶体或加等体积水稀释时,都会引起 ( )
A.溶液的pH增大 B.CH3COOH的电离程度增大
C.溶液的导电能力减小 D.溶液的c (OH – )减小
17. 一个价电子构型为2S2 2P5 的元素,下列关于它的描述正确的是
A.原子序数为9 B.同周期元素种电负性最大
C.原子半径比O原子要大 D.第一电离能最大
18.下列离子方程式中正确的是
A.H2SO4与Ba(OH)2溶液反应:Ba2++2OH—+2H+十SO42-=BaSO4↓+2H2O
B.Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++HCO3-+2OH-=CaCO3↓+ CO32-+2H2O
C.Na2CO3溶液中通入少量CO2: CO32-+ CO2+ H2O=2HCO3-
D.CH3COOH溶液与NaOH溶液反应: H++ OH—=H2O
19.许多物质在通常条件下是以晶体的形式存在,而一种晶体又可视作若干相同的基本结构单元构成,这些基本结构单元在结构化学中被称作晶胞。已知某化合物是由钙、钛、氧三种元素组成的晶体,其晶胞结构如图所示,则该物质的化学式为
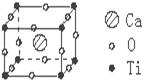
A.Ca4TiO3 B.Ca4TiO6
C.CaTiO3 D.Ca8TiO12
第二部分 非选择题 共83分
姓名_____成绩
一、二选择题答题卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 |
| 答案 |
三、填空题
20.(12分)在下列物质中:NaCI、NaOH、Na2O2、H2O2、(NH4)2S、CCI4、C2H2、SiC.
晶体硅、金刚石、SO3
①其中只含有离子键的离子晶体是 ;
②其中既有离子键,又有极性键和配位键的离子晶体是 ;
③其中既有离子键,又有非极性键的是 ;
④其中含有非极性键的非极性分子的是 ;
⑤其中非极性键的极性分子的是 ;⑥其中含有极性键的的原子晶体是 ;
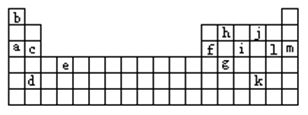 21.(12分)下图是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
21.(12分)下图是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
⑴下列 (填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、l ④d、e、f
⑵如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:A.原子核对核外电子的吸引力;B.形成稳定结构的倾向。下图是一些气态原子失去核外不同电子所需的能量(KJ·mol-1)
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量远远大于失去第一个电子所需要的能量 。
②表中X可能为以上13种元素中的 (填写字母),它与j元素形成的化合物的化学式为 。
③Y是周期表中 族元素。
④以上13种元素中 (填写字母)元素原子失去核外第一个电子需要的能量最多。
22.(8分)氰(CN)2为无色可燃气体、剧毒、有苦杏仁味,是拟卤素的一种。拟卤素的性质与卤素的相似。
(1)写出氰与苛性钠溶液反应的化学方程式:
(2)已知氰分子键角之间夹角为180°并有对称性,(CN)2的结构式为 ,
(CN)2分子为 (填“极性”或“非极性”)分子。
(3)CN-中电子数为 。
23.(10分)已知A、B、C、D、E为中学常见的五种物质,均含元素Y,有的还可能含有元素X、Z,元素X、Y、Z的原子序数依次递增。
①元素Y在A、B、C、D、E中所呈化合价依次递增,其中只有B为单质。
②常温下将气体D通入水中发生反应,生成C和E;
③工业上以A、空气和水为原料,通过催化氧化法制取E;
请回答以下问题:
(1)B分子中含有化学键为 (写名称),A的分子式为 ,A分子的空间构型是 。
(2)写出②中涉及反应的化学方程式 。
(3)由B反应生成1molA放出的热量为46.2kJ,写出该反应的热化学方程式
。
(4)工业上,若输送Cl2的管道漏气,用A进行检验时可观察到大量白烟,同时有B生成,写出有关反应的化学方程式 。
24.(10分)
(1)请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
_________+__________→__________+__________+__________+H2O
(2)反应物中发生氧化反应的物质__________,被还原的元素是_________。
(3)反应中1 mol氧化剂_______(填“得到”或“失去”)___________ mol电子。
(4)请将反应物的化学式及配平后的系数填入下列相应的位置中:
| |
| |
四、实验题
25.(14分)(1)有下图所示A、B、C、D四种仪器: 请选择下列仪器名称的序号,填人相应的空格内:①烧杯②普通漏斗③圆底烧瓶④锥形瓶⑤分液漏斗⑥酸式滴定管
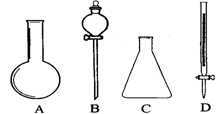 A______________
B______________C______________D______________
A______________
B______________C______________D______________
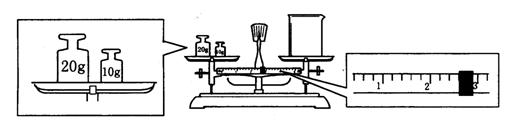
(2)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图.由图中可以看出,该同学在操作时的一个错误是______________,烧杯的实际质量为______________g.
(3)指出下面3个实验中各存在的一个错误:
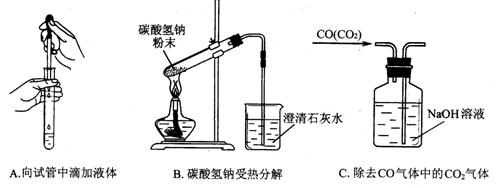
A__________________________,B__________________________,C___________________________
五、计算题
26、(9分)pH=12的NaOH溶液100mL,要使它的pH为11。(体积变化忽略不计)
(1)如果加入蒸馏水,应加 mL;
(2)如果加入pH=10的NaOH溶液,应加 mL;
(3)如果加0.01mol/L HCl,应加 mL。
27.(8分)已知2Fe2++Br2==2Fe3++2Br-,当向100mL的FeBr2溶液中通入标准状况下的Cl23.36L,充分反应后测得形成的溶液中Cl-和Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为多少?