高三化学二模选择易错题集锦(1)
1.将一定量的金属钾放入
A.
2.“酸碱质子理论”认为凡是能够给出质子(H+)的分子或离子都是酸,凡是能够接受质子的分子或离子都是碱,物质酸性(碱性)的强弱取决于分子或离子给出(接受)质子能力的大小。按照“酸碱质子理论”,下列说法正确的是
A.HCO3-既是酸又是碱,NH3既不是酸又不是碱
B.ClO-+H2O![]() HClO+OH-不是酸碱反应
HClO+OH-不是酸碱反应
C.2Na+2H2O=2NaOH+H2↑是酸碱反应
D.碱性强弱顺序:C2H5O->OH->C6H5O-
3.
A.1mol B. 3mol C.5.06mol D.6.02mol
4.下列条件下,两瓶气体所含原子数一定相等的是
A.同质量、不同密度的N2和CO
B.同温度、同体积的H2和N2
C.同体积、同密度的C2H4、C3H6
D.同压强、同体积的N2O和CO2
5.通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能 / kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
下列叙述正确的是
A.由于Si-C的键能大于Si-Si的键能,所以SiC的熔点高于晶体硅的熔点
B.由于Si-O的键能大于Si-Cl的键能,所以SiO2的熔点高于晶体SiCl4的熔点
C.SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g)的反应热计算式为:△H=(4×360kJ·mol-1+2×436kJ·mol-1 )-(4×176kJ·mol-1+4×431kJ·mol-1 )
Si(s)+4HCl(g)的反应热计算式为:△H=(4×360kJ·mol-1+2×436kJ·mol-1 )-(4×176kJ·mol-1+4×431kJ·mol-1 )
D.SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g)的反应热计算式为:△H=(4×360kJ·mol-1+2×436kJ·mol-1 )-(4×176kJ·mol-1-4×431kJ·mol-1 )
Si(s)+4HCl(g)的反应热计算式为:△H=(4×360kJ·mol-1+2×436kJ·mol-1 )-(4×176kJ·mol-1-4×431kJ·mol-1 )
6.将xmolAl2O3和ymolCuO混合后,全部溶于VL过量的稀硫酸中,然后向溶液中逐渐加入0.5mol/L的NaOH溶液,当加入aL时,生成的沉淀最多,则原稀H2SO4的物质的量浓度为
A (a/4V)mol/L B [(3Y+X)/V]mol/L C (a/2V)mol/L D 无法计算
7.
A.等于
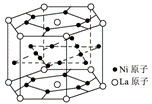 8.氢气是重要而洁净的能源,要利用氢气作能源,必须安全有效地储存氢气。有报道称某种合金材料有较大的储氢容量,其晶体结构的最小单元如右图所示。则这种合金的化学式为
8.氢气是重要而洁净的能源,要利用氢气作能源,必须安全有效地储存氢气。有报道称某种合金材料有较大的储氢容量,其晶体结构的最小单元如右图所示。则这种合金的化学式为
A.LaNi6 B.LaNi
9.短周期元素A、B不属于同主族,形成的化合物的化学式为AB,若A的原子序数为n,则B的原子序数不可能为
A.n+1 B.n+
10.铊(Tl)是某超导材料的组成元素之一,与铝同族,位于第6周期。Tl3+与Ag在酸性介质中发生反应:Tl3+ + 2Ag = Tl+ + 2Ag+
。下列推断正确的是
A、Tl+的最外层有1个电子
B、Tl3+的氧化性比Al3+弱
C、Tl 能形成+3价和+1价的化合物
D、Tl+的还原性比Ag强
11.一定温度下,反应2SO2+O2
![]() 2SO3达到平衡时,n(SO2):n(O2):n(SO3)= 2:3:4 。缩小体积,反应再次达到平衡时,n(O2)=0.8mol、n(SO3)=1.4mol,此时SO2的物质的量应是
2SO3达到平衡时,n(SO2):n(O2):n(SO3)= 2:3:4 。缩小体积,反应再次达到平衡时,n(O2)=0.8mol、n(SO3)=1.4mol,此时SO2的物质的量应是
A.0.4mol B.0.6mol C.0.8mol D.1.2mol
12.室温下,等体积的下列各组酸和碱的溶液混合后,溶液PH<7的是
①PH之和为14的硝酸和氢氧化钾溶液
②PH之和为15的盐酸和氨水溶液
③PH之和为14的醋酸和苛性钠溶液
④PH之和为13的硫酸和氢氧化钡溶液
A.② B.①② C.②③ D.③④
13.室温时,将xmlPH=a的稀氢氧化钠溶液与ymlPH= b的稀盐酸充分反应。下列关于反应后溶液PH的判断,正确的是
A.若x=y,且a+b=14,则PH>7 B.若10x=y,且a+b=13,则PH=7
C.若ax=by,且a+b=13,则PH=7 D.若x=10y,且a+b=14,则PH>7
14.一种新型熔融盐燃料电池具有高发电效率而倍受重视。现有Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极能O2和CO2的混合气体,制作 2CO2。则下列说法中正确的是
A.负极电极反应是:O2+2CO2+4e—=2CO32—
 B.通CO的一极是电池的正极
B.通CO的一极是电池的正极