高三化学复习专题图表计算题
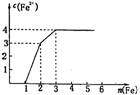
1、某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度和加入铁粉的物质的量之间的关系如右图所示。则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为
A、1:1:1 B、1:3:1 C、3:3:8 D、1:1:4
 2、向10
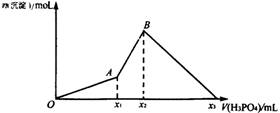
mL 1 mol/L的Ba(OH)2溶液中逐滴加入x mL 1 mol/L的H3PO4溶液时,产生沉淀的物质的量与滴入H3PO4的体积之间的曲线如图所示。试分析:
2、向10
mL 1 mol/L的Ba(OH)2溶液中逐滴加入x mL 1 mol/L的H3PO4溶液时,产生沉淀的物质的量与滴入H3PO4的体积之间的曲线如图所示。试分析:
(1)O~A段沉淀物的化学式为_______________________________。
(2)A~B段反应的化学方程式为________________________________。
(3)x2=_________mL,x1=_________mL。
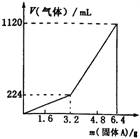 3、将一定量混合均匀的铁粉与硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A。将质量为m的固体A加入到300 mL 2 mol·L—1的盐酸中使之完全溶解,测得室温下加入固体A的质量与收集到气体体积(已换算成标准状况)的关系如图所示(假设所得氢硫酸溶液饱和前无硫化氢气体逸出)。
3、将一定量混合均匀的铁粉与硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A。将质量为m的固体A加入到300 mL 2 mol·L—1的盐酸中使之完全溶解,测得室温下加入固体A的质量与收集到气体体积(已换算成标准状况)的关系如图所示(假设所得氢硫酸溶液饱和前无硫化氢气体逸出)。
已知加入固体A的质量m≤3.2 g时,收集到的气体为氢气;当m>3.2 g时,收集到的气体为H2和H2S的混合气。
试分析与计算:
(1)3.2 g固体A中所含的物质有__________。
(2)3.2 g固体A中各物质的物质的量分别为__________,溶于上述盐酸充分反应后,所得溶液中氢硫酸的物质的量浓度为(忽略溶液体积的变化)___________。
 (3)当固体A全部溶于上述盐酸,且A的质量m>3.2 g时,收集到的气体体积(标准状况下)V=__________mL(用含m的代数式表示)。
(3)当固体A全部溶于上述盐酸,且A的质量m>3.2 g时,收集到的气体体积(标准状况下)V=__________mL(用含m的代数式表示)。
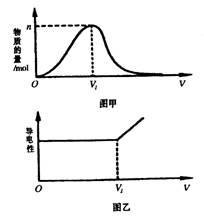
4、由H2和Cl2组成的混合气体,经光照充分反应后,通入100 mL 1 mol·L—1的NaOH溶液中,图甲表示溶液中某种离子的物质的量随通入气体体积的变化而变化的曲线,图乙表示溶液中的导电性随着通入气体体积的变化而变化的曲线。
(1)图甲表示溶液中__________离子的变化曲线,说明曲线下降的原因:_________________________________。
(2)对溶液进行导电性实验;当通入的混合气体体积大于V1时,引起溶液导电性明显增强的主要阳离子是_____________。
(3)当n=0.02 mol时,光照前的混合气体中H2和Cl2的物质的量之比为_________。
5、为了防治环境污染并对尾气进行综合处理,某硫酸厂用氨水吸收尾气中的SO2,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。为测定上述(NH4)2SO4和NH4HSO4固体混合物的组成。现称取该样品四份,分别加入相同浓度的NaOH溶液各40.00 mL,加热至80℃左右,使氨气全部逸出[(NH4)2SO4和NH4HSO4分解温度均高于200℃],测得有关数据如下(标准状况):
| 实验序号 | 样品质量/g | NaOH溶液体积/mL | 氨气体积/L |
| Ⅰ | 7.4 | 40.00 | 1.68 |
| Ⅱ | 14.8 | 40.00 | 3.36 |
| Ⅲ | 22.2 | 40.00 | 1.12 |
| Ⅳ | 37.0 | 40.00 | 0.00 |
(1)实验过程中有关的离子反应方程式为____________________________________
(2)由Ⅰ组数据直接推测:标准状况下3.7 g样品进行同样实验时,生成氨气的体积为_________L。
(3)试计算该混合物中的(NH4)2SO4和NH4HSO4物质的量之比__________。
(4)欲计算该NaOH溶液物质的量浓度应选择第_____组数据,其浓度为________。
6、合成氨原料可以由天然气制取。其主要反应为:CH4(g)+H2O(g)→CO(g)+3H2(g)。
(1)1 m3(标准状况)CH4按上式完全反应,产生H2_________mol。
(2)CH4和O2反应为:2CH4(g)+O2(g)→2CO(g)+4H2(g);设CH4同时和H2O(g)及O2(g)反应。1 m3(标准状况)CH4按上述两式完全反应,产物气体的体积V(标准状况)为__________。
(3)CH4和H2O(g)及富氧空气(O2含量较高,不同富氧空气氧气含量不同)混合反应,产物气体组成如下表:
| 气体 | CO | H2 | N2 | O2 |
| 体积(L) | 25 | 60 | 15 | 2.5 |
计算该富氧空气中O2和N2的体积比V(O2)/V(N2)。
(4)若CH4和H2O(g)及富氧空气混合反应的产物中,C(H2)/V(N2)=3:1(合成氨反应的最佳比),则反应的H2O(g)和富氧空气的体积比为何值?
7、Na2S2O3·5H2O(俗称海波)是照相业常用的一种定影剂,常采用下列方法制备:将亚硫酸钠溶液与硫粉混合共热,生成硫代硫酸钠Na2SO3+S=Na2S2O3,滤去硫粉,再将滤液浓缩、冷却,即有Na2S2O3·5H2O晶体析出。该法制得的晶体中常混有少量Na2SO3和Na2SO4的杂质。
为测定一种海波晶体样品的成分,某同学称取三份质量不同的该样品,分别加入相同浓度的H2SO4溶液20 mL,充分反应后滤出硫,并将滤液微热(假定生成的SO2全部逸出),测得有关实验数据如下(标准状况):
| 第一份 | 第二份 | 第三份 | |
| 样品的质量/g | 12.60 | 18.90 | 28.00 |
| 二氧化硫的体积/L | 1.12 | 1.68 | 2.24 |
| 硫的质量/g | 1.28 | 1.92 | 2.56 |
(1)样品与硫酸可能发生反应的离子方程式为_______________________________;
(2)根据上表数据分析,该样品__________(填选项字母);
A、只含有Na2S2O3
B、含有Na2S2O3和Na2SO3两种成分
C、含有Na2S2O3、Na2SO3和Na2SO4三种成分
(3)试计算:该样品中各成分的物质的量之比?
(4)所加硫酸溶液的物质的量浓度为___________;
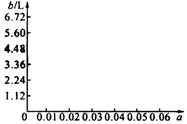
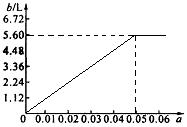
(5)若将63 g该样品与一定量的该硫酸溶液微热,欲计算生成SO2的体积,还需提供一个数据是(用a表示该数值,并注明单位)________________________;
试讨论:当a在不同取值范围时,SO2的体积b。并请在下图中画出b随a变化的曲线。
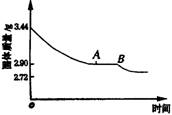
8、某化学小组为了测定石膏的组成(CaSO4·xH2O),即测x值,做了如下实验:将含结晶水的硫酸钙放在坩埚中加热前和加热后都进行称量。随着实验次数的增加,加热的时间不断延长。他们在实验中将数据整理如下表。 利用数据可绘制成如图所示图象:
| 实验顺序 (按序延长加热时间) | 固体质量/g | |
| 加热前 |
| |
| 1 2 3 4 5 6 7 8 | 3.44 3.44 3.44 3.44 3.44 3.44 3.44 3.44 | 3.26 3.12 2.90 2.90 2.80 2.78 2.72 2.72 |
(1)利用实验数据,通过计算推断生石膏的化学式。
(2)通过计算解释图象中产生AB段的原因。
9、已知Fe2O3在高炉中有下列反应:Fe2O3+CO![]() 2FeO+CO2
2FeO+CO2
反应形成的固体混合物(Fe2O3、FeO)中,元素铁和氧的质量比用m(Fe):m(O)表示。
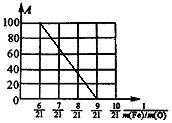
(1)上述固体混合物中,m(Fe):m(O)不可能是_________(选填a、b、c多选扣分)
A、21:9 B、21:7.5 C、21:6
(2)若m(Fe):m(O)=21:8,计算Fe2O3被CO还原的质量分数。
(3)设Fe2O3被CO还原的质量分数为A%,则A和混合物中m(Fe):m(O)的关系式为[用含m(Fe)、m(O)的代数式表示]。A%=___________。
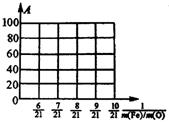
请在上图中画出表示A和m(Fe)/m(O)关系的图形。
(4)如果Fe2O3和CO的反应分两步进行:
3Fe2O3+CO![]() 2Fe3O4+CO2
2Fe3O4+CO2
Fe3O4+CO2![]() 3FeO+CO2
3FeO+CO2
试分析反应形成的固体混合物可能的组成及相应的m(Fe):m(O)[令m(Fe):m(O)=21:a,写出a的取值范围]。将结果填入下表:
| 混合物组成(用化学式表示) | a的取值范围 |
图表计算题参考答案
1、D
2、(1)Ba3(PO4)2
(2)Ba3(PO4)2+H3PO4=3BaHPO4 (3)10
(4)![]()
3、(1)Fe、FeS
(2)n(Fe)=0.01 mol
n(FeS)=0.03 mol
c(H2S)=0.1 mol·L—1
(3)![]() (24≥m>3.2)
(24≥m>3.2)
4、(1)ClO—,当通入的气体开始过量时,溶液呈酸性,
发生反应:H++ClO—=HClO,使n(ClO—)减少
(2)H+
(3)3:5
5、(1)H++OH—=H2O
NH4++OH—![]() NH3↑+H2O
NH3↑+H2O
(2)0.84 L (3)1:4 (4)Ⅲ 5 mol·L—1
6、(1)133.9
(2)3m3<V<4m3
(3)设H2O为x mol,O2为y mol
则![]() x=10,y=7.5
x=10,y=7.5
![]()
设富氧空气中V(O2)%为a
则![]()
∴![]()
7、(1)S2O32—+2H+=S↓+SO2↑+H2O
SO32—+2H+=SO2↑+H2O
(2)C
(3)由第一份的数据:![]()
Na2S2O3———S———SO2
0.04mol 0.04mol 0.04mol
![]()
n(Na2SO4)=(12.60g-2.48g·mol—1×0.04mol-126g·mol—1×0.01mol)
÷142g·mol—1=0.01mol
n(Na2S2O3):n(Na2SO3):n(Na2SO4)=0.04mol:0.01mol:0.01mol=4:1:1
(4)5 mol·L—1
(5)硫酸溶液的体积a L
当a<0.05时,b=112a L
当a=0.005时,b=112a L=5.6 L
当a>0.05时,b=5.6 L
8、(1)CaSO4·xH2O![]() CaSO4+xH2O
CaSO4+xH2O
136+18x 136 18x
3.44g 2.27g 0.72g
x=![]()
生石膏化学式:CaSO4·2H2O
(2)实验数据和图象AB段说明生石膏受热分解过程中,有一种组成的化合物存在。
CaSO4·2H2O![]() CaSO4·yH2O+(2-y)H2O
CaSO4·yH2O+(2-y)H2O
172 136+18y
3.44 2.90
∴ y=![]()
该化合物为2CaSO4·H2O(或CaSO4·![]() H2O)
H2O)
因在加热过程中生石膏CaSO4·2H2O转化为相对稳定的2CaSO4·H2O,因此图象中有AB段。
9、(1)a、c
(2)设Fe2O3原总的物质的量为n(Fe2O3),Fe2O3被还原质量分数为A%
则有![]()
得![]()
(3)![]()
 加热后
加热后