高三化学《硫酸工业》综合检测题
时量:90分钟 满分:100分 姓名____________计分______________
本卷可能用到的相对分子质量:H:1 O:16 S:32 Fe:56
一、选择题:(下列各题只有一个选项符合题意,每小题3分,共60分)
 1、导致下列现象的主要原因与排放SO2有关的是(2000年全国高考题)
1、导致下列现象的主要原因与排放SO2有关的是(2000年全国高考题)
A.酸雨 B.光化学烟雾 C.臭氧空洞 D.温室效应
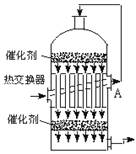
2、在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,采用了中间有热交换器的接触室(见右图),按此密闭体系中气体的流向,则从A处流出的气体为( )
A.SO2 B.SO3、O2
C.SO2、O2 D.SO2、SO3
3、下列反应中,调节反应物用量或浓度不会改变反应产物的是(1998年上海高考题)
A.硫化氢在氧气中燃烧 B.铁在硫蒸气中燃烧
C.二氧化硫通入石灰水 D.硫酸中加入锌粉
4、对于反应4FeS2 + 11O2 = 2Fe2O3 +8SO2 ,下列叙述正确的是( )
A、铁和硫两种元素被还原
B、转移的电子数是40
C、Fe2O3和SO2都既是氧化产物,又是还原产物
D、由于O2过量,SO2部分被氧化为SO3
5、现有1 L含SO3为30%的发烟硫酸(密度为1.95 g·cm-3),要把它稀释成浓度为95%的浓硫酸,要加水约为( )
A.120 mL B.180 mL C.240 mL D.300 mL
6.含FeS2 A%的黄铁矿W t,在接触法制H2SO4的过程中,损失硫C%,可制得浓度为B%的硫酸为( )
A.![]() t B.
t B.![]() t C.
t C.![]() t D.
t D.![]() t
t
7、在氧气中灼烧0.44 g硫和铁组成的化合物,使其中的硫全部转变为二氧化硫,把这些二氧化硫全部氧化并转变为硫酸.这些硫酸可以用20 mL 0.5 mol/L的氢氧化钠溶液完全中和.则原化合物中硫的质量分数为( )
A.18% B.46 % C.53% D.36%
8、在强酸溶液中,下列各组离子能够大量共存的是 ( )
A.Mg2+、Ca2+、HCO3-、CI- B.Na+、AIO2-、Cl-、SO42-
C.K+、Fe2+、SO42-、Br- D.Fe2+、Ca2+、CI-、NO3-
9、高温下硫酸亚铁发生如下反应:2FeSO4![]() Fe2O3+SO2↑+SO3↑,若将生成的气体通入氯化钡溶液中,得到的沉淀物是( )
Fe2O3+SO2↑+SO3↑,若将生成的气体通入氯化钡溶液中,得到的沉淀物是( )
A BaSO3和BaSO4 B BaS C BaSO3 D BaSO4
10、a、b、c、d、e五种物质均含有一种相同元素,在一定条件下可发生如下的转化关系: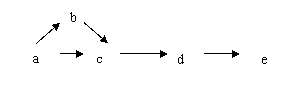
其中a是单质,b在通常情况下是气体,c、d都是氧化物,e是该元素的最高价氧化物对应的水合物,且是一种强电解质。则a可能是( )
A、Cl2 B、Br2 C、S D、C
11、下列工业过程的措施中与勒沙特列原理有关的是( )
A 硫酸工业制法中采用高温下氧化二氧化硫 B 硫酸工业制法中用采用常压氧化二氧化硫
C 合成氨工业采用高压条件 D 合成氨工业采用铁触媒作催化剂
12、除去SO2中的少量SO3所采用的方法无效的是( )
A 通过浓硫酸的洗气瓶 B 通过亚硫酸氢钠溶液的洗气瓶
C 通过外部用冰盐水冷却的U型管 D 通过碳酸氢钠溶液的洗气瓶
13、对某酸性溶液(可能含有Br-,SO42-,H2SO3,NH4+)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;
③加入氯水时,溶液略显黄色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸
对于下列物质不能确认其在溶液中是否存在的是( )
A Br- B SO42- C H2SO3 D NH4+
14、若以ω1和ω2分别表示浓度为a mol·L-1和b mol·L-1硫酸的质量分数,且知
2a=b,则下列推断正确的是( )
A 2ω1=ω2 B 2ω2=ω1 C ω2>2ω1 D ω2<2ω1
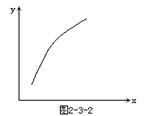
15、
在密闭容器中通入A、B两种气体,在一定条件下反应,2A(气)+B(气)![]() 2C(气);
2C(气);
ΔH=-Q kJ/mol (Q>0)。达平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是( )

16、SO3溶解在硫酸中所得混合液叫做“发烟硫酸”,通常
以SO3的质量分数表示其组成,今将0.1185克发烟硫酸试溶于水,用0.125 mol/L氢氧化钠标准溶液滴定,用去此标准液20ml,恰好中和,则试样中,SO3质量分数为( )
A.15% B.17% C.34% D.60%
17、在硫酸的工业制法中,下列生产操作与说明生产操作的主要原因二者都是正确的是( )
A.从沸腾炉出来的炉气需净化,因为炉气中SO2会与杂质反应
B.硫铁矿燃烧前需要粉碎,因为大块的硫铁矿不能燃烧
C.SO3用98.3%的浓H2SO4吸收,目的是防止形成酸雾,以便使SO3吸收完全
D.SO2氧化为SO3时需使用催化剂,这样可以提高SO2的转化率
 18、取100mL18.3mol/L的H2SO4与Zn反应,当Zn完全溶解时,生成的气体(可使品红褪色)在标况下占有的体积为22.4L,将所得的溶液稀释为1L,测得溶液中H+的浓度为1mol/L,则所生成的气体中SO2和H2的体积比为( )
18、取100mL18.3mol/L的H2SO4与Zn反应,当Zn完全溶解时,生成的气体(可使品红褪色)在标况下占有的体积为22.4L,将所得的溶液稀释为1L,测得溶液中H+的浓度为1mol/L,则所生成的气体中SO2和H2的体积比为( )
A、1 :2 B、2 :1
C、1 :4 D、4 :1
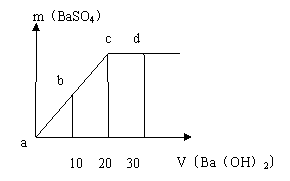
19、常温下,向0.1mol/L的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验时不同阶段的溶液,下列有关说法中不正确的是( )
A、 溶液的PH:a<b<c<d
B、溶液的导电能力:a>b>d>c
C、a、b溶液呈酸性 D、c、d溶液呈碱性
 20、某化工厂工业废水中含H2SO4的质量分数为2%,采用边排放边中和的方法将它处理至基本呈中性,处理方法如下图所示,若处理后废水的PH=7,则2%的NaOH溶液的流量为( )
20、某化工厂工业废水中含H2SO4的质量分数为2%,采用边排放边中和的方法将它处理至基本呈中性,处理方法如下图所示,若处理后废水的PH=7,则2%的NaOH溶液的流量为( )
A、0.00816m3/s B.0.01m3/s
C.0.01632m3/s D.0.02m3/s
二、填空题
21、(8分)X、Y、Z是短周期元素的3种常见氧化物,X跟水反应后可生成一种具有还原性的不稳定的二元酸,该酸的化学式是__________________,Y和X 的组成元素相同,Y的化学式是____________________,1mol Z在加热时跟水反应的产物需要用6mol的氢氧化钠才能完全中和。在一定条件下,Y可以跟非金属单质A反应生成X和Z,单质A是________,该反应方程式为____________________.
22、(7分)A、B两种盐的式量均为120,A、B的焰色反应分别为黄色和紫色,A、B的溶液混合产生一种有刺激性气味气体C,向A、B中加入Ba(OH)2溶液分别产生白色沉淀D、E,E能溶于稀盐酸中,也产生气体C。
(1) 写出A、B、C、D、E的化学式:A______B______D______。
(2)写出下列有关离子方程式:A+B___________________________________
B+Ba(OH)2____________________________________________。
23、(7分)下图每一个方框中的字母代表一种反应物或生成物,它们都是中学化学中常见的物质,其中A、C都是由两种元素组成的固态化合物,常温下甲是短周期元素的气体单质,E是过渡元素的单质。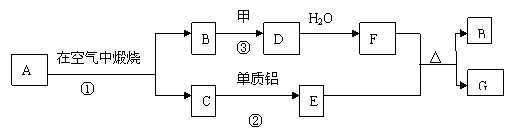

(1)若A是黄色固体,反应①用于工业生产,则A的化学式为________________.此时反应②的化学方程式为_______________________________________.
(2)若A、C都是黑色固体,A经反应①生成C时,固体质量不变,则A的化学式为____________.
(3)反应③在工业生产中的条件是_________________________________________.
24、(10分)某化学兴趣小组选用下列实验装置图,测定工业原料气(含SO2、N2、O2)中SO2的含量。
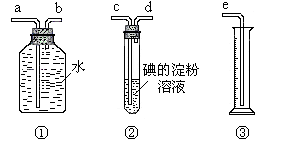 |
(1)若原料气从左到右流向时,上述装置组装连接的顺序是:原料气→______________(填a、b、c、d、e等)
(2)装置②中发生反应的离子方程式为_______________________;当装置②中出现____________________现象时,立即停止通气.
(3)你认为下列试剂中,可以用来代替试管中的碘的淀粉溶液的是____________.
A.酸性KMnO4 B.NaOH溶液 C.溴水 D.氨水
(4)若碘溶液的浓度为0.05mol/L,体积为20mL,收集到的N2与O2的体积为297.6mL(已折合为标况体积),SO2的体积分数为________________
25、(8分)某化工厂以硫磺为原料生产硫酸,设空气中O2的体积含量为21%,不考虑各阶段物料损失,完成下列各题:
(1)若该厂生产98%的硫酸10t,需要硫磺的质量是__________________t,需要消耗标况下的空气的体积______________________m3.
(2)若该厂每天生产98%的硫酸a t,生产过程中为了使硫充分燃烧,且下一步催化氧化时不再补充空气,要求硫燃烧后的混合气体中O2的体积分数为b%,该厂每天消耗标况下的空气的体积为___________________________m3,为满足题设要求,b%的下限等于___________________。
参考答案:
1、A 2、C 3、B 4、C 5、C 6、C 7、D 8、C 9、D 10、C
11、C 12、D 13、B 14、D 15、C 16、A 17、C 18、A 19、D 20、A
21、H2SO3;SO3;P;5SO3+2P = 5SO2 + P2O5
22、(1)NaHSO4;KHSO3;BaSO4;
(2)H+ + HSO3- = H2O +SO2↑;HSO3- +Ba2+ +OH- = BaSO3↓+H2O
23、(1)FeS2;2Al +Fe2O3 =2 Fe + Al2O3
(2)Cu2S;
(3)400℃-500℃;催化剂。
24、(1)cdbae;
(2)SO2+I2+2H2O = H2SO4 + 2HI;由蓝色变无色。
(3)A、C
(4)44.6%
25、(1)3.2t;19600m3
(2)![]() ;7%
;7%