高三化学《物质的量》单元测试
第I卷 (共64分)
相对原子质量:H-1 O-16 Na-23 K-39 S-32 Cu-64 I-127
一、选择题(本题包括6小题,每小题4分,共24分。每小题只有一个选项符合题意)
1.澳大利亚研究人员最近开发出被称为第五形态的固体碳,这种新的碳结构称作“纳米泡沫”, 他外形类似海绵,比重极小,并具有磁性。纳米泡沫碳与金刚石的关系是
A.同系物 B.同分异构体 C.同位素 D.同素异形体
 2.以共价单键相连的非金属单质中,1 个原子与相邻原子成键的数目为8-N个,N为该非金属元素的族序数,这一现象化学家称为8-N规则。某非金属单质结构如图所示,构成该单质的元素位于
2.以共价单键相连的非金属单质中,1 个原子与相邻原子成键的数目为8-N个,N为该非金属元素的族序数,这一现象化学家称为8-N规则。某非金属单质结构如图所示,构成该单质的元素位于
A.ⅢA B.ⅣA C.ⅤA D.ⅥA
3.下列取代基或微粒中,碳原子都满足最外层为8电子结构的是
A.甲基(—CH3) B.碳正离子[(CH3)3C⊕]
C.碳负离子(CH3-) D.碳烯 (:CH2)
4.目前人类已发现的非金属元素除稀有气体外,共有16种,下列对这16种非金属元素的相关判断
① 都是主族元素,最外层电子数都大于4
② 单质在反应中都只能作氧化剂
③ 氢化物常温下都是气态,所以又叫都气态氢化物
④ 氧化物常温下都可以与水反应生成酸
A.只有①②正确 B.只有①③正确
C. 只有③④正确 D.①②③④均不正确
5.将40 mL 1.5 mol·L-1的CuSO4溶液与30 mL 3mol·L-1的NaOH溶液混合,生成浅蓝色沉淀,假如溶液中C(Cu2+)或C(OH-)都已变得很小,可忽略,则生成沉淀的组成可表示为
A.Cu(OH)2 B.CuSO4·Cu(OH)2
C.CuSO4·2Cu(OH)2 D.CuSO4·3Cu(OH)2
6.向100mLFeBr2溶液中通入标准状况下的Cl2 3.36L,全部被还原,测得溶液中c(Br-)=c(Cl-),则原FeBr2溶液的物质的量浓度为
A. 0.75 mol·L-1 B.1.5 mol·L-1
C. 2 mol·L-1 D.3 mol·L-1
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
7.设NA为阿佛加德罗常数的值,下列有关叙述不正确的是
A.常温常压下,NA个CH4分子的体积大于22 .4 L
B. lmol·L-1的醋酸钠溶液中含CH3COOH、CH3COO-共NA个
C. 足量Na2O2和11.2L CO2反应,转移电子数目为NA
D. 含1mol碳原子的金刚石中,C-C共价键数为2NA个
8.下列说法正确的是
A.含有相同氧原子数的SO2和CO的质量相等
B.等物质的量浓度的NaOH溶液与氨水中的c(OH-)相等
C.乙酸分子与甲酸甲酯分子中的共价健数相等
D.等温等压下,3molC2H2(g)和1molC6H6(g)的密度相等
9.下列实验操作中,错误的是
A.配制5%食盐溶液时,将称量的食盐放入烧杯中加计量的水搅拌溶解
B.硫酸铜结晶水含量测定时,需用小火缓慢加热,防止晶体飞溅
C.测定未知NaOH溶液浓度时,酸式滴定管需用标准酸液润洗2~3次
D.配制0.1 mol·L-1H2SO4溶液时,将量取的浓H2SO4倒入容量瓶中加水稀释
10.常温下,在密闭容器里分别充入两种气体各0.1 mol,在一定条件下充分反应后,恢复到原温度时,压强降低为开始时的1/4。则原混合气体可能是
A.H2和O2 B.HCl和 NH3
C.H2和Cl2 D.CO和O2
11.吸入人体内的O2有2%转化为活性氧(如·O·),活性氧能加速人体衰老,目前正尝试用亚硒酸钠Na2SeO3消除活性氧。下列说法中不正确的是
A.消除活性氧时,Na2SeO3是氧化剂 B.Na2SeO3溶液的pH>7
C.Se2-离子半径比S2-大 D.H2Se的稳定性比HBr弱
12.下列离子方程式正确的是
A.将0.1mol·L-1HCl溶液数滴缓缓滴入1mol·L-1 50mLNa3PO4溶液中,且不断搅拌: 3H+ + PO43-=H3PO4
B.将1mol·L-1 NaAlO2溶液和1.5mol·L-1的HCl溶液等体积互相均匀混合:
6AlO2- + 9H+ + 3H2O = 5Al(OH)3↓+ Al3+
C.向1mol·L-1明矾溶液50mL中滴入数滴0.1mol·L-1Ba(OH)2溶液:
Al3++2SO42-+2Ba2++3OH -=Al(OH)3↓+2BaSO4↓
D.将少量SO2气体通入NaClO溶液中:SO2+H2O+ ClO-=SO42-+Cl-+2H+
13.放射性核素![]() 的一个原子经过6次衰变(每次衰变都放出一个相同粒子)后,得到比较稳定的第100号元素镄(Fm)的含153个中子的核素。下列说法中正确的是
的一个原子经过6次衰变(每次衰变都放出一个相同粒子)后,得到比较稳定的第100号元素镄(Fm)的含153个中子的核素。下列说法中正确的是
A.每次衰变都放出一个氘原子
B.最终得到核素的符号是![]()
C.Uub和Fm都是主族元素
D.上述Uub、Fm的原子核中中子数与质子数之差相同
14.用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U型管的质量差,实验测得n(H)∶n(O)>2∶1。下列对导致这一结果的原因的分析中,一定错误的是
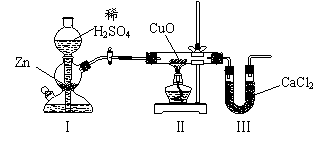
A.Ⅰ、Ⅱ装置之间缺少干燥装置 B.Ⅲ装置后缺少干燥装置
C.Ⅱ装置中玻璃管内有水冷凝 D.CuO没有全部被还原
15.某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等),下列分析推理正确的是
| 50ml盐酸 | 50ml盐酸 | 50ml盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| VCO2(标况) | 2.24L | 3.36L | 3.36L |
A.根据不中数据能计算出盐酸的物质的量浓度
B.根据表中数据不能计算出混合物中NaHCO3的质量分数
C.加入混合物9.2g时盐酸过量
D.15.7g混合物恰好与盐酸完全反应
16.25℃时,将两铜电极插入一定量的硫酸钠饱和溶液中进行电解,通电一段时间后,阴极析出了a mol气体,同时有W gNa2SO4•10H2O晶体析出,温度不变时剩余溶液中溶质的质量分数为
A.![]() ×100%
B.
×100%
B.![]() ×100%
×100%
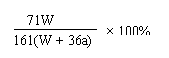 | |||
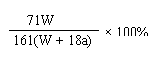 | |||
C、 D、
第Ⅱ卷(非选择题 共86分)
三、实验题(本题包括2小题,共28分)
17. 下列实验操作或对实验事实的叙述正确的是______________(填序号)
① 用稀HNO3清洗做过银镜反应实验的试管;
② 配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌;
③ 用碱式滴定管量取20.00mL 0.1000mol/L 的KMnO4溶液;
④ 用托盘天平称取10.50g干燥的NaCl固体;
⑤ 不慎将苯酚溶液沾到皮肤上,立即用酒精清洗;
⑥容量瓶检漏的操作:在容量瓶中注入适量的水,塞上玻璃瓶塞,左手五指托住瓶底,右手食指顶住瓶塞,反复倒置,观察是否漏水
⑦ 向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体;
⑧ 配制Al2(SO4)3溶液时,加入少量的稀硫酸。
18.某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如图装置。倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管气体的体积为VmL(已折算成标准状况)
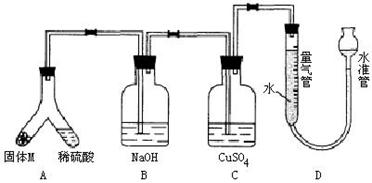
由上述实验事实可知:
(1)①固体M中一定有的物质是______________(填化学式)
理由是_____________________________________________________________
②其中一种物质的质量可以确定为___________g(用代数式表示)。
(2)B装置的名称是________。
写出B装置中反应的离子方程式_______________________________________。
(3)C装置的作用是_________________________,如果实验中没有B装置,则C装置中产生的现象是__________________________________________________。
(4)稀硫酸和固体M反应后溶液中还残留淡黄色固体,该固体是_____________,要分离出该固体,在实验操作中,除烧杯外还需要用到的玻璃仪器是_____________。
(5)通过进一步实验,测得固体M中各种成分的质量之和小于反应前铁粉和硫粉的质量之和,产生这种现象的原因可能是_____________
a.M中有未反应的铁和硫
b.测定气体体积时水准管的水面高于量气管的水面
c.A中留有反应生成的气体
d.气体进入D装置前未用浓硫酸干燥
四、填空题(本题包括4小题,共40分)
19.碳元素有多种同位素,其中14C具有放射性,它能自发放出某种射线,而衰变成其他元素。考古学对出土生物遗骸的年代断定可以使用多种方法,其中较精确的一种是基于14C放射性的方法,但被断定的年代一般不超过5万年。
(1) ![]() 与
与![]() 结构上的差别在于其 的不同。如14CO2与碳在高温条件下发生反应:14CO2+C
结构上的差别在于其 的不同。如14CO2与碳在高温条件下发生反应:14CO2+C![]() 2CO,达到化学平衡后,平衡混合物中含14C的微粒有( )
2CO,达到化学平衡后,平衡混合物中含14C的微粒有( )
A.14CO2 B.14CO2,14CO
C.14CO2,14CO,14C D.14CO
(2) 下列考古遗址发现的遗物中能用14C测定年代的是( )
A. 战国曾侯乙墓的青铜编钟(距今约2400年)
B. 马家窑文化遗址的粟(距今约5300年)
C. 秦始皇兵马俑(距今约2200年)
D. 元谋人的门齿(距今约170万年)
20.A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、C及B、D分别是同主族元素;已知B、D两元素原子核中质子数之和是A、C两元素原子核中质子数之和的2倍;四种元素形成的单质中有两种是气体,两种是固体。
(1) 写出B、C两元素所形成的原子个数比为1:1的化合物的电子式
(2) C和D可形成一种新型的熔盐电池,电池反应可写作:
![]() ,其正极的电极反应式为
。
,其正极的电极反应式为
。
(3) 由A、B、C、D四种元素所组成的一种中学常见的化合物,它既能与盐酸反应,又能与NaOH溶液反应,该化合物的化学式为 。
21.A、B、C、D为中学化学中常见的四种气体单质。在一定条件下B可以分别和A、C、D化合生成甲、乙、丙,C和D化合生成化合物丁。已知甲、乙、丙的每个分子中含有的电子数相等,并且甲、乙、丙、丁有如下图所示关系:
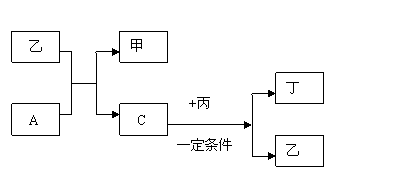

请填空:
(1)单质B的化学式 ,电子式 。
(2)写出相应的化学反应方程式
![]() ① A + 乙 甲 + C :
① A + 乙 甲 + C :
![]() ② C + 丙 丁 + 乙:
② C + 丙 丁 + 乙:
(3)试根据化合物丙、丁中D元素的化合价,判断丙和丁能否在一定条件下发生化学反应生成D的单质。若能,写出化学反应方程式,若不能,简要说明理由。
22.科学家从化肥厂生产的(NH4)2SO4中检出组成N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO42-和N4H44+两种离子形式存在,植物的根系极易吸收N4H44+,但它遇到碱时,会生成一种形似白磷的N4分子,N4分子不能被植物吸收。
请回答下列问题:
⑴N4和N2的关系正确的是___________(填序号);
A.同种单质 B.同位素 C.同分异构体 D.同素异形体
⑵N4H4(SO4)2______ (填“能”或“不能”)和草木灰混合施用;
⑶已知白磷、NH4+、N4H44+的空间构型均为四面体,NH4+的结构式为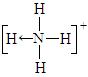 (→表示共用电子对由N原子单方面提供),白磷(P4)的结构式为
(→表示共用电子对由N原子单方面提供),白磷(P4)的结构式为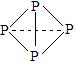 ,请画出N4H44+的结构式_____________________。
,请画出N4H44+的结构式_____________________。
⑷已知液氨中存在着平衡2NH3![]() NH4++NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式________________________________________________。
NH4++NH2-。科学家在液氨中加入氢氧化铯(CsOH)和特殊的吸水剂,使液氨中的NH4+生成N4分子,请写出液氨与氢氧化铯反应的化学方程式________________________________________________。
五、计算题(共20分)
23.(8分)在室温下,向100mL Cu(IO3)2饱和溶液中加入足量的经酸化的KI溶液,反应完全后,用0.10mol/L Na2S2O3溶液滴定,消耗了40mL Na2S2O3溶液。各反应如下:
I-+IO3-+H+→I2+H2O
Cu2++I-→CuI↓+I2
I2+S2O32-→I-+S4O62-(均未配平)
⑴原Cu(IO3)2饱和溶液中的物质的量浓度是多少?
⑵若Cu(IO3)2饱和溶液的密度为1.0g/cm3,室温时,Cu(IO3)2的溶解度是多少
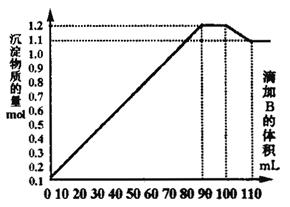 24.(12分)向100mLBaCl2、AlCl3和FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,产生的沉淀总物质的量和加入溶液B的体积关系如右图所示:
24.(12分)向100mLBaCl2、AlCl3和FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,产生的沉淀总物质的量和加入溶液B的体积关系如右图所示:
(1)当加入B溶液110 mL时,溶液中的沉淀是__________________(填化学式)。
(2)溶液B中Na2SO4与NaOH的物质的量浓度之比____________;从90 mL至100 mL之间加入10 mL B溶液时所发生的离子反应方程式是__________。
(3)将A、B溶液中各溶质的物质的量浓度填入下表:
| 溶质 | Na2SO4 | NaOH | BaCl2 | AlCl3 | FeCl3 |
| 浓度 |