高三化学《物质结构》测试题
一、选择题 (本题包括18小题,每小题3分,每小题只有一个答案符合题意)
1.下列物质既有离子键又有极性共价键的是( )
A.H2O2 B.NH4Cl C.Na2O2 D.Na2S
2.下列分子中所有原子均满足最外层8电子结构的是( )
A. LiCl B.HCl C. PCl5 D.CS2
3.具有相同质子数的两种粒子( )
A. 一定是同种元素 B.一定是一种分子和一种离子
C. 一定是不同离子 D.无法判断
4.下列过程中,共价键被破坏的是( )
A.碘升华 B.溴蒸气被木炭吸附 C.NaCl溶于水 D.HCl气体溶于水
5.短周期元素X、Y的原子序数相差2,下列有关叙述正确的是( )
A.X与Y不可能位于同一主族 B.X与Y一定位于同一周期
C.X与Y可能形成共价化合物XY D.X与Y可能形成离子化合物XY
6.2002年由德、法、美及波兰等多国科学家组成的科研小组合成了非常罕见的45 26Fe原子,有关45 26Fe的说法正确的是( )
A.它是一种新元素 B.它是一种新核素
C.45 26Fe与56 26Fe互为同素异形体 D.这种铁原子发生衰变放出两个质子后变成43 26Fe
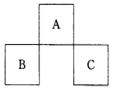 7. A、B、C均为短周期元素,它们在周期表中的位置如右图所示。已知:B、C两元素的核电荷数之和是A元素原子序数的4倍。则A、B、C分别是( )
7. A、B、C均为短周期元素,它们在周期表中的位置如右图所示。已知:B、C两元素的核电荷数之和是A元素原子序数的4倍。则A、B、C分别是( )
A. C、Al、P B. N、Si、S C.O、P、Cl D.F、S、Ar
8.X和Y是短周期元素,两者能组成化合物X2Y3,已知X原子序数为n ,则Y的原子序数不可能是( )
A. n+11 B.n+3 C.n-5 D.n-6
9.在一定条件下,RO3-与R-发生如下反应:RO3-+5R-+6H+==3R2+3H2O,下列关于R元素的叙述正确的是( )
A. 位于VA族 B.R的氢化物的水溶液属于强酸
C.RO3-中的R只能被还原 D.R2 在常温常压下一定是气体
10. 正电子、反质子等都属于反粒子,它们跟普通电子、质子的质量、电量均相等,而电性相反。科学家设想在宇宙的某些区域可能存在完全由反粒子构成的物质——反物质。1998年初和年底,欧洲和美国的科研机构先后宣布:他们分别制造出9个和7个反氢原子,这是人类探索反物质的一大进步。你推测反氢原子是( )
A. 由1个带正电的质子和1个带负电的电子构成
B.由1个不带电的中子和1个带负电荷的电子构成
C.由1个带负电的质子和1个带正电的电子构成
D.由1个带负电荷的质子和1个带负电荷的电子构成
11.下列粒子的个数比不是1:1的是( )
A. NaHCO3晶体中的阴离子和阳离子 B. Na2O2固体中的阴离子和阳离子
C.氧原子中的质子和中子 D.NH3分子中的质子和电子
12.下列各组物质中,都是由极性键构成的极性分子的一组是( )
A.CH4和Br2 B.NH3和H2O C.H2S和CCl4 D.CO2和HCl
13.联氨N2H4可用来除去高压锅炉中溶解的氧(N2H4+O2→N2+H2O未配平),有关叙述中正确的是( )
A. 联氨分子中只有极性键 B.联氨分子中只有非极性键
C.联氨在高压锅炉中可生成HNO3 D.1kg联氨恰可除去1kg溶解氧
14. 可能存在的第119号未知元素,有人称为“类钫”,根据周期表结构及元素性质变化趋势,有关“类钫”的预测,说法不正确的是( )
A.类钫”在化合物中呈+1价 B.“类钫”具有放射性
C.“类钫”单质的密度大于1g·cm-3 D.类钫”单质有较高的熔点
15. 下列离子中,电子数大于质子数且质子数大于中子数的为( )
A.D3O+ B.Li+ C.OD- D.OH-
16.最近科学界合成一种“二重结构”的球形物质分子是把足球型C60分子容纳在足球Si60分子中,外面的硅原子与里面的碳原子以共价键结合。下列关于这种物质的叙述正确的是( )
A.是混合物 B.是化合物 C.不含极性键 D.其晶体属于原子晶体
17. 下列各图为周期表中的一部分,原子序数与其位置不相符的是( )
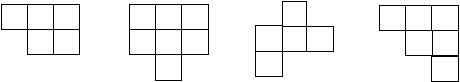
![]()
2 12 6
9 10 3 4 5 21 15
12 37 34
A. B. C. D.
18. A、B、C、D是四种短周期元素,已知A、C同主族,B、D同周期,A的气态氢化物比C的气态氢化物稳定;B的阳离子比D的阳离子氧化性强,若B的阳离子比C的阴离子少一个电子层,下列比较不正确的是( )
A.原子序数:A>B>C>D B.原子半径:D>B>C>A
C.单质熔点:D>B,C>A D.简单离子半径:C>A>D>B
高三化学《物质结构》答题卷
选择题(54分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | |||||||||
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
二、填空题(每空2分)
19.X、Y、Z为三个不同短周期非金属元素的单质。在一定条件下有如下反应:
X+Y==A(g),Y+Z==B(g)。请针对以下两种不同情况回答:
(1)若常温下X、Y、Z均为气体,且A和B化合生成固体C时有白烟产生,则:
a) Y的化学式是 ;
b) 生成固体C的化学方程式是 。
(2)若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
a) B的化学式是__________;
b) 向苛性钠溶液中通入过量的A,反应的离子方程式是 ;
c) 将Y与(1)中某单质的水溶液充分反应可生成两种强酸,该反应的化学方程式是 。
20.有下列物质:①CO2 ②H2O ③NaOH ④Na2O ⑤Na2O2 ⑥NaCl 用序号填空:
(1)只含有离子键的是_____ _____, (2)只含有共价键的是 ,
(3)既含有离子键,又含有共价键的是 。
21.A、B、C、D均为短周期元素,且原子序数逐渐增大。A、D同主族,A与B的质子数之和等于C的质子数,A+与C2-核外电子数之和等于D+的核外电子数,B原子与D+的核外电子数之和等于E原子的核外电子数。
(1)A、B、C、D、E的元素符号分别为 。
(2)D、E元素可组成化合物甲,电解甲的水溶液时,反应的离子方程式为 ;A、C元素可组成原子个数比为1:1的化合物乙,将E单质通入乙的水溶液中,生成一种强酸,并有气体放出,反应的化学方程式为 。
(3)A、B、C、E中的任意三种元素形成的化合物,其中既含离子键又含共价键,且水溶液呈酸性的化合物有(写出两种化合物) 。
(4)A、C、D、E中的任意三种元素可组成多种化合物,其中溶于水时能抑制水的电离的化合物有(写出两种不同类别的化合物) ,它们能抑制水的电离的理由是 。
22.有原子序数依次增大的A、B、C、D、E五种短周期元素,它们可以组成甲、乙、丙、丁四种化合物,各化合物中原子个数比如下表。
| 甲 | 乙 | 丙 | 丁 | |
| 化合物中各元素原子个数比 | A:C=1:1 | B:A=1:2 | D:E=1:3 | B:E=1:4 |
其中A、B两种原子的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2个°周期表中,C是E的邻族元素,化学性质活泼;D和E则位于同周期,且D和E的原子序数之和为30。
(1)D和E同属于哪一周期 。推断依据是 。
(2)向甲的水溶液中加入MnO2,反应的化学方程式是 。
(3)已知乙的相对分子质量小于甲。写出实验室制取乙的化学方程式
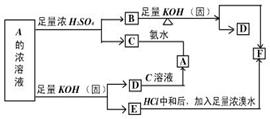 23.某物质A的水溶液在一定条件下发生如图所示的一系列反应,其中C、D为中学化学中的常见气体,请回答。
23.某物质A的水溶液在一定条件下发生如图所示的一系列反应,其中C、D为中学化学中的常见气体,请回答。
A—F的化学式: A B C D E F
三、计算题(8分)
25.某元素的一种原子X,其氧化物XCl21.11g配成溶液后,需要用Imol·L-1的AgNO3溶液20mL才能把氯离子完全沉淀,已知此原子中有20个电子。
(1)试计算X的质量数。
(2)试推算该元素的原子序数,在元素周期表中的位置,并指出该元素的名称。