高三化学《氧族、碳族》单元测试
可能用到的原子量:
H-1 O-16 Mg-24 S-32 Cl-35.5 Mn-55 Fe-56 Cu-64
第Ⅰ卷 (共64分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。
1.臭氧分子的结构与SO2(极性分子)相似,可读做二氧化氧,在臭氧层中含量达0.2ppm(ppm表示百万分之一)。臭氧是氧气吸收了太阳的波长小于220nm的紫外线形成的,不过当波长在220 nm~320 nm的紫外线照射臭氧时,又会使其分解。下列说法中正确的是
A.打雷时也能产生臭氧,臭氧分子是直线型分子
B.臭氧转化为氧气和氧气转化为臭氧均须吸收能量
C.臭氧和氧气的相互转化能保持大气中臭氧的含量基本稳定
D.向大气中排放硫、氮的氧化物和氟氯代烃均能抑制臭氧的分解
2.“空对空”响尾蛇导弹头部的“红外眼睛”,能分辩出0.001℃的温差变化,它是由热敏陶瓷材料和热释电陶瓷材料做成的。下列叙述中不正确的是 ( )
A.“红外眼睛”对热非常敏感
B.“红外眼睛”的热目标是敌机发动机或尾部喷口高温区
C.“红外眼睛”的电阻值随温度明显变化
D.“红外眼睛”的工作原理与人眼相同
3.制取硫酸时,混合气体的组成是:SO27%、O211%、N282%。将100体积混合气体进入接触室反应后,导出的气体恢复到原温度和压强时,变为97.2体积,则SO2的转化率是
A.40% B.60% C.80% D.90%
4.下列有关实验问题的处理方法正确的是
A.浓硫酸不慎溅到皮肤上,应立即用碳酸钠溶液冲洗
B.制备气体时为防止气流不通畅,应检查乳胶管是否弯折堵塞
C.燃着的酒精灯打翻在桌面上引起失火,可用水浇灭
D.铜与浓硫酸反应时,用蘸有浓溴水的棉花放在导管口吸收多余的气体
5.在右下图的实验装置中,从实验开始过一段时间,对看到的现象叙述不正确的是
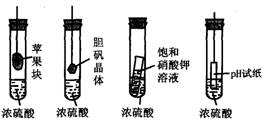 A.苹果块会干瘪
A.苹果块会干瘪
B.胆矾晶体表面有“白斑”
C.小试管内有晶体析出
D.pH试纸变红
6.已知NaHSO4在水中的电离方程式为:NaHSO4=== Na+
+ H+ + SO![]() 。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是( )
。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是( )
A.该温度高于25℃
B.由水电离出来的H+的浓度是1.0×10-10mol·L-1
C.NaHSO4晶体的加入抑制了水的电离
D.该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性
7、用密度为1.32g·mL-1的稀H2SO4溶液逐滴滴入BaCl2溶液中至不再产生沉淀为止。已知反应后所得溶液质量和加入的BaCl2溶液质量相等,则该稀H2SO4溶液的浓度为 ( )
A.21.9% B.42. 1% C.13.5mol·L-1 D.5.67mol·L-1
8.PH=5的H2SO4溶液稀释1000倍后,溶液中c(H+):c(SO42--)约为
A.1∶2 B.1∶10 C.1∶20 D.20∶1
二、选择题(本题包括8小题,9-16每小题4分;每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为O分,若正确答案包括两个选项,只选一个且正确得2分,多选、错选均不得分)
9.下列反应必须用稀硫酸,而不能用浓硫酸的是
A.跟锌反应制氢气 B.跟苯、浓硝酸作用制硝基苯
C.溶解金属铜 D.作乙酸乙酯水解的催化剂
10.除去SO2中的SO3,可选用的试剂是
A.石灰水 B.98.3%的浓硫酸 C.饱和NaHSO3 D.KMnO4
11.下列离子方程式正确的是
A.向明矾溶液中滴加Ba(OH)2溶液至Al3+恰好完全沉淀:
Al3++2SO42-+3OH-+2Ba2+=2BaSO4↓+Al(OH)3↓
B.向FeI2溶液中通入Cl2至Fe2+恰好完全被氧化2Fe2++Cl22Fe3++2Cl-
C.酸雨久置pH变小:2H2SO3 + O2 = 4H+ + 2SO42-
D.将少量SO2气体通入NaClO溶液中:SO2 + H2O + ClO- =SO42- + Cl- + 2H+
12.下列溶液中能吸收二氧化硫气体,但无沉淀产生的是:
A.氢硫酸 B.氯水 C.石灰水 D.亚硫酸钠
13.无论在酸性还是在碱性溶液中,均能大量共存的离子组是:
A.K+、SO32-、S2-、SO42-; B.Na+、Cu2+、SO42-、Cl-;
C.Br-、Ba2+、Cl-、K+; D.Ca2+、K+、CO32-、HS-
14.下列有关过氧化氢的说明不正确的是
A.H2O2是极性分子 B.H2O2具有弱酸性
C.H2O2既具有氧化性,又具有还原性 D.H2O2易分解生成H2和O2
15.在100mL含等物质的量的HBr和H2SO3的溶液中通入0.01molCl2,有一半Br -变成Br2,(已知Br2能氧化H2SO3)。原溶液中HBr和H2SO3的浓度都等于
A.0.0075mol/L B.0.008mol/L C.0.075mol/L D.0.08mol/L
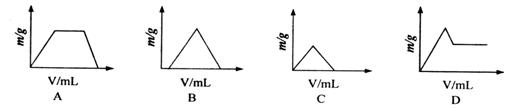
16..将通量CO2通入NaOH和Ca(OH)2的混合稀溶液中,生成沉淀的质量(m)和通入CO2(V)关系图,正确的是 ( )
第Ⅱ卷 (共76分)
三、实验题:本题包括2小题, 共21分
17.(14分) 某研究性学习小组的同学对绿矾受热分解的情况进行探究。
(1)资料表明,在加热条件下三氧化硫具有比较强的氧化性。甲同学认为,绿矾受热分解的产物是FeO、SO3、H2O。你支持甲同学的观点吗?说明你的理由
;
(2)实验是解决问题的重要手段。乙同学用如下装置通过实验来探究绿矾受热分解的产物情况(加热及夹持装置未画出):
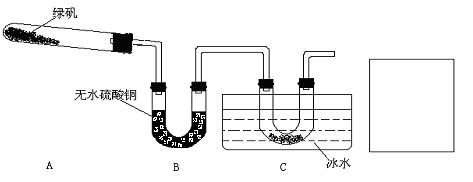
实验过程中发现:装置A中有残留固体,装置B中无水硫酸铜变蓝,装置C中的U形管中有无色晶体出现。
回答下列问题:
①在装置C导管出口处还应有的实验现象是
;
②装置A中残留的固体是 ;装置C中的U形管中无色晶体是 ;
③乙同学为了验证绿矾受热分解的所有产物,在C装置后连接了一个装置,并选用了合适的药品不仅达到了实验目的而且还起到了一举两得的效果。请你在C装置后的方框中画出该装置,并注明选用的药品。
④写出绿矾受热分解的化学方程式 。
18、2003年12月23日22时许,重庆市开县境内中石油川东北气矿罗家16号井发生天然气井喷事故,"井喷"事故中从地下喷发出大量天然气和硫化氢气体,243人遇难 。
请用你学到的有关科学知识回答下列问题:
(1) 井喷事故中造成大量人员遇难的原因是什么? 。
(2)在野外发生有毒气体大面积泄漏时,在无法找到防毒面具的情况下,可采取什么措施防止中毒? 。
(3)为防止井喷事故中更大的人员伤害,抢险人员采用了点火燃烧的方法来除去该有毒气体,试写出该气体燃烧的化学方程式。 。
(4)在石油钻井中,为防止钻井发生井喷事故,要根据井下压强,将重晶石粉(密度4.5g·cm3左右)与泥浆按一定配比混合后灌入井中。写出重晶石的化学式 。 试说明重晶石粉为什么可做压井材料?
(5)含硫地区钻井液的PH值要求控制在9.5以上。请思考为什么要控制钻井液的PH值?
。
试猜测用于调节控制液的PH值的化学物质可以是什么物质? ,
写出控制液与井下有毒含硫气体可能发生的化学反应的方程式 。
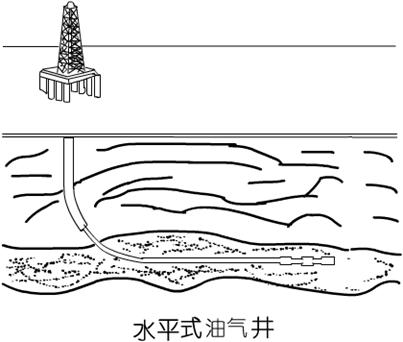
(6)进行科技创新,我们完全可将石油、天然气中含有的有毒气体在地下就消除掉,不让它跑到地面上来。下图是水平式油气钻井示意图(川东北气矿罗家16号井就是一种水平钻井),请你设计一个合理、大胆的不让含硫有毒气体从天然气中跑到地面来的设想方案。
|
|
|
|
四、填空题:
19、(1)在烧制砖瓦时,黏土中铁的化合物在用炭焙烧过程中生成 而制成红砖;若焙烧后期从窑顶喷淋水中,窑内产生大量的 气体,它们把红砖还原成青黑色,黑色物质的主要成分是 ,它与未燃烧完的炭颗粒形成青砖。
(2)陶瓷工业中,常遇到因陶土中混有氧化铁而影响产品质量。解决的办法是把陶土和水一起搅拌,使微粒直径达纳米级,然后插入两根石墨电极,接通直流电源,此时阳极聚集 ,阴极聚集 。其理由是 。
(3)我国古代炼丹中经常使用红丹,俗称铅丹。在一定条件下铅丹(用X表示)与硝酸能发生如下反应:X+4HNO3→PbO2+2Pb(NO3)2+2H2O
①铅丹的化学式是 ,此铅丹中的铅的化合价是 。
②由此反应可推测PbO是 性氧化物,PbO2是 性氧化物。
20、.A、B、C 是短周期ⅠA 和ⅡA 族元素的碳酸盐,它们的质量分别为 mA、mB、mC,与足量盐酸完全反应,消耗盐酸的物质的量分别为 nA(HCl)、nB(HCl)、nC(HCl)。已知:mA= mB+ mC,nA(HCl)= nB(HCl)+ nC(HCl)。请填空:
(1)写出短周期ⅠA 和ⅡA 族元素形成的所有碳酸盐的名称: 。
(2)若以MA、MB和MC分别表示 A、B、C 的相对分子质量,试写出 MA、MB和MC三者的相互关系式 。
(3)A 的正确选择有 种,其化学式为: 。
(4)若 A 和 B 为ⅡA 族元素的碳酸盐,C 为ⅠA 族元素的碳酸盐,则 A、B、C 的化学式依次是 ,mB∶mC= 1∶ 。
21、“9·11”事件发生后,美国世贸大厦轰然倒下。在清理废墟中,人们发现很多石棉。石棉是一种压缩强度大、柔软性强、耐热、耐火、耐酸和耐碱的腐蚀,而且价格低廉的硅酸盐。石棉有毒,能使人患肺癌。
(1)有一种石棉叫做石棉矿青石棉,其化学式为Na2Fe5Si8O22(OH)2写成氧化物的形式为
;分子中铁的氧化数为 ,我们可以看作 ;其物质的量分数为 。
(2)云母是一种重要的硅酸盐,它具有韧度、弹性、透明度、高电解强度、化学惰性和热稳定性。
![]() 叶蜡石的成分为AlSi2(OH)O5,白云母可看作叶蜡石中 的Si(Ⅳ)被Al(Ⅲ)所取代,再由K(I)平衡其电荷形成的,则白云母写成氧化物的形式为 。
叶蜡石的成分为AlSi2(OH)O5,白云母可看作叶蜡石中 的Si(Ⅳ)被Al(Ⅲ)所取代,再由K(I)平衡其电荷形成的,则白云母写成氧化物的形式为 。
(3)研究表明,在原硅酸盐中,Al(Ⅲ)很容易取代Si(Ⅳ)而不会引起原硅酸盐结构大的变化。从立体几何的知识看,Al(Ⅲ)与Si(Ⅳ)最直接的关系是 。
22.A和B在常温下都是气体,A和B在空气中都不能被点燃,A的式量比B大。现分步实验如下:在A溶液中通入适量B气体,溶液酸性增强,继续加硝酸钡溶液反应,得到一种不溶于稀硝酸的白色沉淀。过滤,滤液无色,再向滤液中加入硝酸银溶液,析出另一种不溶于稀硝酸的白色沉淀。根据上述叙述写出:(1)A、B两种气体的名称:A_______ B________。
(2)写出上述实验各步反应的离子方程式:_______________,______________,______________。
23.A、B、E为固体化合物,D、G为固体单质,F、X、Z为可燃性气体,且F、X燃烧的火焰呈蓝色或淡蓝色,在一定条件下能实现下图所示的变化:
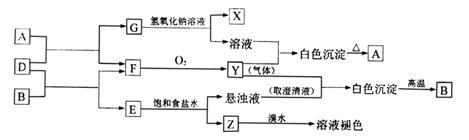 |
填写以下空白:
(1)写出A、B、Z的名称:A: ,B: ,Z: 。
(2)写出G和NaOH溶液反应的化学方程式,并标明电子转移的方向和数目: ,该反应中氧化剂的化学式是 。
五.计算题
24.(8分)有三种不同质量的氧化铜与炭粉的混合样品①、②、③。甲、乙、丙三同学各取一种样品。加强热充分反应,测定各样品中氧化铜的量。
(1)甲取样品①强热,若所有固体为金属铜,将其置于足量的稀硝酸中微热,产生1.12L气体(标准状况),则样品①中氧化铜的质量为 g。
(2)乙取样品②a g强热,生成的气体不能使澄清的石灰水变浑浊。再将反应后的固体与足量的稀硝酸微热,充分反应后,有b g固体剩余,该剩余固体的化学式为 ,样品②中氧化铜质量为 g(以含a、b的代数式表示)。
(3)丙称量样品③强热后剩余的固体,质量比原样品减小了cg,若该固体为金属铜,则样品③中氧化铜的物质的量(n)的取值范围为 。
25.1.0 L H2S气体和a L空气混合后点燃,若反应前后气体的温度和压强都相同(20℃、101.3kPa)。试讨论当a的取值范围不同时,燃烧后气体的总体积V(用含a的表达式表示,假定空气中氮气和氧气的体积比为4∶1,其他成分可忽略不计)
| a的取值范围 | 燃烧后气体的总体积V |
化学答题卷
班级 姓名 成绩
一、二、选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | ||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
三、填空
 17、(1)
17、(1)
(2)① ②
③

④
18、⑴ ⑵
⑶ ⑷ 、
⑸ 、 、
⑹
四、填空题
19、⑴ 、 、 ⑵ 、 、
⑶ 、 、 、
20、⑴ ⑵
⑶ 、 ⑷ 、
21、⑴ 、 、 、
⑵ ⑶
22、⑴A、 B ⑵
、 ,
23、⑴A、 B 、 Z 、
⑵ 、
五、计算题
24、⑴
⑵ 、
⑶
25、
| a的取值范围 | 燃烧后气体的总体积V |