高三化学《氧族元素》单元测试卷
一、 选择题(每题只有一个答案)原子量Fe:56 H:1 S:32 O:16 K:39
1、 吸进人体内的O2,有2%转化为氧化性极强的活性氧副产物,如![]() 等,这些活性氧能加速人体衰老,被称为“生命杀手”。中国科学家尝试用含硒化合物Na2SeO3清除人体内的活性氧。在消除活性氧时,Na2SeO3的作用是( )
等,这些活性氧能加速人体衰老,被称为“生命杀手”。中国科学家尝试用含硒化合物Na2SeO3清除人体内的活性氧。在消除活性氧时,Na2SeO3的作用是( )
A.还原剂 B.氧化剂 C.既是氧化剂,又是还原剂 D.以上均不是
2、工业上常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制取一种广谱消毒剂,在该反应中NaClO3和Na2SO3的物质的量之比为2:1,该广谱消毒剂的化学式为( )
A.Cl2O7 B.ClO2 C.Cl2O3 D.Cl2O
3、从矿物学资料查得,一定条件下自然界存在如下反应:
14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4 下列说法正确的是( )
A.CuSO4是氧化剂,FeS2既是氧化剂又是还原剂
B.当生成7molCu2S时,共转移电子14mol
C.产物中的SO42-离子全部是氧化产物
D.该反应中氧化剂、还原剂的物质的量之比为14︰5
4、下列变化中可以说明SO2具有漂白性的是( )
A.SO2通入酸性高锰酸钾溶液中红色褪去 B.SO2通入品红溶液红色褪去
C.SO2通入溴水溶液中红棕色褪去
D.SO2通入氢氧化钠与酚酞的混合溶液红色褪去
5、有一固体混合物,其中硫元素和氧元素的质量分数分别为x和(1-3x),则该混合物的组成可能是( )
A. CuSO4、FeSO4、CuSO3 B. CuSO4、CuSO3、CuS2O3
C. ZnSO4、FeSO4、CuSO4 D. CuS、Cu2S、CuSO4
6、下列有关环境保护的说法中错误的是 ( )
A 含氮、磷化合物的生活污水大量排放可使水体富营养化
B 各国工业大量排放二氧化硫是全球气候变暖的主要原因
C 劣质装修材料中的甲醛、苯、氡气等对人体有害
D 废旧电池中的汞、镉、铅等重金属盐对土壤和水源会造成污染
7、高压电机、复印机工作时会产生臭氧,该气体有强氧化性。下列叙述中不正确的是 ( )
A.臭氧和氧气是氧的同素异形体 B.臭氧可使湿润的KI淀粉试纸变蓝
C.臭氧的存在对人体有益无害 D.自氧是很好的消毒剂和脱色剂
8、高温下硫酸亚铁发生如下反应:2FeSO4![]() Fe2O3+SO2↑+SO3↑,若将生成的气体通入氯化钡溶液中,得到的沉淀物是 ( )
Fe2O3+SO2↑+SO3↑,若将生成的气体通入氯化钡溶液中,得到的沉淀物是 ( )
A.BaSO3和BaSO4 B.BaS C.BaSO3 D.BaSO4
9、下列反应产生的气体,通过Na2SO3溶液而不反应的是
(
)
①Na2O2和CO2 ②Al和NaOH溶液 ③MnO2和浓盐酸 ④浓硝酸和铜片
⑤铜片和浓硫酸共热 ⑥固体NaCl和浓H2SO4 ⑦FeS和热稀硝酸
A.①② B.② C.①②⑤ D.全部反应
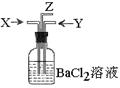 10、碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )
10、碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )
A、 气瓶中产生的沉淀是碳酸钡
B、 Z导管出来的气体中无二氧化碳
C、 气瓶中产生的沉淀是亚硫酸钡
D、Z导管口有红棕色气体出现
11、水蒸气中常含有部分(H2O)2,要确定(H2O)2的存在,可采用的方法是( )
A、1L水蒸气冷凝后与足量金属钠反应,测产生氧气的体积
B、1L水蒸气冷凝后,测氧元素的质量分数
C、该水蒸气冷凝后,测水的PH D、该水蒸气冷凝后,测氢氧原子比
12、下列结论正确的是 ( )
①微粒半径:S2->Cl>S>F ②氢化物稳定性:HF>HCl>H2S>H2Se
③离子还原性:S2->Cl->Br->I- ④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>HClO4>H2SeO4 ⑥非金属性:F>Cl>S>Se
A. ②④⑥ B. ①③④ C. 只有① D. 只有⑥
13、已知2.1g KOH和1.6g硫粉混合后加热,恰好相互完全反应:aKOH+bS=cK2Sx+dK2SO3+eH2O则x值为 ( )
A. 0 B. 1 C. 2 D. 3
14、下列实验操作中,先后顺序正确的是 ( )
A.稀释浓硫酸时,先在烧杯中加入一定体积的浓硫酸,后注入蒸馏水
B.为测定硫酸铜晶体的结晶水含量,称样时,先称取一定量的晶体,后放入坩锅中
C.为检验酸性溶液中的Cl-和SO42-,先加硝酸银溶液,滤去沉淀后加硝酸钡溶液
D.在制取干燥纯净的氯气时,先使氯气通过水(或饱和食盐水),后通过浓硫酸
15、用右图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是 ( )
|
| 气体 | a | b | c |
| A | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
| B | SO2 | 浓硫酸 | Cu | 酸性KMnO4溶液 |
| C | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| D | CO2 | 稀盐酸 | CaCO3粉末 | 浓硫酸 |
16、将一定质量的金属Zn跟100mL,18.0mol/L的浓硫酸在加热条件下充分反应。发现Zn完全溶解,生成的气体在标准状况下所占的体积为11.2L。将反应后的溶液稀释成1L,测得溶液中H+离子的物质的量浓度为2mol/L。则所生成气体中二氧化硫与氢气的体积比为
A、1:2 B、2:1 C、3:2 D、2:3
高三化学《氧族元素》单元测试卷2005-11-23
班级 座号 姓名 成绩
一、选择题(每题5分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
二、 空题
17、A、B、C、D是中学化学中常见的四种化合物,它们分别由两种元素组成.甲、乙、丙是单质,甲、丙、A、C、D常温下均为气体,B为液体。这些单质和化合物之间存在如下关系:
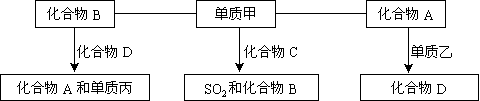
(1)写出下列物质的分子式:A_____、B_____、C_____、甲_____、丙_____。
(2)写出下列物质的电子式:A_______、B_______、C_______。
(3)写出单质甲跟化合物C反应,生成SO2和化合物B的化学方程式
(4)在密闭容器中,化合物B跟化合物D在高温下生成化合物A和单质丙的反应是可逆反应,其化学方程式H2O(g)+CO(g)==CO2(g)+H2(g);反应达平衡后,若增大体系的压强,该平衡______________(填向左移动、向右移动、不移动);其理由是
18.常温下干燥的混合气体可能由H2S、H2、Cl2、SO2、NH3、NO2、NO、CO2和O2中的某几种组成,进行以下实验:
① 混合气体无色,其密度比空气密度大。
②混合气体不能使湿润的品红试纸褪色,打开瓶塞无颜色变化。
③混合气体通过浓硫酸时有浑浊,但气体体积不变,再通过碱石灰,气体体积缩小到原来的10%。
④上述通过碱石灰的混合气体,若点燃会爆炸,恢复到常温时剩余气体体积为通过浓H2SO4和碱石灰之前的原混合气体的2.5%,若使其通过赤热的铜网,铜网表面变黑。
⑤当原混合气体通过CuSO4溶液时,剩余气体为原来的90%。
根据以上实验回答:
(1)原混合气体中一定含有 ,一定不含 。
(2)原混合气体的相对平均分子质量为 。
三、 实验题
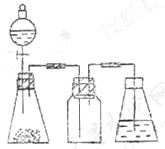
19、研究性学习小组进行SO2的制备及性质探究实验。
(1)根据反应Na2SO3(固)+H2SO4(浓)= Na2SO4 + SO2↑+ H2O ,制备SO2气体。
①用下列简图,在答题卡的方框中画出制备并收集SO2的实验装置(含试剂)示意图。
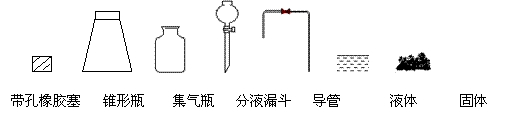 |
②实验过程中,使用分液漏斗滴加浓硫酸的操作是___ _____________
。
(2)将SO2气体分别通入下列溶液中:
①品红溶液,现象是_______________________________ _____;
②溴水溶液,现象是___________________________________________;
③硫化钠溶液,现象是_________________________________________。
(3)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象很不明显,但又不存在气密性问题。请你推测可能的原因并说明相应的验证方法(可以不填满)。
① 原因_____________________;验证方法______________ ______ ___。
② 原因_____________________;验证方法 ___________________ 。
③原因_____________________;验证方法________________________。
四、 计算题
20、某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为1.96g的该结晶水合物,分别制成溶液。一份加入足量Ba(OH)2溶液,生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色;加热该混合物,逸出能使湿润的红色石蕊试纸变蓝的气体;用稀盐酸处理沉淀物,经洗涤和干燥,得到白色固体2.33 g。另一份加入含0.001 molKMnO4的酸性溶液,MnO4-恰好完全被还原为Mn2+。 请回答以下问题:M(BaSO4)=233g/mol
(1)该结晶水合物中含有的两种阳离子是 和 ,阴离子是 。
(2)试通过计算确定该结晶水合物的化学式 。
21、白色的亚铜化合的Cu(NH4)SO3难溶于水,若与足量的10mol·L-1的硫酸溶液混合并微热,生成铜和SO2气体及溶液。
(1)完成并配平化学方程式:Cu(NH4)SO3+ H2SO4--Cu+ SO2+ CuSO4+
(2)按上述操作,铜的最高转化率是多少_______________
(3)有人设计让上述实验在密闭容器中进行,结果铜的转化率大大提高,问在密闭容器中进行反应,铜的最高转化率是 ?
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | A | B | A | B | C | B | C | D | B | D | A | A | D | D | D | C |
17
CO2、H2O、H2S、O2、H2
(2)略
(3)3O2+2H2S![]() 2SO2+2H2O
2SO2+2H2O
(4)H2O(气)+CO(气)![]() CO2(气)+H2(气);不移动;高温下化合物B为气体,反应前后气体的总体积不变。
CO2(气)+H2(气);不移动;高温下化合物B为气体,反应前后气体的总体积不变。
18(1)H2S、CO2、H2、O2 NO2、Cl2、NO、SO2、NH3 (2)40.3
19.(1) ①如图配置
②打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,缓慢滴加。
(2) ①溶液褪色
②溶液褪色
③有浅黄色沉淀(或溶液变浑浊)
(3)①NaSO3 变质
取待测试样于试管中,加适量蒸馏水配成溶液,先滴入足量稀盐酸,再滴入BaCl2 ,溶液有白色沉淀生成,则证明该NaSO3 固体变质
②不是浓硫酸
用洁净玻璃棒蘸取待测试样,涂白纸不变黑,则证明该溶液不是浓硫酸
20(1)NH4+、Fe2+,SO42-)
(2) 该结晶水合物的化学式为(NH4)2Fe(SO4)2•6H2O [或(NH4)2SO4•FeSO4•6H2O]
21、解析:(1)上述反应打用逆向配平(歧化反应,铜元素化合价既升高又降低)缺项显然为(NH4)2SO4 ,各计量系数依次为2,2,1,2,1,2,1。
(2)2molCu (NH4)SO3中的铜1mol转化为单质铜,1mol转化为CuSO4,因此,转化率为50%。
(1)若在密闭容器中进行,为何铜的转化率会提高?显然Cu(I)自身岐化转化率只能为50%,必有其它还原剂才能提高其转化率。由于产物中含SO2,SO2具有强还原性,能将Cu(II)还原为零价。其最高转化率可达100%,原因是:每生成1molCuSO4可生成2molSO2,它可提供4mol电子,完全可将CuSO4还原且SO2仍过量。