高三化学冲刺训练(5)
1.三国时代,诸葛亮领兵南征孟获,遇到了“哑泉”,士兵饮后致哑,腹痛,甚至死亡。又有一“安乐泉”饮后可解“哑泉”之毒。1995年10月国内某报刊报道,经科研人员研究,“哑泉”水中溶有CuS04,“安乐泉”水质偏碱性。下列有关说法可能符合题意的是
①“哑泉”之毒是由于水中的Cu2+使人体中的蛋白质变性
②“哑泉”之毒是由于水中的SO42-使人体中的蛋白质变性
③“哑泉”之毒是由于水中的Cu2+水解显酸性使人体中的蛋白质变性
④“安乐泉”能解“哑泉”之毒的离子方程式为CU2++2 OH-=Cu(OH)2↓
A.①④ B.②④ C.③ D.均不正确
2.下列分子中的所有碳原子不可能处在同一平面上的是
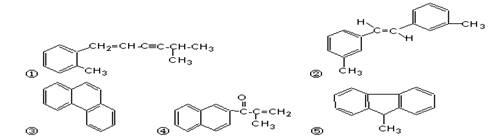
A.②③ B.①④③ C.①②④ D.①⑤
3. 尿酸是人体的一种代谢产物,关节炎形成的原因就是在关节的滑液中形成尿酸钠(通常用NaUr表示)晶体:
HUr+H2O====Ur -+H3O+ ① Ur -+Na+====NaUr ②
第一次关节炎发作的时间大都在寒冷季节,发病部位常常是手指的关节处,下列推测正确的是
A.反应②是吸热反应 B.热敷可以使关节炎的症状减轻有一定的道理
C.NaUr易溶于水 D.关节炎发病时关节滑液的pH降低
4.用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 1mol干冰晶体中含有C=O键的数目为2NA
B. 工业生产硫酸时,在接触室内每充人NA个SO2可完全转化为1molS03
C. 1molCa(ClO)2只作氧化剂且充分反应时,转移的电子数一定为2NA
D 在标准状况下2.24L乙醇含有的碳原子数约等于0.2NA
5.对下列各种溶液中所含离子的判断合理的是
A. 向无色溶液中加氯水变橙色,溶液中可能含: SO42—,Br—,OH—,Ba2+
B.在c(H+)=10-14mol/L的溶液中可能含:Na+,A1O2—,CO32—,SO32—
C. 某溶液,加铝粉有氢气放出,则溶液中可能含:K+,Na+,H+,NO3-
D.使紫色石蕊试液变红色的溶液中可能含:K+,Na+,Ca2+, HCO3—
6.下列离子方程式正确的是
A.澄清石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2十+2H2O
B.Fe(NO3)2溶液中加入盐酸:3Fe2++4H++NO3-==3Fe3+十NO↑ +2H2O
C 将等物质的量的C12和SO2与水充分反应:C12+SO2+2H2O=4H++SO42-+2C1—
D.A1C13溶液和过量的氨水反应:Al3+ +4OH-=AlO2-+2H2O
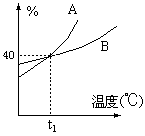 7.A、B两种物质的饱和溶液的百分比浓度随温度变化的曲线如图:现分别在50克A和80克B中各加水150克,加热溶解后并都蒸发掉水50克,冷却到t1℃,下列叙述正确的是
7.A、B两种物质的饱和溶液的百分比浓度随温度变化的曲线如图:现分别在50克A和80克B中各加水150克,加热溶解后并都蒸发掉水50克,冷却到t1℃,下列叙述正确的是
A.t1℃时溶液中A、B的质量百分比浓度相等
B.t1℃时溶液中A的浓度小于B的浓度
C.t1℃时两者均无固体析出 D.t1℃时析出固体B
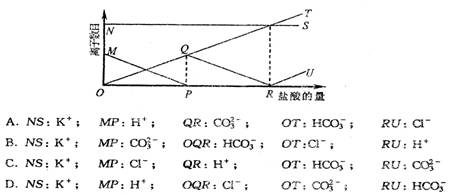
8.向一定量的K2CO3溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中离子数目也相应地发生变化,如下图所示,各条曲线与溶液中离子数目的大致对应关系相对正确的是
9.最近研究证明,钒对糖尿病的治疗有特殊的疗效,患者饮用含少量偏钒酸钠和食盐的混合溶液,4天后血液中的糖量即可恢复正常。但钒的化合物有毒,人吸收多了会得肺水肿。下列叙述正确的是
A.钒是过渡元素,在元素周期表中处于第五周期
B.人体血液中含的糖是蔗糖,医院注射所用的糖也是蔗糖
C.检测糖尿病患者尿液的实质就是检测含不含蔗糖
D.V2O5常用作制硫酸和有机合成的催化剂
10.制备氰氨基化钙的化学方程式如下:![]() +
+
![]() 关于该反应的下列说法中,正确的是
关于该反应的下列说法中,正确的是
A.反应中,氢元素被氧化,碳元素被还原
B.HCN既是氧化剂又是还原剂
C.CaCN2是还原产物,H2是氧化产物
D.CO为氧化产物,H2为还原产物
11.(1) 根据观有中学化学知识,判断下列有关实验描述正确的是 (填序号)。
A. 红砖中氧化铁成分检验用到的试剂是盐酸和硫氰化钾溶液
B. 用冰醋酸,蒸馏水和容量瓶等仪器配制pH为1的醋酸稀溶液
C. 中和滴定时,酸式滴定管用蒸馏水清洗3次后,即加入标准盐酸溶液进行滴定
D. 实验室用洁净的试管做银镜反应时不能将试管直接放在酒精灯火焰上加热
E.实验室制备乙酸乙酯时吸收液为饱和碳酸钠溶液而不用饱和碳酸氢钠溶液
(2)为了探究“淀粉溶液遇碘(I2)的显色反应”,经查阅资料得知:常温下,淀粉溶液检验碘的反应灵敏度极高。当有I—存在时,I—浓度不低于lxlO—7g/mL即可显色;而淀粉溶液的浓度在十万分之五左右即能与碘反应呈现浅蓝色。碘遇淀粉呈现蓝色的灵敏度还受其他多种因素的影响,如淀粉的种类、试剂的浓度和温度等。例如当温度升高到50℃时,碘—淀粉就不易显色;已显色的溶液,温度越高褪色也越快。
请根据下表设计方案(实验均在室温条件下进行),预测溶液的酸碱性对碘—淀粉显色灵敏度的影响及原因。
|
试管序号 | 向3支试管内各加3mL淀粉溶液,分别滴加如下试剂各10滴 | 再向混合液中各滴入3滴碘—碘化钾水溶液后,振荡,并对比,预计可能的现象 | 推侧可能的原因 |
| ① | 蒸馏水 | 显蓝色 | |
| ② | 稀盐酸 | ||
| ③ | 氢氧化钠稀溶液 |
由上述实验,可能得出的结论是
12.(10分)本世纪是生命科学研究的昌盛时期,科学家研究发现,进入生物体内的氧分子,可接受1个电子转变为超氧阴离子自由基(O2-),进而引发产生一系列自由基。一切需氧生物在其机体内均有一套完整的活性氧系统(抗氧化酶和抗氧化剂),能将活性氧转变为活性较低的物质,机体因此受到保护。人们利用羟胺(NH2OH)氧化的方法可以检测其生物系统中O2-含量,原理是O2-与羟胺反应生成NO2-和一种过氧化物。NO2-在对氨基苯磺酸和α—萘胺作用下,生成粉红的偶氮染体,染体在λ=530nm处有显著吸收,且其吸收值与c(NO2-)成正比,从而可计算出样品中的O2-含量。某实验室用以上方法处理后测得溶液中c(NO2-)=2.500×10-3 mo1.L-1。
(1)请根据测定原理写出有关反应的离子方程式:_________________;
(2)计算该样品此时c(O2-)=___________________________;
(3)如用羟胺氧化法测定O2-时,将其生成的过氧化物作为检测物,若选用氧化还原法进行定量分析(KMnO4或K2Cr2O7.任选一种即可)
①请写出其测定原理的反应方程式:______________________;
②测定所用的主要玻璃仪器为___________,通过观察____________的现象可确定测定反应是否进行完全。
|
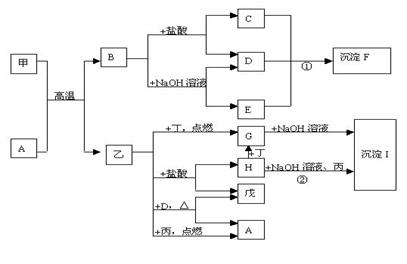
请填写下列空白:
(1)物质A的化学式是 ,
甲的原子结构示意图是
, 丁的电子式是
。
(2)反应①的离子方程式是 。
(3)反应②的化学方程式是
。
14.(10分)2005年诺贝尔化学奖由法国科学家YvesChauvin、美国科学家RobertH.Orubbs、 RichardR.Schrock共同获得。以表彰他们在烯烃复分解反应方面研究与应用所作出的贡献。已知烯烃的交叉复分解反应机理为双键断裂,换位连接。
又已知:R—CH2—CH=CH2+Cl2 R—CHCl—CH=CH2+HCl
有机物R是烃的含氧衍生物(分子式为:C9H14O6),常用作纤维的增塑剂以及化妆晶等,F也可由油脂水解得到,有机物R的合成路线如下:
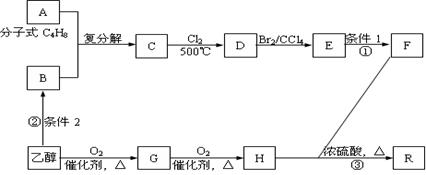
试回答下列问题:
(1)写出反应①、②的反应条件:条件1 ;条件2 。
(2)写出结构简式,A: ;E: 。
(3)写出反应③的化学方程式: 。
15.(8分)化合物CO、HCOOH、OHC-COOH分别燃烧时,消耗O2和生成的CO2的体积比都是1:2。后两者的分子式可以分别看成是(CO)(H2O)和(CO)2(H2O),也就是说只要分子式符合[(CO)m(H2O)n](m和n为正整数)的各种有机物,它们燃烧时消耗的O2和生成的CO2的体积比总是1︰2。现有一些含C、H、O三种元素的有机物,将它们在足量空气中燃烧,再将所得的混合气体(包括水蒸气)通过Na2O2层(反应完全),发现实际消耗O2的(燃烧消耗O2的体积减去气体通过Na2O2层后生成的体积)与生成CO2的体积之比为1︰4。
(1)在满足已知条件的有机物中,相对分子质量最小的化合物的分子式是 ;
(2)这些有机物满足的通式是 ;
(3)某两个碳原子数目相同的上述有机物,若它们的相对分子质量分别为a和b(a<b),则a和b满足的一般关系式是 。
高考化学冲刺训练(5)
1、A 2、D 3、BD 4、A 5、B 6、BC 7、BD 8、B 9、D 10、B
12.(10分)![]()
(2)5.000×10-3 mol·L-1 (3分)
(3)![]()
②酸式滴定管、锥形瓶锥形瓶中溶液的紫红色(或橙黄色)是否褪去(3分)
13、(1)Fe3O4,
(2)Al3++3AlO2-+6H2O====4Al(OH)3↓ (3)4FeCl2+O2+8NaOH+2H2O====4Fe(OH)3+8NaCl
或FeCl2+2NaOH====Fe(OH)2↓+2NaCl
4Fe(OH)2+O2+2H2O====4Fe(OH)3
![]()
14、(10分)
⑴ 条件1 氢氧化钠水溶液,加热 (2分) 条件2 浓硫酸,170℃(加热) (2分)
⑵ A CH3CH=CHCH3 (2分) E CH2C1CHBrH2Br (2分)
⑶ 3CH3COOH
+ CH2OHCHOHCH2OH→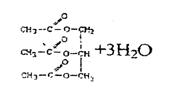 (2分)
(2分)
15.(8分)(1)C2H4O (2分) (2)(C2O)mH2n(2分)
(3)b-a=2k(k为自然数)(4分)
 实验步骤
实验步骤