高考章节复习(氧族元素精选非选择题)
1.已知X是淡黄色固体,A、B是盐,其焰色反应呈黄色,C是硫酸盐,D、E是无色气体。A、B、C、D、X之间的转化关系如下:
(1)A+H2SO4(稀)→C+D↑; (2)B+H2SO4→C+E↑+H2O;
(3)D+E→X+H2O; (4)B+O2→C; (5)X+NaOH→A+B+H2O
试推断化学式:A________,B_______,C________,
D________,E_______,X________。
2.(1)实验证明铜不能在低温下与O2反应,也不能与稀H2SO4共热发生反应,但工业上却是将废铜屑倒入热的稀H2SO4中并通入空气来制备CuSO4溶液。
铜屑在此状态下被溶解的化学方程式为________________________________________。
(2)在过氧化氢跟稀硫酸的混合溶液中,加入铜片常温下就生成蓝色溶液。写出有关化学方程式__________________________________________________。
3.从下列A组物质中选择一种试剂,除去B组物质中的少量杂质,将正确答案的序号填入B组的括号内。A组:(A)浓硫酸 (B)饱和石灰水 (C)氯水 (D)CO2(E)氯化钡溶液
B组:(1)碳酸氢钠溶液中混有碳酸钠( ) (2)苛性钠溶液中混有碳酸钠( )
(3)硫酸钠溶液中混有亚硫酸钠( ) (4)氯化钾溶液中混有碘化钾( )
(5)氯化钾溶液中混有碘化钾( )
4.硫酸具有以下(A)-(E)所示的性质,试选择正确答案编号填在①-②所示变化的相应空格处:
(A)在水中电离,并呈强酸性;(B)高沸点难挥发;(C)浓硫酸具有吸水性;(D)浓硫酸具有脱水性;(E)浓硫酸具有强氧化性;(F)浓硫酸溶于水放出大量热。
①铜片与浓硫酸共热产生二氧化硫气体______________________。
②将稀硫酸滴在一张纸片上,再烘干(纸片不接触灯焰),发现纸片中滴过酸液的部位先变黑最后留下一个洞_________________________。
③蔗糖晶体中滴入适量的浓硫酸,再在滴有浓硫酸处加滴2-3滴水。发现加水处立即黑,黑色区不断扩大,最后变成一块疏松的焦炭,并伴有刺激性气味气体产生。_________。
5.某亚硫酸钠试剂已部分被氧化,为确定它的纯度,要进行如下实验:①称取样品w1g; ②将样品溶解;③给溶液加入稍过量的盐酸酸化了的BaCl2溶液;④过滤、洗涤、干燥沉淀,称其质量为w2g.试回答:
(1)BaCl2要用盐酸酸化的原因是___________________________________________________;
(2)BaCl2溶液要稍过量的原因是____________________________________________________;
(3)判断操作③是否完成的方法是___________________________________________________;
(4)判断沉淀是否洗净的方法是 ____________________________________________________;
(5)Na2SO3纯度的表示式为______________________________________。
6.一种白色晶体A极易溶于水,将A配成溶液进行如下框图所示的实验,实验现象及转化关系如下列框图所示。
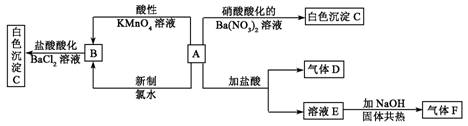
其中A为正盐,气体D能使品红溶液褪色,气体F能使湿润的红色石蕊试纸变蓝。试回答下列问题:
(1)写出下列物质化学式:A:_________________;C:_________________;
(2)写出下列反应的离子方程式:
①A和酸性KMnO4溶液:____________。②A和新制氯水:__________________________。
(3)通过本题的解答在检验SO![]() 时是使用HCl酸化的BaCl2溶液还是使用硝酸酸化的Ba(NO3)2,你得到的启示是:____________________________________。
时是使用HCl酸化的BaCl2溶液还是使用硝酸酸化的Ba(NO3)2,你得到的启示是:____________________________________。
7.在一烧杯中盛有100mL2mol/LH2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央(如下图所示)。向该烧杯里缓缓注入0.4mol/L的Ba(OH)2溶液至恰好完全反应,在此实验过程中:
(1)烧杯里观察到的实验现象是:
①___________________________________;②__________________________________
(2)写出实验过程中反应的离子方程式:
__________________________________。
8.实验室中根据2SO2+O2![]() 2SO3+196.6kJ设计如下图所示实验装置来制备SO3固体。请回答下列问题。
2SO3+196.6kJ设计如下图所示实验装置来制备SO3固体。请回答下列问题。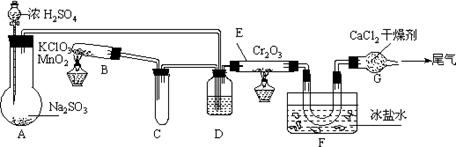
⑴实验前,必须进行的操作是(填操作名称,不必写具体过程)
⑵在A装置中加入Na2SO3固体的同时,还需加几滴水,然后再滴加浓硫酸。加几滴水的作用是
⑶小试管C的作用是
⑷广口瓶D内盛的试剂是 。装置D的三个作用是
①
②
③
⑸实验中当Cr2O3表面红热时,应将酒精灯移开一会儿再加热,以防温度过高,这样做的原因是
⑹装置F中U型管内收集到的物质的颜色、状态是
⑺装置G的作用是
⑻从G装置导出的尾气处理方法是
9.将1.95g由Na2SO4和Na2CO3组成的混合物溶于水得溶液A,在A中加入10mL未知浓度的BaCl2溶液恰好完全反应,过滤得沉淀B,向B中加入足量稀硫酸,沉淀不消失反而增加0.18g。计算:
(1)原混合物中Na2CO3的质量分数。 (2)BaCl2溶液的物质的量浓度。
10.将一定量混合均匀的铁粉与硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A。将质量为m的固体A加入到300mL 2mol·L-1盐酸中使之完全溶解。测得室温下加入固体A的质量与收集到气体体积(已换算成标准状况)的关系如右图所示(假设所得氢硫酸溶液饱和前无硫化氢气体逸出)。
已知加入固体A的质量m≤3.2g时,收集到的气体为氢气;当m>3.2g时,收集到的气体来H2和H2S的混合气。试分析与计算:
(1)3.2g固体A中各物质的物质的量分别为 ,溶于上述盐酸充分反应后,所得溶液中氢硫酸的物质的量浓度为(忽略溶液体积的变化)
;
(2)当固体A全部溶于上述盐酸,且A的质量m>3.2时,收集到的气体体积(标准状况下)V= mL(用含m的代数式表示)。
11.硫酸是极其重要的化工原料,在工业、农业、医药、军事等领域应用广泛。工业上通常用接触法制硫酸,主要原料是硫铁矿和空气。接触法制硫酸的生产过程大致可分为三个阶段:二氧化硫的制取和净化;二氧化硫转化为三氧化硫;三氧化硫的吸收和硫酸的生成。
问题1:设空气中N2、O2的含量分别为0.80和0.20(体积分数),则110
L空气和足量的FeS2完全反应后,气体体积(同温同压)变为___________L。(已知:4FeS2 + 11O2![]() 2Fe2O3 + 8SO2)
2Fe2O3 + 8SO2)
问题2:为了防止环境污染并对尾气进行综合利用,硫酸厂常用氨水吸收尾气的SO2、SO3等气体,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。
为了测定测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液50.00 mL,加热至120℃左右,使氨气全部逸出[(NH4)2SO4和NH4HSO4的分解温度均高于200℃],测得有关实验数据如下(标准状况):
| 实验序号 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L |
| 1 | 3.62 | 50.00 | 0.896 |
| 2 | 7.24 | 50.00 | 1.792 |
| 3 | 10.86 | 50.00 | 2.016 |
| 4 | 14.48 | 50.00 | 1.568 |
⑴由1组数据直接推测:1. 81 g样品进行同样实验时,生成氨气的体积(标准状况)为__________L。
⑵试计算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比为___________。
⑶求所用NaOH溶液的物质的量浓度。(写出计算过程)
12测定水中溶解氧气的方法是:取a mL水样,迅速加入MnSO4溶液及含有NaOH的KI溶液,立即塞好塞子、振荡,使反应充分;开塞,迅速加入适量H2SO4,此时有I2生成;用Na2S2O3溶液(浓度b mol·L-1)和I2反应,消耗了V mL达到终点(以淀粉作指示剂)。有关方程式为:
①2Mn2++O2+4OH-===2MnO(OH)2(反应很快)②MnO(OH)2+2I-+4H+===Mn2++I2+3H2O
③I2+2S2O32—===S4O62—+2I-
(1)需要进行滴定的反应是________________,终点的颜色变化为__________________。
(2)水中溶解O2为(以mg/L为单位)_____________________。
(3)加MnSO4及含NaOH的KI溶液振荡时,塞子若未塞紧(设未溅出溶液),测得结果将___________(填“偏高”“偏低”或“无影响”),原因是_____________________。
13.下图为固体物质A及其产物发生的一系列反应的框图,每一个方框内表示有一种反应物或生成物(反应条件及反应所需和生成的水均已略去),其中A、G为反应物,C、F在常温下均为气体:
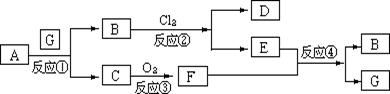
(1)试写出B和C的分子式: 。
(2)写出把F通入到E物质的水溶液中所发生的反应④的离子方程式:
________________________________________________________________.
14.将x摩尔H2S和1摩尔O2置于一个容积可变的容器内进行反应,维持容器内气体的压强不变(101千帕),在常温下测得反应前后容器内气体密度分别为d1和d2,若x的取值不同,则H2S的氧化产物可能有以下三种情况(忽略气体的溶解):
(1)全部是SO2,此时的x的取值范围是 ,且d1 d2(填大于、等于、小于)
(2)全部是S,此时x的取值范围是
(3)部分是S,部分是SO2,此时x的取值范围是 ,容器内气体的物质的量为
摩(用含x的关系式表示).
15.某无色溶液可能会有下列钠盐中的几种:(A)氯化钠,(B)硫化钠,(C)亚硫酸钠,(D)硫酸钠,(E)碳酸钠。向此溶液中加入适量稀H2SO4,有浅黄色沉淀析出,同时有气体产生。此气体有臭鸡蛋气味,可使澄清石灰水变浑浊,不能使品红溶液褪色。根据上述实验回答下列问题:
(1)不能使品红溶液褪色,说明气体中不含________气体;
(2)溶液中存在的钠盐是_________、________、___________;而且______与_______的物质的量之比要大于2:1。
16.将下列离子Cu2+、Na+、K+、NO3-、OH-、NH4+、H+、SO32-、S2-、SO42-,按可能大量共于溶液中的情况,把它们分成A、B两组,而且每组中都不少于两种阳离子和两种阴离子。试判断A组__________________________;B组______________________。
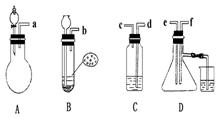 17.已知实验室制取H2S气体的原理是:FeS+H2SO FeSO4+H2S.根据 下图中A~D的实验装置和试剂进行实验,回答下列问题:
17.已知实验室制取H2S气体的原理是:FeS+H2SO FeSO4+H2S.根据 下图中A~D的实验装置和试剂进行实验,回答下列问题:
(1)装置A是由双孔塞、玻璃导管及 和 组装起来的.
(2)组装一套制取SO2气体的装置,并证明SO2既有氧化性,又有还原性.
①按实验装置连接顺序,把a![]() f各导管口连接起来,正确的顺序是 ,连 , 连 ;②C装置中的溶液是 ,反应后该溶液变为无色,说明SO2具有 性;
f各导管口连接起来,正确的顺序是 ,连 , 连 ;②C装置中的溶液是 ,反应后该溶液变为无色,说明SO2具有 性;
③D中产生的现象是 ,说明SO2具有 性;
(3)A装置中发生反应的化学方程式为 .
(4)烧杯中NaOH溶液的作用 .
18.只用氯化钡溶液及试管鉴别Na2SO3溶液和稀硫酸,简述实验步骤及结论。
19.两位同学设计了下述两个方案,并都认为如果观察到的现象和自己设计的方案一致,即可确证无色混合气体中含有CO2和SO2。
方案甲:无色气体→酸性KMnO4(褪色)→澄清石灰水(浑浊)
方案乙:无色气体→足量品红溶液(颜色变浅)→澄清石灰水(浑浊)
试评价上述各方案是否严密,并说明理由.
20.某无色溶液可能含有下列钠盐中的几种:
(A)氯化钠、(B)硫化钠、(C)亚硫酸钠、(D)硫代硫酸钠、(E)硫酸钠、(F)碳酸钠。
向此溶液中加入适量稀硫酸,有浅黄色沉淀析出,同时有气体产生。此气体有臭鸡蛋气味,可使澄清的石灰水变浑浊,不能使品红试液褪色。根据上述实验现象回答下列问题:
(1)不能使品红试液褪色,说明该气体中不含 (填分子式)。
(2)此无色溶液至少存在哪几种盐?请写出全部可能的情况(填写相应的字母):
第一种情况是: ;
第二种情况是: ;
第三种情况是: ;
第四种情况是: 。
氧族元素练习(非选择题)答案
1.Na2S、Na2SO3、Na2SO4、H2S、SO2、S
![]() 2.(1)2Cu+O2+2H2SO4(稀)=2CuSO4+2H2O
2.(1)2Cu+O2+2H2SO4(稀)=2CuSO4+2H2O
(2)Cu+H2O2+H2SO4(稀)=CuSO4+2H2O
3..B组:(1)(D) (2)(B) (3)(E)
(4)(A) (5)(C)
4.①A和E。②BDE。③C、F、D、E。
5.(1)防止BaSO3生成
(2)使SO42-完全转化为BaSO4
(3)取上层清液少许,滴加稀H2SO4,若有白色沉淀生成则操作③完成,否则未完成。
(4)取最后几滴洗液,滴加AgNO3,若无沉淀,已洗净,反之,未洗净。
(5)ω(Na2SO3)=[(233W2-142W2)/233W1]×100%
6.【命题分析】本题以框图题的形式为核心命题点,考核了《考试大纲》规定应综合应用的知识点:SO![]() 的检验,SO
的检验,SO![]() 的还原性,KMnO4、Cl2的氧化性等综合考核考生对学科主干知识的熟悉程度,突出考查学科综合能力。
的还原性,KMnO4、Cl2的氧化性等综合考核考生对学科主干知识的熟悉程度,突出考查学科综合能力。
【答案】(1)(NH4)2SO3(2分) BaSO4(2分)
(2)①2MnO![]() +5SO
+5SO![]() +6H+==2Mn2++5SO
+6H+==2Mn2++5SO![]() +3H2O(2分)
+3H2O(2分)
②Cl2+H2O+SO![]() ==SO
==SO![]() +2H++2Cl-(2分)
+2H++2Cl-(2分)
(3)在确定溶液中不含Ag+等干扰离子存在时可选用盐酸酸化的BaCl2溶液作试剂检验SO![]() ,在确定溶液中不含SO
,在确定溶液中不含SO![]() 等干扰离子存在时可选用HNO3酸化的Ba(NO3)2溶液作试剂检验SO
等干扰离子存在时可选用HNO3酸化的Ba(NO3)2溶液作试剂检验SO![]() (4分)。
(4分)。
7.(1)①溶液里产生白色沉淀 ②小球下沉 (2) Ba2++2OH—+2H++SO42—=BaSO4↓+2H2O
8.(1)检查装置的气密性
(2)水与浓硫酸作用放热,有利于SO2的放出
(3)缓冲、防止倒吸(答一即得1分)
(4)浓硫酸。①干燥SO2和O2 ②使SO2和O2混合均匀 ③通过观察控制气体比例和气流速度
(5)温度过高不利于SO3的生成,且影响催化剂的活性
(6)无(白)色晶(固)体
(7)防止水蒸气与SO3接触
(8)用NaOH溶液吸收
9.(1)27.2% (2)1.5mol•L-1
10.(1)Fe 0.01mol; FeS 0.03mol; 0.1 mol•L-1
(2)280m-672。
11.问题1: 104 问题2: (1) 0.448 (2) 1:2 (3) 3.00mol/L
12.(1)③(2分) 蓝色褪去(2分)(2)![]() ×103 mg/L (4分)(3)偏高(2分)外界空气中O2进入,氧化Mn2+(2分)
×103 mg/L (4分)(3)偏高(2分)外界空气中O2进入,氧化Mn2+(2分)
13.(1)B为FeSO4 C为H2S (2)SO2+2Fe3++2H2O=2Fe2++SO42-+4H+
14.(1)x≤2/3 d1<d2 (2)x≥2 (3)2/3<x<2
15.(1)SO2 (2)硫化钠、亚硫酸钠、碳酸钠;硫化钠、亚硫酸钠
16.Cu2+、NH4+、H+、SO42-、NO3- OH-、SO32-、S2-、Na+、K+
17. (1)分液漏斗、圆底烧瓶
(2)①a、d、c、e、f、b
②溴水或酸性KMnO4溶液 还原性
③瓶壁有浅黄色固体出现 氧化性
![]() (3)Na2SO3+H2SO4
(3)Na2SO3+H2SO4 ![]() Na2SO4+SO2↑+H2O
Na2SO4+SO2↑+H2O
(4)吸收未反应的H2S和SO2,以免污染空气
18.①分别用试管提取2mL的待测液,滴加氯化钡溶液至恰好完全反应(不产生沉淀).
②将两支试管中的液体分别加入对方试管的沉淀中,沉淀溶解、产生气体试管的原试剂为亚硫酸钠;没变化试管的原试剂为稀硫酸.
19.甲不严密.高锰酸钾是一种强氧化剂,它可以氧化二氧化硫、硫化氢……等具有还原性的气体,因此使高锰酸钾褪色的气体,不可能验证只是二氧化硫.
乙严密.能使过量的品红溶液变浅,是二氧化硫的特性,排除干扰后,余下的气体能使澄清的石灰水变浑浊,验证了二氧化碳气体.
20.(1)SO2 (2)B、C、F B、D、F
21.根据下图回答问题:
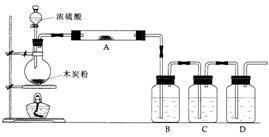 (1)上述装置中,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,还可以用什么简单的方法证明该装置不漏气。_______________________________。
(1)上述装置中,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,还可以用什么简单的方法证明该装置不漏气。_______________________________。
(2)写出浓硫酸和碳粉在加热条件下发生反应的化学方程式:______________________
(3)如果用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入的试剂的名称及其作用:
A中加入的试剂是________,作用是 。
B中加入的试剂是________,作用是 。
D中加入的试剂是________,作用是 。
(4)实验时C中KMnO4溶液发生的变化是 。
21.(1)反应前先用小火加热烧瓶,B、C、D瓶中有气泡冒出,停止加热后,水会升到导管里形成一段水柱,证明装置不漏气。
(2)C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O
(3)无水CuSO4,验证产物中有水蒸汽; 品红溶液,验证产物中有SO2;
澄清石灰水,验证产物中有CO2
(4)紫色未全部褪去