高三第二学期理科综合(化学)能力测试
(附答案)
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 Al:27 S:32
Cl:35.5 K:39 Fe:56 Cu:64 Zn:65 Br:80 Ag:108 I:127 Ba:137
5.将下列各组括号内的少量杂质除去的操作正确的是
A.FeCl2溶液(FeCl3):加足量的铁粉,振荡、过滤
B.乙醇(水): 加浓H2SO4 蒸馏
C.O2(H2、H2O): 通过浓硫酸洗气,再通过灼热的CuO 粉末
D.氢氧化铁胶体(氯化钠溶液): 过滤
6.下列实验能达到测量要求的是
A.用托盘天平称取35.20g NaCl B.用10mL量筒量取8.50mL盐酸
C.用25ml滴定管量取15.80ml溶液 D.用pH试纸测得溶液pH值为4.2
7. 在N2 + 3H2 ![]() 2NH3的体系中,保持容器中压强和温度不变,充入氩气,则下列叙述正确的是
2NH3的体系中,保持容器中压强和温度不变,充入氩气,则下列叙述正确的是
A.因为压强不变,所以平衡不移动
B.因为体积增大,所以N2 、H2、 NH3的浓度均减小,正逆反应速率均减小,平衡不移动
C.因为体积增大,相当于减小压强,平衡向体积增大的方向移动,即平衡向逆反应方向移动
D.因为加入氩气不参与反应,因此正逆反应速率均不变,平衡不移动
|
A.用铂电极电解CuSO4溶液: Cu2++2H2O Cu+O2↑+4H+
B.明矾溶液中加入过量氨水: Al3++4NH3·H2O AlO2-+4NH4++2H2O
C.碳酸氢钙溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH- CaCO3↓+CO32-+2H2O
D.乙酸溶液中加入碳酸氢铵: CH3COOH +
HCO3- CH3COO-+CO2↑+H2O
9.A、B、C、D、E五种短周期元素。A、B、C位于同一周期相邻位置,A和C的原子序数之比为3∶4,A、B、C分别与D形成的化合物分子中都含有10个电子。E的原子结构示意图中从内到外各层的电子数之比为1∶4∶1。则下列叙述中正确的是
A.A和C形成的某种化合物能与E的单质在一定条件下发生置换反应
B.实验室制备B、D两种元素形成的化合物发生的反应属于氧化还原反应
C.由A、C原子和B、D原子分别构成的分子都是极性分子
D.由A、B、C、D四种元素组成的化合物中不可能含有离子键
10.下列说法可以实现的是:①酸性氧化物均能与碱发生反应;②盐溶液与弱酸反应可以生成强酸;③发生复分解反应,但产物既没有水生成,也没有沉淀和气体生成;④两种酸溶液充分反应后,所得溶液呈中性;⑤有单质参加反应,但该反应不是氧化还原反应
A.②③④⑤ B.①③④⑤ C.①②③⑤ D.①②③④⑤
11.下列4组溶液,不用试剂也能鉴别开来的是
① AgNO3溶液、稀氨水 ② NaAlO2溶液和盐酸
③ NaHCO3、NaHSO4、Ba(NO3)2、NH4Cl ④ NaNO3、FeCl3、NaCl、AgNO3
A.只有① B.①② C.①②③ D.全部
12.由氧化铜和氧化铁的混合物ag,加入2mol·L-1的硫酸溶液50mL,恰好完全溶解,若将a g的该混合物在H2中加热充分反应,冷却后剩余固体质量为
A.1.6a g B.(a-1.6)g C.(a-3.2) g D.无法计算
第Ⅱ卷(非选择题 共180分)
25.本题包括两小题(共22分)
І. 05年8月20日辽宁沈阳某化工厂装有24吨有机液化气原料槽车发生泄漏,该液化气在空气中远超过爆炸极限,十分危急,经消防人员多次努力终于排除险情。该液化气含碳
85.7﹪ ,含氢14.3﹪,该气体是相同条件下氢气密度的21倍,可使溴水褪色。
⑴该气体的结构简式为:__________ ___, 名称为:__________________。
(2)分别写出该液化气通入溴水及发生燃烧的化学方程式:
____________________________________ ,
________________________________ ___。
Ⅱ.A、B、C、D、E、F、G、H均为含有苯环的有机物。B与FeCl3溶液混合没有颜色变化,F、H除苯环外还有一个含氧的六元环(与苯环共用2个碳原子)。它们之间的转化关系如下:
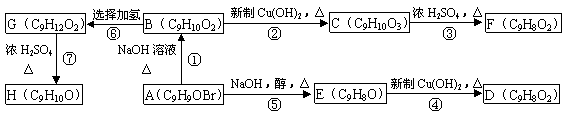 |
(1)化合物A含有的官能团是 。
(2)B、F的结构简式分别为 、 。
(3)物质D不可能具有的性质是 (填写字母)。
A.使溴水褪色 B.使酸性KMnO4溶液褪色 C.能与Na2CO3溶液反应
D.能发生酯化反应 E.能与新制的Cu(OH)2反应 F.能使FeCl3溶液变色
(4)反应⑤的反应类型是 。
(5)写出反应①的化学方程式: 。
(6)写出同时符合下列两项要求的C的两种同分异构体的结构简式
①化合物是1,3,5—三取代苯 ②苯环上的三个取代基中必须含有醇羟基、酚羟基和醛基这三种结构
。
26.本题包括两小题(共14分)
І. 配平氧化还原反应方程式,回答问题。
(1) NH3 + NO2 →_ N2 + H2O
(2)氧化产物与还原产物的质量比为 。
Ⅱ.一种白色晶体A极易溶于水,将A配成溶液进行如下框图所示的实验,实验现象及转化关系如下列框图所示。
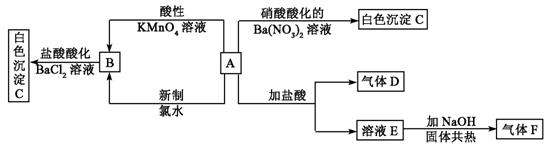
其中A为正盐,气体D能使品红溶液褪色,气体F能使湿润的红色石蕊试纸变蓝。试回答下列问题:
(1)写出下列物质化学式:A:_________________;C:_________________;
(2)写出E的电子式_____________;F的结构式__________________。
(3)写出下列反应的离子方程式:
①由B生成C:________________________________________________________
②A和新制氯水:___________________________________________________。
27.本题包括两小题(共18分)
І. 下列有关化学实验的操作或说法中,正确的是(填字母代号) 。
A.实验室制肥皂时,将适量植物油、乙醇和NaOH溶液混合,并不断搅拌、加热,直到
混合物变稠,即可得到肥皂
B.用pH试纸测定某无色溶液的pH时,用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上,再跟标准比色卡比较
C.检验红砖中的氧化铁成分时,向红砖粉末中加入盐酸,放置至充分沉淀后,取上层清
液于试管中,滴加KSCN溶液2滴~3滴即可
D.制备硫酸亚铁晶体时,向稀硫酸中加入废铁屑至有少量气泡生成时,过滤,然后加热
蒸发滤液即可得硫酸亚铁晶体
E.在收集氨气的试管口塞一团蘸有稀硫酸的棉花,防止污染空气
Ⅱ.“化学多米诺实验”即利用反应中产生的压力和虹吸作用原理,使若干化学实验依次发生,整个过程只需要控制第一个反应,就好像多米诺骨牌游戏一样。下图就是一个“化学多米诺实验”。
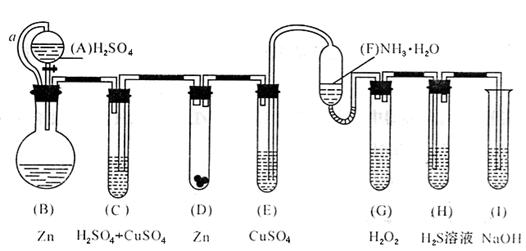
已知:Cu2++4NH3·H2O=[Cu(NH3)4]2++4H2O(该反应产物可作为H2O2分解的催化剂。)
请回答下列问题:
(1)进行实验前必须进行的操作是 ;
(2)B与D两容器中反应速率比较:B D(填“>”、“<”或“=”),原因是 ;
(3)H中的现象是 ;
(4)I的作用是(用离子方程式表示) ;
(5)A和B之间导管a的作用是 ;
(6)在该实验中不涉及的反应类型是(填编号) 。
①分解反应 ②化合反应 ③置换反应 ④复分解反应
28.(6分)为了确定某水合含+2价铁离子盐的化学式,某同学进行了下列实验:
(1)将0.784g该盐加强热至质量恒定,得到0.160gFe2O3
(2)将0.784g该盐溶于水,加入过量的BaCl2溶液,得到0.932gBaSO4
(3)将0.392g该盐溶于水,加入过量的NaOH溶液后煮沸,释放出的氨气用50.0mL
0.10mol·L-1盐酸吸收后,多余的盐酸用30.0mL 0.10mol·L-1NaOH溶液恰好中和。
根据以上事实,求该盐的化学式。
参考答案
Ⅰ卷
化学:5.A 6.C 7.C 8.D 9.A 10.D 11.D 12.B
Ⅱ卷
25.本题包括两小题(共22分)
І. (6分)⑴该气体的结构简式为:CH2=CHCH3 名称为:丙烯、(2分)
(2)CH2=CHCH3+Br2→CH2Br-CHBrCH3 (2分)
2CH2=CHCH3+9O2→6CO2+6H2O (2分)
Ⅱ.(16分)
(1)—CHO、—Br(2分)
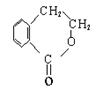
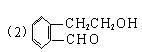
(2分) (2分)
(3)F(1分)
(4)消去反应(1分)
![]() (2分)
(2分)
(6) (2分)
 |
26.本题包括两小题(共14分)
І. (1) 8 NH3 + 6 NO2 = 7N2 + 12 H2O
(2)氧化产物与还原产物的质量比为 4:3 。
Ⅱ.(共10分)
(1)(NH4)2SO3(1分)BaSO4(1分)
(2)![]() (2分)
(2分)![]() (2分)
(2分)
(3)Ba2++ SO42—= BaSO4↓(2分) SO32—+Cl2+H2O = SO42—+2H++2Cl— (2分)
27.本题包括两小题(共18分)
І. BCE(6分) 。
Ⅱ.(前两个空每空1分,后每个2分,共12分)
(1)检查装置的气密性
(2)< D中Zn与CuSO4发生反应覆盖在Zn表面形成原电池,从而使反应速率加快
(3)有气泡并有乳白色(浅黄色)浑浊
(4)H2S+2OH-=S2-+2H2O
(5)平衡烧瓶(B)和漏斗(A)的气压,使液体易于流下
(6)②
28.(6分)解:![]()
![]()
![]()
![]()
=![]()
![]()
故该盐的化学式为:(NH4)2Fe(SO4)2·6H2O