高三第一次模拟考试化学试卷
可能用到的相对原子质量: H-1 O-16 C-12 Na-23 Fe-56
选择题
8、下列说法正确的是
A 质量相等密度不等的N2和C2H4两种气体的分子数一定相等
B 碱金属离子的盐水溶液一定不显酸性
C原子的最外层电子数大于4,此元素一定是非金属元素
D 分子式为C8H6O2的芳香族化合物,它的分子(除苯环外不含其他环)中不可能有一个羟基)
9、下列各组离子一定能在指定环境中大量共存的是
A 在c(HCO3—) = 0.1mol/L 的溶液中:NH4+ Al3+ Cl— NO3—
B 在由水电离出的c(H+) = 1×10—12mol/L的溶液中:Fe 3+ ClO— Na + SO42—
C 在PH=1的溶液中:NO3— SO42- Na+ Fe 2+
D 在既能溶解Al(OH)3 ,又能溶解H2SiO3的溶液中:Na + SO42- Cl— ClO—
10、Na2CO3·10H2O与NaHCO3混合物ng溶于水制成200mL溶液中c(Na+) = 0.5mol/L,若
将n克该混合物加热到质量不变时,失去的质量可能为
A 11 g B 9 g C 5.3 g D 3.1g
11、表示下列变化的化学用语正确的是
A NaHS的水解:HS— + H2O = H3O+ + S2-
B CO与H2混合气体ag充分燃烧后,通过足量Na2O2 ,Na2O2固体增重ag
C 0.5mol的浓硫酸与1mol NaOH反应放出57.3KJ的热量
D 向VmLpH = a的盐酸中滴加10VmLpH = b的NaOH溶液,此时混合液中c(Cl—)
=c(Na+),则(a+b)为15
12、 下图是某空间站,能量转化系统的局部示意图, 其中燃料电池采用KOH为电解液,下列有关说法中不正确的是
向日面时 背日面时

A 该能量转化系统中的水可以循环使用
B 燃料电池系统产生的能量实际上来自于水
C 水电解系统中的阳极反应:4OH— — 4e—= 2H2O + O2
D 燃料电池放电时的负极反应 : H2 – 2 e— + 2OH—= 2H2O
13、05年11月13日吉林市“双苯厂”发生爆炸,导致松花江受到硝基苯等 苯系物污染,有关部门采取了一系列措施进行治理,以下拟采取的措施错误的是
A、从上游水库加大放水量降低被污染江水的污染物浓度。
B、把江水先通过活性炭吸附有毒物质后再送入自来水厂去生产合格的自来水。
![]()
![]() C、污染物
具有氧化性,向江水中投入适量还原剂,使其被还原成
C、污染物
具有氧化性,向江水中投入适量还原剂,使其被还原成
D、在一定时间内,禁止食用松花江中鱼类水产品。
14、 一定条件下,向一带有活塞的密闭容器中充入1molA和3molB,发生如下反应:
A(g)+3B(g)![]() 2C(g); △H< 0,反应达平衡后,改变下述条件,C的平衡浓
2C(g); △H< 0,反应达平衡后,改变下述条件,C的平衡浓
度一定变大的是
A 保持温度和压强不变,充入1molA
B 保持温度和压强不变,充入2molC
C 保持温度和压强不变,充入2molHe
D 保持温度和容积不变,充入 3molB
26、(18分) A、B、C、D四种短周期元素的原子序数依次增大。A、D同族,B、C同周期,A与B组成的化合物甲为气态,其中A、B原子个数比为4:1。由A与C组成的两种化合物乙与丙均为液态,乙中A、C原子个数比为1:1,丙中为2:1。由D与C组成的两种化合物丁和戊都为固态,丁中D、C原子数之比为1:1,戊中为2:1。
(1)下列分子的电子式为:
甲 _______________ 乙_______________ 戊________________
(2)写出B元素最高价氧化物与丁发生反应的化学方程式:
_______________________________ _____。
(3)由A、B、C、D四种元素形成的化合物中,有一些化合物的水溶液呈碱性。从已学过的化合物中试写出两种,并用离子方程式表示其呈碱性的原因。
1___________,____________________________________________________________。
2___________,__________________________________________________________。
(4)将足量丙与戊混合后,进行电解,其阳极反应的电极反应式为___________ ,阴极反应的电极反应式__________ _________________。
27、(17分) 我国第二代身份证采用的是具有绿色环保性能的PETG新材料,PETG新材料可以回收再利用,而且对周边环境不构成任何污染。PETG的结构简式为:
![]()
![]()
![]()
![]()
![]() H
H![]() OCH2CH2O-C- —C
OCH2CH2O-C- —C![]() m
m![]() OCH2- -CH2-O-C- -C
OCH2- -CH2-O-C- -C![]() n
n
‖ ‖ ‖ ‖
O O O O
EG TPA CHDM TPA
|
![]() (2) RCOOR1 + R2OH
RCOOR2+R1OH (R、R1、R2表示烃基)
(2) RCOOR1 + R2OH
RCOOR2+R1OH (R、R1、R2表示烃基)
这种材料可采用下列合成路线:
![]()
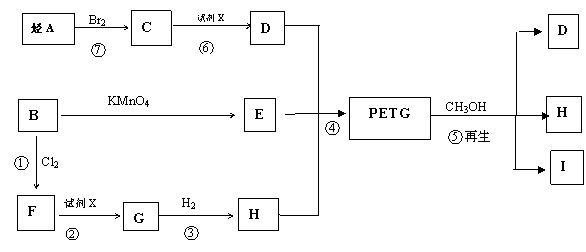

试回答下列问题:
(1)反应 ② ⑥加入的试剂X是_____________________________。
(2)⑤的反应类型是______________________________________________。
(3)写出结构简式:B____________________,I______________________.
(4)合成时应控制单体的物质的量之比为:
n(D):n(E):n(H)= ________:_________:__________(用m、n表示)
(5)写出化学方程式:
反应③___________________________________________________
反应⑥___________________________________________________
28、(15分)实验室用燃烧法测定某氨基酸CxHyOzNp的分子组成。取mg该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2 。实验装置如下图:

请回答下列有关问题:
(1) 实验开始时,首先要通入一段时间的氧气,其理由是:
______________________________________________________________。
(2) 以上装置中需要加热的仪器有 ________________(填字母,下同),操作时应先点燃_____________处的酒精灯。
(3) A装置中发生反应的化学方程式是:__________________________________________。
(4) 装置D的作用是:_______________________________________________。
(5)读取N2体积时,应注意:① ________________ _;②_____________________________。
(6)实验中测得N2的体积VmL(已折算为标准状况),为确定此氨基酸的分子式,还需要的有关
数据有_____________________ (用字母填空)。
A 生成二氧化碳气体的质量 B 氨基酸的相对分子质量
C 通入氧气的体积 D 生成水的质量
29、(16分) 将固体FeC2O4·2H2O放在一个可称量的容器中加热灼烧,固体质量随温度升高而变化,测得
数据如下:
| 温度/℃ | 25 | 300 | 350 | 400 | 500 | 600 | 900 |
| 固体质量/g | 1.000 | 0.800 | 0.800 | 0.400 | 0.444 | 0.444 | 0.429 |
根据计算分析推断并完成下列填空:
(1)写出25℃—300℃时固体发生变化的化学方程式 ________________________ _,
判断理由是:_____________________________________________________________。
(2)350℃ — 400℃时发生变化得到的产物是 ____________,物质的量之比为 __ _______。
(3)500℃时固体产物含氧的质量分数为:_________________________ 。
(4)写出600℃—900℃时发生变化的化学方程式:
_______________________ _______。
参考答案
一、 选择题
8A 9 D 10 C 11 B 12 B 13C 14 D
二、26、(18分)
(1)(每空2分、共6分)
|


(2)2CO2+2Na2O2===2Na2CO3+O2 (2分)
(3)NaHCO3 HCO3—+H2O![]() H2CO3+OH—(3分)
H2CO3+OH—(3分)
CH3COONa CH3COO—+H2O![]() CH3COOH+OH—(3分)
CH3COOH+OH—(3分)
(4) 4OH—-4e—=== 2H2O + O2↑ (2分) 、 4H++4e—===2H2↑(2分)
27、(17分) (1 )NaOH溶液 (2分) (2)取代(2分)
![]()
![]() (3)CH3- -CH3 (2分)、 H3COOC- -COOCH3(2分)
(3)CH3- -CH3 (2分)、 H3COOC- -COOCH3(2分)
(4) m: (m+n):n (3分)
![]()
![]() (5) 3 HOCH2─ ─CH2OH + 3H2
(5) 3 HOCH2─ ─CH2OH + 3H2 ![]() HOCH2─ ─CH2OH (3分)
HOCH2─ ─CH2OH (3分)
![]() ⑥ CH2Br-CH2Br + 2H2O
HOCH2-CH2OH + 2HBr(3分)
⑥ CH2Br-CH2Br + 2H2O
HOCH2-CH2OH + 2HBr(3分)
28、(15分)(1)避免残留在装置中的空气(主要是氮气)对实验结果产生影响(2分)
(2)A、D(2分) ; D(1分)
![]() (3) 4CxHyOzNp +
(4x+y-2z)O2 4xCO2
+ 2yH2O + 2pN2 (3分)
(3) 4CxHyOzNp +
(4x+y-2z)O2 4xCO2
+ 2yH2O + 2pN2 (3分)
(4)除去未反应的O2(2分)
(5)量筒内液面与集气瓶内液面相平;读数时,视线平视凹液面最低点。(2分)
(6)A、B、D(3分)
29、(16分)(1)FeC2O4·2H2O=== FeC2O4+2H2O(3分)
通过计算加热1.000g FeC2O4·2H2O失去全部结晶水的质量恰好0.800g(2分)
(2)FeO CO CO2 (3分); 1:1:1(2分)
(3)30%(3分)
![]() (4)6Fe2O3 4Fe3O4+O2↑(3分)
(4)6Fe2O3 4Fe3O4+O2↑(3分)