高三第一次月考化学试卷3
(时量:90分钟 满分:100分)
一、选择题(每题仅有一个正确答案,每小题3分,共54分)
1.下列叙述正确的是:( )
A.氧化剂在反应中失去电子 B.还原剂在反应中发生还原反应
C.氧化反应和还原反应不一定是同时发生的
D.有单质生成的分解反应一定是氧化还原反应
2.下列说法中不正确的是:( )
A.人类历史上使用最早的合金是青铜,目前世界上使用量最大的合金是钢
B.从金属矿石中提炼金属一般步骤依次是:矿石的富集、精炼、冶炼
C.硫酸的消费量常被视为一个国家工业发达水平的一种标志
D.能源、信息、材料通常被称为新科技革命的三大支柱
3.在我国许多地区已发生过误食亚硝酸中毒事件。人体正常的血红蛋白中含有Fe2+,若误食亚硝酸盐则导致血红蛋白中的Fe2+转化为高价铁(Fe3+)血红蛋白而中毒。服用维生素C(Vc)可解除亚硝酸盐中毒。以下说法正确的是:( )
A.Vc将Fe3+还原为Fe2+ B.Vc解毒未发生氧化还原反应
C.亚硝酸盐是还原剂 D.Vc是氧化剂
4.早期食盐加碘在食盐中加入的化合物是碘化钾,但在使用过程中发现食盐不久会泛黄,口感变苦。有人做了这样的小实验:将泛黄的食盐放到稀饭中,稀饭变成浅蓝色。则可推断,空气中使KI变质的物质可能是:( )
A.H2O B.CO2 C.O2 D.N2
5.黑火药的爆炸反应中:S+2KNO3+3C ==== K2S+N2↑+3CO2↑被还原的元素是:
A.只有N B.只有S C.只有C D.N和S
6.对电解质的叙述正确的是:( )
A.能导电的物质(如Cu) B.在水溶液中导电性很强的物质(如HCl)
C.在溶液中能生成离子的化合物(如NH3)
D.在水溶液里或熔融状态下能导电的化合物(如NaCl)
7.下列反应属于氧化还原反应,但水既不作氧化剂也不作还原剂的是 ( )
|
C.3Fe+4H2O(g) ==== Fe3O4+4H2 D.2Na+2H2O ==== 2NaOH+H2↑
8.下列各组离子在溶液中可以大量共存,加入过量盐酸后产生沉淀的是:( )
A.Na+、Cl-、NO3-、SiO32- B.K+、Ag+、NO3-、OH-
C.H+、Fe2+、Cl-、NO3- D. K+、Ba2+、Cl-、SO42-
9.下列各组中两种溶液间的反应,均可用同一离子方程式表示的是( )
A.CH3COOH和Na2CO3与CH3COOH和NaHCO3
B.AgNO3和HCl与AgNO3和NaCl
C.BaCl2和Na2SO4 与Ba(OH)2和H2SO4
D.KOH和AlCl3与氨水和AlBr3
10.在某溶液中有K+、H+、SO42-、NO3-,则溶液中溶质的种类最多为( )
A.2种 B.3种 C.4种 D.5种
11.用石墨作电极,电解1 mol/L下列物质的溶液,溶液的pH保持不变的是( )
A.CuCl2 B.NaOH C.Na2SO4 D. NaCl
12.根据以下四个反应:
(1)H2S+I2=2H++2I-+S↓ (2)H2SO3+2H2S=3S↓+3H2O
(3)2I-+Br2=2Br-+I2 (4)H2SO3+I2+H2O=H2SO4+2HI
确定Br-、I-、H2S和H2SO3还原性由强到弱的顺序是:( )
A.H2S>H2SO3>I->Br- B.Br->I->H2SO3>H2S
C.H2SO3>H2S>Br->I- D.I->Br->H2S>H2SO3
13.下列离子方程式中书写正确的是:( )
A.氢氧化钠溶液中加入少量氯化铝溶液:Al3++3OH-==== Al(OH)3↓
B.氢氧化钠溶液中通入少量硫化氢气体:H2S+OH-==== HS-+H2O
C.小苏打溶液和醋酸混合:HCO3-+CH3COOH ==== CH3COO-+CO2↑+H2O
D.硫酸亚铁溶液与过氧化氢溶液混合:Fe2++2H2O2+4H+ ==== Fe3++4H2O
14.从沸腾炉中出来的炉气中含有能使催化剂中毒的物质是 ( )
A.SO2 B.N2 C.砷、硒化物 D.水蒸气
15.某温度下将Cl2通入KOH溶液里,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO3-的物质的量浓度之比为11:1,则Cl2与KOH反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为:( )
A.1∶3 B.4∶3 C.2∶1 D.3∶4
16.在4Zn+10HNO3 ==== 4Zn(NO3)2+N2O↑+5H2O反应中,被还原的HNO3与未被还原的HNO3的质量比为:( )
A.2∶5 B.5∶1 C.4∶1 D.1∶4
17.在下列四种溶液中,加入括号里的各种离子,各离子能在原溶液中大量共存的是:
A.滴加石蕊试液显红色的溶液 (Fe3+、NH4+、Cl-、SCN-)
B.pH值为1的溶液 (Cu2+、Na+、Mg2+、NO3-)
C.水电离出来的c(H+)=10-13mol/L的溶液 (K+、HCO3-、Br-、Ba2+)
D.所含溶质为Na2SO4的溶液 (K+、CO32-、NO3-、Al3+)
18.同温同压下,在体积一定的密闭容器中,适量的NH3和Cl2恰好完全反应。若反应产物只有N2和NH4Cl,则反应前后容器中压强比应接近:( )
A.1∶11 B.11∶7 C.7∶11 D. 11∶1
二、填空题 (共20分)
19.(9分)(1)在下面的化学方程式中,标出电子转移方向和数目,并指出氧化剂和还原剂,氧化产物和还原产物:
3Cu+8HNO3 ==== 3Cu(NO3)2+2NO↑+4H2O
氧化剂 还原剂 氧化产物 还原产物
(2)配平方程式:
____ HNO3+____ H2S —— ____ NO2↑+_____ H2SO4+____ H2O
20.(6分) 接触法制硫酸的主要设备是:____________、______________、____________。
在______进行的反应中硫元素的化合价没有变化。硫酸工业尾气中造成大气污染的是________,大气中该气体带来主要危害是_____________。
21.(5分) ⑴ 已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
① CuSO4+Na2CO3: 主要:Cu2++2OH- ==== Cu(OH)2↓
次要:Cu2++CO32- ==== CuCO3↓
② CuSO4+Na2S: 主要:Cu2++S2― ==== CuS↓
次要:Cu2++OH― ==== Cu(OH)2↓
则Cu(OH)2、CuS、CuCO3的溶解度由大到小顺序是_____________________
⑵ 在反应:11P+15CuSO4+24H2O ==== 5Cu3P+6H3PO4+15H2SO4 中5mol CuSO4可氧化P的物质的量为__________mol。
三、推断题 (共12分)
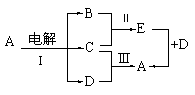 22.如图所示,E为黑色物质,B为空气的主要成分之一,C是红色金属,反应Ⅲ是C在D的稀溶液中进行,则:
22.如图所示,E为黑色物质,B为空气的主要成分之一,C是红色金属,反应Ⅲ是C在D的稀溶液中进行,则:
⑴ A是_______________,C是________________,
D是_________________;
⑵ 写出反应Ⅰ的离子方程式:
_________________________________________________________
⑶ 在上图中,有两种方法可以制取A,由反应Ⅲ制取A记为方法①,由E+D反应制取A记为方法②。你认为其中__________法更好,理由是:______________________。
四、计算题 (共14分)
23.用含杂质30%的硫铁矿2.0 t来生产硫酸。已知煅烧时有1.5%的硫受损失而混入炉渣,SO2接触氧化的转化率为95%,计算可生成98%的硫酸多少吨?(杂质不含硫元素。)
24
|
MnO2+4HCl ===== MnCl2+Cl2↑+2H2O 计算:
(1)反应生成的氯气在标况下的体积。
(2)参加反应的HCl中被氧化的HCl的质量。

| 20.(6分) ___沸腾炉___、 接触室 、 吸收塔 。 吸收塔 。_ 二氧化硫(SO2) ,_酸雨 。 |
高三第一次月考化学试卷答题卡
| 注意事项: 1.考生在答题前须将自己的班级、姓名等信息填写在密封线外指定的空格内 2.考生必须在规定区域做答,在草稿纸、试题卷上做答一律计0分,答题时答错答题框、超出答题框的答案也计0分。 |
可能用到的相对原子质量:
H-1 O-16 S-32 Mn-55 Fe-56
一、选择题(请将选择题的正确答案填写在相应的空格内)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | D | B | A | C | D | D | B | A | B |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | D | C | A | C | C | B | D | B | D |
二、填空题(共20分)
|
⑴ 3Cu+8HNO3 ==== 3Cu(NO3)2+2↑+4H2O 氧化剂 HNO3 还原剂 Cu 氧化产物 Cu(NO3)2 还原产物 NO ⑵ 配平:
|
| 21.(5分) ⑴ ___CuCO3 > Cu(OH)2 > CuS (2分) ⑵ __1___ (3分) |
三、推断题 (共12分)
| 22.(12分)
⑵ 2Cu2+ + 2H2O 2Cu + 4H+ + O2↑ ⑶ ___②___,__制备等量德硝酸铜消耗的硝酸的量较少,且不产生污染空气的 氮的氧化物 。 |
四、计算题 (共14分)
| 23.(7分) 2.2吨
24.(7分) ⑴ 6.72 L ⑵ 21.9 g |