高考化学第一轮单元测试题(5)
第五单元 元素周期律、元素周期表
本试卷分第Ⅰ卷和第Ⅱ卷两部分共100分,考试时间100分钟,可能用到的相对原子
质量:H:1 C:12 N:14 O:16 Na:23
第Ⅰ卷(选择题,共49分)
一、选择题(本题包括5小题,每小题2分,共10分,每小题只有一个选项符合题意。)
1、某元素的两种同位素,它们的原子具有不同的 ( )
A. 质子数 B. 质量数 C. 原子序数 D. 电子数
2、下列数字为几种元素的核电荷数,其中原子核外最外层电子数最多的是 ( )
A. 9 B. 14 C. 20 D. 34
3、在原子序数为3~10的元素中,随着核电荷数递增而逐渐增加的是 ( )
A. 原子半径 B. 最外层电子数 C. 最高价 D. 核外电子层数
4、元素的化学性质主要决定于 ( )
A. 原子半径 B. 原子核外电子结构 C. 元素化合价 D. 元素的相对原子质量
5、有人认为在元素周期表中,位于A族的氢元素,也可以放在族,下列物质能支持这种观点的是 ( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
二、选择题(本题包括8小题,每小题3分,共24分,每小题有一个或两个选项符合题意。)
6、有![]() 和
和![]() 两种离子,它们的电子层结构相同,下列关系或化学式正确的是( )
两种离子,它们的电子层结构相同,下列关系或化学式正确的是( )
A. ![]() B. 氢化物
B. 氢化物![]() 或
或![]() C.
C. ![]() D. 氧化物
D. 氧化物![]()
7、科学家最近发现出第112号新元素,其原子的质量数为277,这是迄今已知元素中最重的原子,关于该新元素的下列叙述正确的是 ( )
A. 其原子核内中子数和质子数都是112
B. 其原子核内中子数为165,核外电子数为112
C. 其原子质量是12C原子质量的277倍
D. 其原子质量与12C原子质量之比为277:12
8、X、Y是元素周期表中ⅦA族中的两种元素。下列叙述中能说明X的非金属性比Y强的是 ( )
A. X原子的电子层数比Y原子的电子层数多
B.X的氢化物的沸点比Y的氢化物的沸点低
C.X的气态氢化物比Y的氢化物稳定
D.Y的单质能将X从![]() 的溶液中置换出来
的溶液中置换出来
9、下列各表分别是元素周期表的一部分,表中的数字表示元素的原子序数,各表中数字所表示的元素在周期表中的位置与周期表的结构不相符的是 ( )
![]()
| 6 | ||||
|
| 15 | 16 | ||
| 32 | ||||
| 1 |
| 2 | ||
| 11 |
| |||
| 19 | ||||
| 9 | ||
| 16 | 18 | |
|
| 35 |
| 1 | ||
|
| 4 | 5 |
| 13 |
|
|
|
|
10、氯只有![]() 和
和![]() 两种稳定同位素,在氯气中
两种稳定同位素,在氯气中![]() 和
和![]() 的原子数之比为3:1,则相对分子质量为70:72:74,氯气分子数之比可能是
( )
的原子数之比为3:1,则相对分子质量为70:72:74,氯气分子数之比可能是
( )
A. 5:2:1 B. 5:2:2 C. 9:3:1 D. 9:3:2
11、已知短周期元素的离子![]() 都具有相同的电子层结构,则下列叙述正确的是( )
都具有相同的电子层结构,则下列叙述正确的是( )
A.原子半径![]() B.原子序数
B.原子序数![]()
C.离子半径![]() D.单质的还原性
D.单质的还原性![]()
12、下列说法中错误的是 ( )
A.原子及其离子的核外电子层数等于该元素所在的周期数
B.元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
C.除氦外的稀有气体原子的最外层电子数都是8
D.同一元素的各种同位素的物理性质、化学性质均相同。
13、下图是周期表中短周期的一部分,A、B、C三种元素原子核外电子数之和等于B的质量数。B原子核内质子数和中子数相等。下列叙述中不正确的是 ( )
 A.三种元素的原子半径的大小顺序是
A.三种元素的原子半径的大小顺序是![]()
B.A元素最高价氧化物的对应水化物具有强氧化性和不稳定性
C.B元素的氧化物和氢化物的水溶液都呈酸性
D.C元素的单质是非金属单质中惟一能跟水激烈反应的单质
三、选择题(本题包括5小题,每小题3分,共15分。每小题只有一个选项符合题意。)
14、根据中学化学教材所附元素周期表判断,下列叙述不正确的是 ( )
A.K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等
B.L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等
C.L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等
D.M层电子为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等
15、A、B为短周期元素,两者能形成型离子化合物,A离子比B离子少一个电子层,已知B的原子序数为x,则A的原子序数为 ( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
16、两种短周期元素形成的化合物中,原子个数比为1:2或2:1,若两种元素的原子序数分别为p和q,则下列关系正确的是 ( )
①![]() ②
②![]() ③
③![]() ④
④![]()
A.①④ B.①③④ C.①②③④ D.①②④
17、A、B、C、D均为短周期的4种元素,当A、B两种元素的两个原子分别得到两个电子形成稳定结构时A放出的能量大于B放出的能量,当C、D两元素的原子分别失去1个电子形成稳定结构时D吸收的能量大于C吸收的能量。若A、B、C、D4种元素间分别形成化合物时属于离子化合物可能性最大的是 ( )
A.C2A B.C2B C.D2A D.D2B
18、一些科学家预言,存在稳定的超重元素,如N=184的原子,它位于元素周期表第七周期,第ⅠNA族,由此,下列说法正确的是 ( )
A.第七周期有50种元素 B.该原子的质子数是184
C.该元素的相对原子质量是298 D.该原子核外有114个电子
第Ⅱ卷(非选择题,共51分)
 四、(本题包括2小题,共12分)
四、(本题包括2小题,共12分)
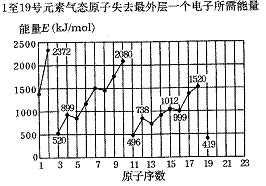
19、(6分)不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如下图所示。试根据元素在周期表中的位置,分析图中曲线的变化特点,并回答下列问题。
(1)同主族内不同元素的E值变化的特点是: ;各主族中E值的这种变化特点体现了元素性质的 变化规律。
(2)同周期内,随原子序数增大,E值增大。但个别元素的E值出现反常现象。试预测下列关系中正确的是 (填写编号)。
①E(砷)>E(硒) ②E(砷)<E(硒) ③E(溴)>E(硒) ④E(溴)<E(硒)
(3)估计1![]() 气态
气态![]() 原子失去最外层一个电子所需能量E值的范围:
原子失去最外层一个电子所需能量E值的范围:
![]() 。
。
(4)10号元素E值较大的原因是 。
20、(6分)假定元素同期表是有限的,根据已知的元素周期表的某些事实和理论可归纳出一些假说。
(1)根据每个周期最后一种金属元素出现的族序数,预测周期表中原子序数最大的金属元素将在 周期 族(注意:把零族看作ⅦA族);周期表在填满 周期后将结束。
(2)根据周期表中每个周期非金属元素的种数(把稀有气体看作非金属)预测周期表中应该有 种非金属元素,还有 种未发现,未发现的非金属处在 周期 族。
五、(本题包括2小题,共12分)
21、(6分)下表是元素周期表的一部分:
|
| I A | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ⑤ | ⑥ | ||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ | |||
(1)表中元素⑩的氢化物的化学式为 ,此氢化物的还原性比元素⑨的氢化物的还原性 (填“强”或“弱”)。
(2)某元素的核外K层电子数比L层电子数少3,则该元素的元素符号是 ,其单质的电子式为 。
(3)俗称为“矾”的一类化合物通常含有的共同元素是 。
(4)已知某些不同族元素的性质也有一定的相似性,如元素③与⑧的氢氧化物有相似的性质。写出元素③的氢氧化物与![]() 溶液反应的化学方程式
。
溶液反应的化学方程式
。
又如表中与元素⑦的性质相似的不同族的元素是 (填元素符号)。
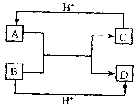 22、(6分)已知A、B、C、D四种不同粒子。他们之间存在如下关系:
22、(6分)已知A、B、C、D四种不同粒子。他们之间存在如下关系:
(1)如果A、B、C、D均是10电子的粒子,则A的结构式为
;D的电子式为 。
(2)如果A为一种金属阳离子,且A、B、D均为10电子粒子,C为30电子粒子。试写出:
A与B在溶液中反应生成C和D的离子方程式 。
C与H+反应生成A的离子方程式 。
六、(本题包括2小题,共12分)
23、(8分)X、Y、Z为短周期元素的单质,U、V为它们的化合物,这些物质之间的关系如右图所示,其中反应条件和某些产物已经略去:
(1)如果X、Y的组成元素是同主族的,写出反应I的化学反应方程式:
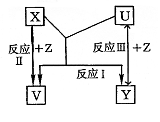 ①若已知V是水:
。
①若已知V是水:
。
②若已知U、V均为氧化物: 。
(2)如果X、Y的组成元素不同主族时,按下列要求回答问题。
①若X组成元素是地壳中含量最多的金属元素时,则X、Y、Z的化学式是:X为 ;Y为 ;Z为 。
②若Y组成元素在自然界中形成的化合物种类最多时,则V、U的化学式是:V为 ;U为 。
③若Z是通常情况下密度最小的物质,则反应I的化学反应方程式: 。
24、(4分)设X、Y、Z代表三种元素。已知:
①![]() 和
和![]() 两种离子具有相同的电子层结构;
两种离子具有相同的电子层结构;
②Z元素原子核内质子数比Y元素原子核内质子数少9个;
③Y和Z两种元素可以形成4核42个电子的负一价阴离子。
据此,请填空:
(1)Y元素是 ,Z元素是 。
(2)由X、Y、Z三种元素所形成的含68个电子的盐类化合物的化学式是 。
七、(本题包括2小题,共15分)
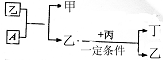 25、(6分) 有A、B、C、D四种单质,在一定条件下,B可以和A、C、D化合生成甲、乙、丙,C和D化合生成化合物丁,丁遇空气变成红棕色气体。已知甲,乙,丙的每个分子中都含有10个电子,并且甲,乙,丙,丁有如下列框图所示的转化关系,请填写下列空白:
25、(6分) 有A、B、C、D四种单质,在一定条件下,B可以和A、C、D化合生成甲、乙、丙,C和D化合生成化合物丁,丁遇空气变成红棕色气体。已知甲,乙,丙的每个分子中都含有10个电子,并且甲,乙,丙,丁有如下列框图所示的转化关系,请填写下列空白:
(1)单质B的化学式 。
(2)单质A跟化合物乙反应的化学方程
式 。
(3)根据化合物丙、丁中D元素的化合价,判断丙和丁能否在一定条件下发生化学反应生成D单质。若认为能反应,写出反应的化学方程式,若认为不能反应,简要说明理由。
。
26、(9分) 已知X、Y、Z、W是元素周期表中短周期中的四种非金属元素,它们的原子序数依次增大,X元素的原子形成的阳离子就是一个质子;Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。
试回答:
(1)写出下列元素的元素符号X 、Y 、Z 、W 。
(2)X单质和Z单质在一定条件下反应生成化合物E,该反应的化学方程式为(请注明反应条件) 。E分子的空间构型为 ,电子式为 。E在催化剂存在的条件下可用于还原汽车尾气中的 ,以减少对大气的污染。
(3)仅由X、Z、W三种元素组成的某种盐是一种速效肥料,但长期施用会使土壤酸化,有关的离子反应方程式为 。
(4)这四种元素可组成原子个数比为5:1:l:3的化合物(按X、Y、Z、W的顺序),该化合物的水溶液与足量的NaOH溶液反应的离子方程式为 。
(5)将9 g单质Y在足量W单质中燃烧,所得气体通入1L 1![]() 1 NaOH溶液中,完全吸收后,溶液中的各离子浓度由大到小的顺序是
。
1 NaOH溶液中,完全吸收后,溶液中的各离子浓度由大到小的顺序是
。
参考答案
1.B 2.A 3.B 4.B 5.C 6.BC 7.BD 8.C 9.C 10.AD 11.C 12.AD 13.A 14.C 15.A 16.C 17.A 18.D
19.(1)随着原子序数的增大,E值变小;周期性
(2)① ③
(3)419;738[或填E(钾);E(镁)]
(4)10号元素是氖,该元素原子的最外层电子排布已达到8个电子稳定结构。
20.(1)第八;ⅧA;八 (2)23;1;第七;ⅦA
21.(1)![]() ;弱 (2)N; (3)
;弱 (2)N; (3)![]()
(4)![]() ;
;![]()
22.(1);![]() (2)
(2)![]()
23.(1)①![]() ②
②![]()
(2)①![]() ②
②![]() ③
③![]()
24.(1)氯(或![]() );氧(或O) (2)
);氧(或O) (2)![]()
25.(1)![]() (2)
(2)![]() (3)能;
(3)能;![]()
![]() 26.(1)
26.(1)![]()
(2)![]() ;三角锥形;
;三角锥形; ![]() ;
;![]()
(3)![]()
(4)![]()
(5)![]()