高考化学第一轮单元测试题(6)
第六单元 物质结构和晶体的类型
本试卷分第Ⅰ卷和第Ⅱ卷共100分,考试时间100分钟,可能用到的相对原子质量:
H:1 C:12 O:16 Fe:56
第Ⅰ卷(选择题,共49分)
一、选择题(本题包括5小题,每小题2分,共10分。每小题只有一个选项符合题意。)
1. 下列含有极性键的离子晶体是 ( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D.
![]()
2. 下列叙述正确的是 ( )
A.离子化合物中可能含有共价键 B.构成分子晶体的微粒一定含有共价键
C.共价化合物中可能含有离子键 D.非极性分子一定含有非极性键
3. 下列对金属通性描述不正确的是 ( )
A.具有金属光泽 B.易导电导热 C.具有高熔点高硬度 D.常温下均为固态
4. 下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是 ( )
A. ![]() 和
和![]() B.
B. ![]() 和
和![]() C.
C. ![]() 和
和![]() D.
D. ![]() 和
和![]()
5. 下列各分子中,所有原子都满足最外层为8电子结构的是 ( )
A. ![]() B.
B.
![]() C.
C.
![]() D.
D.
![]()
二、选择题(本题包括8小题,每小题3分,共24分。每小题有一个或两个选项符合题意。)
6. 关于晶体的下列说法正确的是 ( )
A. 在晶体中只要有阴离子就一定有阳离子
B.在晶体中只要有阳离子就一定有阴离子
C.原子晶体的熔点一定比金属晶体的熔点高
D.分子晶体的熔点一定比金属晶体的低
7. 下列各指定微粒的数目之比不是1:1的是 ( )
A. ![]() 晶体中的阴离子与阳离子 B.
晶体中的阴离子与阳离子 B. ![]() 晶体中的钠离子与碳酸氢根离子
晶体中的钠离子与碳酸氢根离子
C. ![]() 离子中的质子和中子 D.
离子中的质子和中子 D. ![]() 溶液中的铵根离子和氯离子
溶液中的铵根离子和氯离子
8. 下列物质的熔沸点高低顺序正确的是 ( )
A. 金刚石>晶体硅>碳化硅
B. ![]()
C. ![]() D.金刚石>生铁>纯铁>钠
D.金刚石>生铁>纯铁>钠
9. 有关晶体的下列说法中,正确的是 ( )
A. 晶体中分子间作用力越大,分子越稳定
B. 原子晶体中共价键越强,熔点越高
C. 冰熔化时水分子中共价键发生断裂
D. 氯化钠熔化时离子键末被破坏
10. 水的状态除了气、液和固态外,还有玻璃态。它是由液态水急速冷却到165K时形成的,玻璃态的水无固定形态,不存在晶体结构,且密度与普通液态水的密度相同,有关玻璃态水的叙述正确的是 ( )
A. 水由液态变为玻璃态,体积缩小 B.水由液态变为玻璃态,体积膨胀
C.玻璃态是水的一种特殊状态 D.玻璃态水是一种特殊的分子晶体
11. 下列叙述正确的是 ( )
A.![]() 和
和![]() 都是共价化合物,
都是共价化合物,![]() 都是离子化合物
都是离子化合物
B. ![]() 和
和![]() 都是以极性键结合的极性分子
都是以极性键结合的极性分子
C.在![]() 和
和![]() 晶体中,都不存在单个小分子
晶体中,都不存在单个小分子
D.甲烷和结构是对称的平面结构,所以是非极性分子
![]() 12. 下列电子式书写正确的是
( )
12. 下列电子式书写正确的是
( )
![]() A.
A. ![]() B.
B. ![]()
C. ![]() D.
D.
![]()
13. 下列变化过程中,无化学键断裂或生成的是 ( )
A.石墨转化为金刚石
B. ![]() 晶体溶于水
晶体溶于水
C.干冰升华
D. ![]() 溶于水
溶于水
三、选择题(本题包括5小题,每小题3分,共15分。每小题只有一个选项符合题意。)
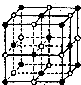 14. 最近科学家发现一种由钛原子和碳原子构成的气态团族分子,如图所示。顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,则它的化学式是
( )
14. 最近科学家发现一种由钛原子和碳原子构成的气态团族分子,如图所示。顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,则它的化学式是
( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
15. 下列事实与氢键有关的是 ( )
A.水加热到很高的温度都难以分解
B.水结成冰体程膨胀,密度变小
C. ![]() 熔点随相对分子质量增大而升高
熔点随相对分子质量增大而升高
D. ![]() 的热稳定性依次减弱
的热稳定性依次减弱
16. 氮化硅(![]() )是一种新型的耐高温耐磨材料,在工业上有广泛用途,它属于( )
)是一种新型的耐高温耐磨材料,在工业上有广泛用途,它属于( )
A.原子晶体 B.分子晶体 C.金属晶体 D.离子晶体
17. 金属晶体的下列性质与自由电子无关的是 ( )
A.导热性 B.密度 C.导电性 D.延展性
18.下列性质中,可以证明某化合物内一定存在离子键的是 ( )
A.晶体可溶于水 B.具有较高的熔点
C.水溶液能导电 D.溶融状态能导电
第Ⅱ卷(非选择题,共51分)
四、(本题包括2小题,共13分)
19.(8分)参考下表中物质的熔点,回答有关问题
| 物质 | NaF | NaCl | NaBr | NaI |
| 熔点/℃ | 995 | 802 | 755 | 651 |
| 物质 | NaCl | KCl | RbCl | CsCl |
| 熔点/℃ | 801 | 776 | 715 | 646 |
| 物质 | SiF4 | SiCl4 | SiBr4 | SiI4 |
| 熔点/℃ | -90.4 | -70.4 | 5.2 | 120 |
| 物质 | SiCl4 | GeCl4 | SbCl4 | PbCl4 |
| 熔点/℃ | -70.4 | -49.5 | -36.2 | -15 |
(1)钠的卤化物及碱金属的氯化物的熔点与阴离子及碱金属离子的 有关,随着 增大,熔点依次降低;
(2)硅的卤化物及硅、锗、锡、铅的氯化物熔点与 有关,随着 增大, 增大,熔点依次升高;
(3)钠的卤化物的熔点比相应的硅卤化物的熔点高得多,这与 有关,因为一般 比 熔点高。
20.(5分)已知有关物质的溶、沸点数据如下表:
| 物质 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 熔点/℃ | 2852 | 2072 | 714 | 190(215×105Pa) |
| 沸点/℃ | 3600 | 2980 | 1412 | 182.7 |
(1)工业上常用电解熔融MgCl2的方法生产金属镁,电解Al2O3,与冰晶石熔混合物的方法生产铝。为什么不用电解MgO的方法生产镁,也不用电解AlCl3的方法生产铝?
答:
。
(2)设计可靠的实验证明MgCl2、AlCl3所属的晶体类型,其实验方法是
。
五、(本题包括2小题,共13分)
21.(6分)A、B、C、D都是短周期元素,原子半径D>C>A>B。其中A、B处于同周期,A、C处于同主族。C原子核内的质子数等于A、B原子核内的质子数之和,C原子最外层电子数是D原子最外层电子数的4倍,试回答:
(1)这四种元素分别是:
A B
C D
(2)这四种元素单质的熔点由高到低的顺序是。 。
(3)C的固态氧化物是
晶体,含![]()
![]() C的氧化物的晶体中含C一O共价键为
C的氧化物的晶体中含C一O共价键为
![]() 。
。
(4)写出A、B、C组成化合物与B、C组成的化合物相互反应的化学方程式
。
22.(7分) 在![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中
中
(1)只含离子键的是
(2)只含极性键的是
(3)只含非极性键的是
(4)既含有离子键又含有非极性键的是
(5)同时含有离子键、共价键的和配位键的是
(6)只以极性键结合的极性分子是
(7)既含有极性键又含有非极性键的极性分子是
六、(本题包括2小题,共13分)
23.(5分)已知A元素最高正化合价为负化合价绝对值的3倍,相同状况下,A的气态氢化物与最高价氧化物气体的密度之比为1:2.35,A元素的原子核内质子数与中子数相等;两元素可形成离子化合物BA,![]() 和
和![]() 的核外电子数相等;B、C两元素位于同一周期,单质C的分子由两个原子共用一对电子组成。
的核外电子数相等;B、C两元素位于同一周期,单质C的分子由两个原子共用一对电子组成。
试回答:
(1)A、B、C的元素名称:A B C ;
(2)用电子式表示A、B结合成化合物的过程:
。
(3)用电子式表示C的氢化物的形成过程:
。
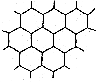
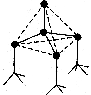 24.(8分)下图表示一些晶体中的某些结构,它们分别是
24.(8分)下图表示一些晶体中的某些结构,它们分别是![]() 、
、![]() 、干冰、金刚石、石墨结构中的某一部分。
、干冰、金刚石、石墨结构中的某一部分。
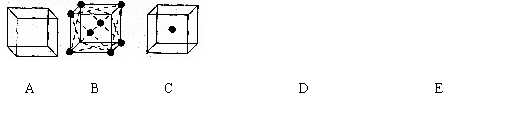 |
(1)其中代表金刚石的是(填编号字母,下同) ,其中每个碳原子与 个碳原子最近且距离相等。金刚石属于 晶体。
(2)其中代表石墨的是 ,其中每个正六边形占有的碳原子数平均为 个。
(3)其中表示![]() 的是
,每个
的是
,每个![]() 周围与它最近且距离相等的
周围与它最近且距离相等的![]() 有
有
个。
(4)代表![]() 的是 ,它属于 晶体,每个
的是 ,它属于 晶体,每个![]() 与
与 ![]() 紧邻。
紧邻。
(5)代表干冰的是 ,它属于 晶体,每个![]() 分子与个
分子与个 ![]() 分子紧邻。
分子紧邻。
(6)上述五种物质熔点由高到低的排列顺序为 。
七、(本题包括2小题,共12分)
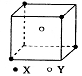 25.(6分)某离子晶体的一个基本单元结构如右图所示,X位于正方形顶点处,Y位于正方体中心。试回答下列问题:
25.(6分)某离子晶体的一个基本单元结构如右图所示,X位于正方形顶点处,Y位于正方体中心。试回答下列问题:
(1)在该晶体中每个Y同时吸引着 个X,每个X同时吸引 个Y,该离子化合物的化学式可能
是: 或 。
(2)在晶体中每个X周围与它最近且等距离的X共有 个,晶体距离最近的2个X与1个Y形成的夹角即![]() 度数为
。
度数为
。
(3)设该离子化合物摩尔质量为![]() 、密度为
、密度为![]() 、阿伏加德罗常数为
、阿伏加德罗常数为![]() ,则晶体中两个距离最近的X中心间距离为:
cm
,则晶体中两个距离最近的X中心间距离为:
cm
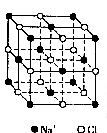 26.(6分)晶体具有规则的几何外形,晶体中最基本的重复单位称为晶胞。
26.(6分)晶体具有规则的几何外形,晶体中最基本的重复单位称为晶胞。![]() 的晶胞结构如图所示。
的晶胞结构如图所示。
已知![]() 晶体晶胞结构为
晶体晶胞结构为![]() 型,由于晶体缺陷,
型,由于晶体缺陷,![]() 值小于1。测知
值小于1。测知![]() 晶体密度
晶体密度![]() 为
为![]() ,晶胞边长为
,晶胞边长为![]() 。(铁原子相对原子质量为55.9,氧原子相对原子质量为16)。求:
。(铁原子相对原子质量为55.9,氧原子相对原子质量为16)。求:
(1) ![]() 中
中![]() 值(精确到0.01)为
。
值(精确到0.01)为
。
(2)晶体中的![]() 分别为
分别为![]() 。在
。在![]() 和
和![]() 的总数中,
的总数中,![]() 所占分数(用小数表示,精确到0.001)为
。
所占分数(用小数表示,精确到0.001)为
。
(3)此晶体的化学式: 。
(4)铁离子在此晶体中占据空隙的几何形状是
(即与![]() 距离最近且等距离的铁离子围成的空间形状)。
距离最近且等距离的铁离子围成的空间形状)。
(5)在晶体中,铁元素的离子间最短距离为 m。
参考答案
1.B 2.A 3.D 4.B 5.C 6.A 7.AD 8.BC 9.B 10.C 11.C 12.B 13.C 14.C 15.B 16.A 17.B 18.D
19. (1)半径;半径 (2)相对分子质量;相对分子质量;分子间作用力
(3)晶体类型;离子晶体;分子晶体
20.(1)因为![]() 的熔点远高于
的熔点远高于![]() ,故电解熔融
,故电解熔融![]() 将需要更高的温度,不便于操作。观察表中数据可见,
将需要更高的温度,不便于操作。观察表中数据可见,![]() 易升华,熔、沸点低,故属于分子晶体,不存在离子,不能被电解。
易升华,熔、沸点低,故属于分子晶体,不存在离子,不能被电解。
(2)将两种晶体加热到熔化状态,![]() 能导电,
能导电,![]() 不能导电,故确证
不能导电,故确证![]() 为离子晶体,
为离子晶体,![]() 为分子晶体。
为分子晶体。
21.(1)![]()
|
(3)原子;![]() (4)
(4)![]()
22.(1)![]() (2)
(2)![]() (3)
(3)![]() (4)
(4)![]()
(5)![]() (6)
(6)![]() (7)
(7)![]()
23.(1)硫;钙;溴 (2) (3)![]()
24.(1)D;4;原子 (2)E;2 (3)A;12 (4)C;离子;8 (5)B;分子;12
(6)石墨>金刚石>![]() >
>![]() >干冰
>干冰
25. (1) 4;8 (2)12;![]() (3)
(3)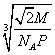
26.(1)0.92 (2) 0.826
(3) ![]() (4) 正八面体 (5)
(4) 正八面体 (5) ![]()