高考化学第一轮单元测试题(7)
第七单元 硫和硫的化合物 环境保护
本试卷分第Ⅰ卷和第Ⅱ卷两部分,共100分,考试时间100分钟,可能用到的相对原子质量:H: 1 O:16 C:12 Fe:56 S:32 Mg: 24 Cu: 64 Zn:65
第Ⅰ卷(选择题,共49分)
一、选择题(本题包括5小题,第小题2分,共10分。每小题只有一个选项符合题意)
1.下列物质不属于“城市空气质量日报”报道的是 ( )
A.二氧化硫 B.氮氧化物 C.二氧化碳 D.悬浮颗粒
2.酸雨形成的主要原因是 ( )
A.森林遭到乱砍滥伐,破坏了生态平衡 B.工业上大量燃烧含硫燃料
C.硫酸厂排出的大量气体 D.大气中![]() 的含量增多
的含量增多
3.强热绿矾晶体,除结晶水蒸发出去外,还发生如下化学反应:
![]()
如果将生成的气体通人浓![]() 溶液中,产生的现象是 ( )
溶液中,产生的现象是 ( )
A.生成![]() 和
和![]() 混合沉淀 B.生成
混合沉淀 B.生成![]() 沉淀,有
沉淀,有![]() 气体逸出
气体逸出
C.生成![]() 沉淀,有
沉淀,有![]() 气体逸出 D.有
气体逸出 D.有![]() 和
和![]() 两种气体同时逸出
两种气体同时逸出
4.下列五种有色溶液与作用,均能褪色,其实质相同的是 ( )
① 品红溶液 ②酸化![]() 溶液 ③溴水 ④滴有酚酞的
溶液 ③溴水 ④滴有酚酞的![]() 溶液 ⑤淀汾-碘溶液
溶液 ⑤淀汾-碘溶液
A.①④ B.①②③ C.②③ D.②③④
5.接触室里装一个热交换器,其主要目的是 ( )
A.冷却反应后的混合气体
B.给催化剂加热
C.把反应放出的热量传递给需要预热的反应混合气体
D.降低接触室的温度,以免温度过高烧坏设备
二、选择题(本题包括8小题,每小题3分,共24分。每小题有一个或两个选项符合题意。)
6.在常温常压下,将![]() L
L ![]() 和
和![]() L
L ![]() 混合,如果反应后气体体积是反应前的
混合,如果反应后气体体积是反应前的![]() ,则
,则![]() 与
与![]() 之比是 (
)
之比是 (
)
A.1:1 B.2:1 C.1:3 D.1:2
7.常温常压下,在四支容积均为![]() 的试管中,分别通入
的试管中,分别通入![]() 的如下两种气体,然后将其倒扣在水中,充分接触后,液面缓慢上升,到不再变化为止,液面上升高度最小的是 ( )
的如下两种气体,然后将其倒扣在水中,充分接触后,液面缓慢上升,到不再变化为止,液面上升高度最小的是 ( )
A.二氧化硫和氯气 B.二氧化硫和硫化氢
C.硫化氢和氯气 D.氯化氢和氢气
8.下列离子方程式书写正确的是 ( )
A.向明矾溶液中滴加![]() 溶液至
溶液至![]() 恰好完全沉淀:
恰好完全沉淀:
![]()
B.向明矾溶液中滴加![]() 溶液至
溶液至![]() 恰好完全沉淀
恰好完全沉淀
![]()
C.向![]() 溶液中通入
溶液中通入![]() 至
至![]() 恰好完全被氧化
恰好完全被氧化 ![]()
D.向![]() 溶液中通入
溶液中通入![]() 至
至![]() 恰好完全被氧化
恰好完全被氧化![]()
9.工业制取硫酸是一种连续的生产过程,今测知进入接触室时混合气体(![]() ,主要成分为
,主要成分为![]() )的流量为
)的流量为![]() ,从接触室导出气体(
,从接触室导出气体(![]() )的流量为
)的流量为![]() ,与此有关的以下说法中正确的是
( )
,与此有关的以下说法中正确的是
( )
A.单位时间内从接触室进入的气体与导出的气体的物质的量乏比为10:9
B.导出气体中![]() 所占的体积分数为
所占的体积分数为![]()
C.此反应中的转化率一定为20%
D.![]() 的催化氧化反应是吸热反应
的催化氧化反应是吸热反应
10.对下列事实的解释错误的是 ( )
A.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B.浓硫酸和浓盐酸混合可制氯化氢,说明浓硫酸是一种难挥发的酸
C.常温下,浓硫酸可以用铝罐储存,说明铝与浓硫酸不反应
D.反应![]() 能进行,说明硫化铜不溶于水,也不溶于稀硫酸
能进行,说明硫化铜不溶于水,也不溶于稀硫酸
11.将通入溶液至饱和,未见沉淀生成,继续通入另一种气体,仍无沉淀,则通入的气体可能是 ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
12.臭氧可使湿润的淀粉碘化钾试纸变蓝,化学方程式为
![]() (未配平),下列叙述正确的是
( )
(未配平),下列叙述正确的是
( )
A.在反应中![]() 被氧化成
被氧化成![]()
B.该反应的还原产物是![]()
C.每生成1![]()
![]() ,转移的电子为2
,转移的电子为2![]()
D.反应中氧化剂与还原剂物质的量之比为1:1
13.下列关于氧族元素的叙述不正确的是 ( )
A.随着原子序数递增,单质熔点升高
B.都能形成+4和+6价化合物
C.能跟大多数金属直接化合
D.都能跟氢气直接化合形成氢化物
三、选择题(本题包括5小题,每小题3分共15分。每小题只有一个选项符合题意。)
14.把29g铁和硫的混合物在密闭容器中加热反应后,冷却至室温再跟足量稀盐酸反应,产生气体在标准状况下为8.4L,则混合物中铁和硫的物质的量之比为 ( )
A.1:1 B.1:2 C.3:2 D.2:3
15.同体积的碘化钾、硫化钠、溴化亚铁的溶液中,分别通入足量氯气充分反应后,如果用去的氯气的质量相同,则碘化钾、硫化钠、溴化亚铁三种溶液的物质的量浓度之比应是 ( )
A.6:3:2 B.2:3:6 C.3:2:1 D.1:2:3
16.已知硫酸的质量分数越大时,其溶液的密度也越大,将![]() 与石
与石![]() 的两种硫酸溶液等体积混合后,溶液的质量分数 ( )
的两种硫酸溶液等体积混合后,溶液的质量分数 ( )
A.大于![]() B.小于
B.小于![]()
C.等于![]() D.无法确定
D.无法确定
17.工业上从含硒废料提炼硒的一种方法是用硝酸钠与硫酸处理废料,得到亚硒酸和少量硒酸,再加盐酸共热。则硒酸转化为亚硒酸,反应是 ( )
![]()
再将![]() 通入亚硒酸溶液中,出现单质硒的沉淀。则有关结论正确的是 ( )
通入亚硒酸溶液中,出现单质硒的沉淀。则有关结论正确的是 ( )
A.![]() 的氧化性比氯气强
的氧化性比氯气强
B.二氧化硒的还原性比二氧化硫强
C.析出l![]() 硒要用
硒要用![]() 、
、![]() 各1
各1![]()
D.![]() 的氧化性比
的氧化性比![]() 强
强
18.向甲、乙两杯中盛有1 ![]() 的稀硫酸里分别投入m g镁、m
g锌,反应停止后,发现一个烧杯中仍有金属残留,则硫酸的物质的量浓度数值
的稀硫酸里分别投入m g镁、m
g锌,反应停止后,发现一个烧杯中仍有金属残留,则硫酸的物质的量浓度数值![]() 是 ( )
是 ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
第Ⅱ卷(非选择题,共51分)
四、(本题包括2小题,共13分)
19.(6分)现欲用实验证实![]() 既具有氧化性又具有还原性。现有试剂溴水、硫化钠溶液、亚硫酸钠溶液、稀硫酸、氢氧化钠溶液、氨水。
既具有氧化性又具有还原性。现有试剂溴水、硫化钠溶液、亚硫酸钠溶液、稀硫酸、氢氧化钠溶液、氨水。
(1)要证明![]() 具有还原性,应选用的试剂有
,
具有还原性,应选用的试剂有
,
看到的现象有
化学方程式为
(2)要证明![]() 具有氧化性,应选用的试剂有 ,
具有氧化性,应选用的试剂有 ,
看到的现象有
化学方程式为
20.(7分)为检验浓硫酸与木炭在加热条件下反应产生![]() 和
和![]() 气体,设计了如下图所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用
气体,设计了如下图所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用![]() 和淀粉的蓝色溶液浸湿的脱脂棉。
和淀粉的蓝色溶液浸湿的脱脂棉。
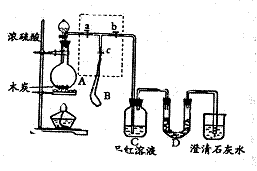 |
请回答下列问题:
(1)实验前欲检查装置A的气密性,可以采取的操作是: .
(2)此实验成败的关键在于控制反应产生气体的速率不能过快,由此设计了虚框部分的 装置,则正确的操作顺序是 (用操作编号填写);
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤 压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
(3)实验时,装置C中的现象为 。
(4)当D中产生 (多选不得分)现象时,可以说明使E中澄清石灰水变浑的是![]() ,而不是
,而不是![]() ;
;
A.进气口一端脱脂棉蓝色变浅,出气口一端脱脂棉蓝色不变
B.脱脂棉上蓝色均变浅
C.脱脂棉上蓝色褪去
则装置D的作用为 。
五、(本题包括2小题,共14分)
21.(6分)某无色溶液可能含有下列钠盐中的几种:(A)氯化钠、(B)硫化钠、(C)亚硫酸钠、(D)硫代硫酸钠、(E)硫酸钠、(F)碳酸钠。向此溶液中加入适量稀硫酸,有浅黄色的沉淀析出,同时有气体产生。此气体有臭鸡蛋气味,可使澄清的石灰水变浑浊,但不能使品红试液褪色。根据上述实验现象回答下列问题。
(1)不能使品红试液褪色;说明该气体中不含 (填分子式)。
(2)此无色溶液中至少存在哪几种钠盐?请写出全部可能的情况(填写相应的字母,有几种填几种,也可补充)。
第一种情况是: ;第二种情况是 ;
第三种情况是: ;第四种情况是 。
22.(8分)过氧化氢(![]() )常被称为“绿色氧化剂”,它和水是极弱的电解质,但它比水易电离。
)常被称为“绿色氧化剂”,它和水是极弱的电解质,但它比水易电离。
(1)水电离生成![]() 和
和![]() 叫做水的自偶电离。同水一样,过氧化氢也有极弱的自偶电离,其自偶电离的电离方程式为 。
叫做水的自偶电离。同水一样,过氧化氢也有极弱的自偶电离,其自偶电离的电离方程式为 。
(2)由于![]() 显弱酸性,在一定条件下它能同强碱作用生成正盐或酸式盐,请写出
显弱酸性,在一定条件下它能同强碱作用生成正盐或酸式盐,请写出![]() 与
与![]() 反应生成正盐的化学方程式 。
反应生成正盐的化学方程式 。
(3)将![]() 溶液滴入含有酚酞的
溶液滴入含有酚酞的![]() 溶液中,红色消失。甲同学认为这是由于
溶液中,红色消失。甲同学认为这是由于![]() 是二元弱酸,消耗了
是二元弱酸,消耗了![]() ,而使红色褪去。乙同学认为
,而使红色褪去。乙同学认为![]() 具有强氧化性,将酚酞氧化,红色消去。试设计一个实验论证甲、乙两位同学的解释中谁正确
具有强氧化性,将酚酞氧化,红色消去。试设计一个实验论证甲、乙两位同学的解释中谁正确
。
(4)甲同学向品红溶液中通入一种气体后,品红褪色。乙同学设计了一个很简便的实验便知甲同学通的是![]() 还是
还是![]() ,他的实验方案是
,他的实验方案是
。
六、(本题包括2小题,共12分)
23.(6分)已知X是淡黄色固体单质.A、B都是钾盐,C是硫酸盐,D和E是无色气体。据以下反应来判断六种物质的化学式:
①![]() (稀)
(稀)![]() ②
②![]()
③![]() ④
④![]()
⑤![]()
A: ;B: ;C: ;
D: ;E: ;X: 。
24.(6分)混合气体中可能有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的一种或几种,将其通人氯水,得无色透明溶液。把溶液分为两份,一份加入盐酸酸化的氯化钡溶液出现白色沉淀;另一份加入用硝酸酸化的
中的一种或几种,将其通人氯水,得无色透明溶液。把溶液分为两份,一份加入盐酸酸化的氯化钡溶液出现白色沉淀;另一份加入用硝酸酸化的![]() 溶液也有白色沉淀生成。从实验可知原气体中:
溶液也有白色沉淀生成。从实验可知原气体中:
(1)肯定 .
(2)肯定没有 .
(3)不能肯定是否有 .
七、(本题包括2小题,共12分)
25.(6分)某化工厂以黄铁矿(主要成分为)为原料生产硫酸。设空气中的氧气的体积分数为![]() ,如果该厂生产98%的浓硫酸
,如果该厂生产98%的浓硫酸![]() ,不考虑其他各生产阶段的物料损失。试完成下列各题:
,不考虑其他各生产阶段的物料损失。试完成下列各题:
(1)写出工业法生产硫酸的化学方程式 。
(2)需要含![]() 60%的矿石质量是
t。
60%的矿石质量是
t。
(3)最少需要消耗空气的体积(标准状况)为多少![]() ?
?
26.(6分)向铜片中加某浓度的硫酸120![]() ,在加热条件下反应,待铜中全部溶解后,将其溶液稀释到500
,在加热条件下反应,待铜中全部溶解后,将其溶液稀释到500![]() ,再加入足量锌粉,使之充分反应,收集到标准状况下气体2.24L,过滤残留固体,干燥后称量,质量减轻了7.5g,求原硫酸的物质的量浓度。
,再加入足量锌粉,使之充分反应,收集到标准状况下气体2.24L,过滤残留固体,干燥后称量,质量减轻了7.5g,求原硫酸的物质的量浓度。
单元检测题(七)参考答案
1.C 2.B 3.B 4.C 5.C 6.AC 7.D 8.C 9.A 10.C 11.A 12.C 13.BD 14.C
15.A 16.A 17.A 18.C
19.(1)溴水、亚硫酸钠溶液;溶液由橙色变为无色;
![]()
(2)硫化钠溶液、亚硫酸钠溶液、稀硫酸;溶液变浑浊;
![]()
20.(1)关闭分液漏斗的活塞,打开止水夹a和b,关闭c,用手捂热(或微热)圆底烧瓶A,若C中有气泡冒出,移开手掌(或热源)后,C处导管内有水上升,则证明A装置的气密性良好。
(2)③①②
(3)品红溶液褪色
(4)A,除去![]() 并检验
并检验![]() 已被除净
已被除净
21.(1)![]() (2)第一种情况:BCF第二种情况:BDF
(2)第一种情况:BCF第二种情况:BDF
22.(1)![]() (2)
(2)![]()
(3)向红色消失后的溶液中滴加![]() 溶液,若再现红色,则为
溶液,若再现红色,则为![]() 酸性所致,甲同学的见解正确,若不再为红色,则酚酞被
酸性所致,甲同学的见解正确,若不再为红色,则酚酞被![]() 氧化所致,乙的见解正确。
氧化所致,乙的见解正确。
(4)将褪色后的溶液加热,若红色再现,是![]() 通入所致,若不再变红色,则通入的是
通入所致,若不再变红色,则通入的是![]() 。
。
23. A:![]() B:
B:![]() C:
C:![]() D:
D:![]() E:
E:![]() X:
X:![]()
24.(1)![]() (2)
(2)![]() (3)
(3)![]()
25.(1)![]()
![]()
![]()
(2)100t (3)![]()
26. ![]()