高考化学第一轮单元测试题(10)
第十单元 化学反应速度 化学平衡
本试卷分第Ⅰ卷和第Ⅱ卷共100分,考试时间100分钟可能用到的相对原子质量:
H:1 C:12 O:16 N:14
第Ⅰ卷(选择题,共49分)
一.选择题(本题包括5小题,每小题2分,共10分。每小题只有一个选项符合题意。)
1.将等物质的量与X2和Y2置于一密闭容器中,在一定条件下发生反应:
m X2(g)+n Y2(g) ![]() pZ(g),达到平衡时,测得容器中,c(X2)=0.1 mol·L-1,m(Y2)=0.9 mol·L-1, c(Z)=0.8 mol·L-1,则Z的化学式可能是
( )
pZ(g),达到平衡时,测得容器中,c(X2)=0.1 mol·L-1,m(Y2)=0.9 mol·L-1, c(Z)=0.8 mol·L-1,则Z的化学式可能是
( )
 A.X3y
B.XY3
C.X2Y4 D.X3Y3
A.X3y
B.XY3
C.X2Y4 D.X3Y3
2.已知工业上真空炼铷的原理如下:2RbCl+Mg MgCl2+2Rb(g),对于此反应的进行能给予正确解释是 ( )
A.铷的金属活动性不如镁强,故镁可置换铷
B.铷的沸点比镁低,把铷蒸气抽出时,平衡右移
C. MgCl2的热稳定性不如Rb强
D.铷的单质状态较化合态更稳定
3.可逆反应:CO(气)+NO2(气)![]() CO2(气)+NO(气);△H=-226
kJ/mol,在下列情况下不能使反应速度加快的是
( )
CO2(气)+NO(气);△H=-226
kJ/mol,在下列情况下不能使反应速度加快的是
( )
A.充入NO2 B.升高温度
C.减小压强,扩大容积体积 D.增加压强,缩小容器体积
4.下列条件的变化,是因为降低反应所需要的能量,增加单位体积内反应物分子中活化分子的百分数而使反应速度加快的是 ( )
A.增大浓度 B.增大压强
C.升高温度 D.使用催化剂
5.在四个不同的容器中,在不同条件下进行合成氨反应。根据下列在相同时间内测定的结果判断生成氨的速率最快的是 ( )
A.v(H2)=0.1 mol·L-1·min-1 B.v(N2)=0.1 mol·L-1·mol-1
C.v(N2) =0.2 mol·L-1·min-1 D.v(NH3)=0.3 mol·L-1·mol-1
二、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个或两个选项符合题意。)
6.把6 mol A和5 mol B两气体通入容积为4 L的密闭容器中,一定条件下反应:3A(气)+B(气)![]() 2C(气)+xD(气);△H<0,5 min达平衡,此时生成2 mol C,测得C的平均反应速率为0.1 mol·(L·min)-1。下列说法中正确的是
( )
2C(气)+xD(气);△H<0,5 min达平衡,此时生成2 mol C,测得C的平均反应速率为0.1 mol·(L·min)-1。下列说法中正确的是
( )
A.降低平衡体系的温度,逆反应速率变小,正反应速率增大,平衡正向移动
B.恒温下达到平衡的标志是C和D的生成速率相等
C.A的平均速度为0.15 mol·(L·min)-1
D.B的转化率为25%
7.在一定温度下将3.0 mol M和2.5 mol N混合于2.0 L的密闭容器中,发生反应的化学方程式为3M(g)+N(g)![]() xP(G)+2Q(g),5 min后反应达到平衡,容器内的压强变小,已知Q的平均反应速率为0.10 mol·L-1,则正确说法错误的是
( )
xP(G)+2Q(g),5 min后反应达到平衡,容器内的压强变小,已知Q的平均反应速率为0.10 mol·L-1,则正确说法错误的是
( )
A.平衡时容器内的压强是原来的0.8倍
B.M的平均反应速率为0.15 mol·L-1·min-1
C.x的值为1
D.平衡时P的浓度为0.25 mol·L-1
8.某反应:2A(g) ![]() B(g)+C(g),在甲、乙两个容积都是1L,且不变的容器中进行,开始时在两个容器中均放入0.5 mol A,甲容器中3s后B的物质的量浓度达到0.18 mol/L且保持不变,乙容器中2s时B的物质的量浓度即达到0.18 mol/L,且保持不变,则( )
B(g)+C(g),在甲、乙两个容积都是1L,且不变的容器中进行,开始时在两个容器中均放入0.5 mol A,甲容器中3s后B的物质的量浓度达到0.18 mol/L且保持不变,乙容器中2s时B的物质的量浓度即达到0.18 mol/L,且保持不变,则( )
A.乙容器中使用了比甲容器更高的温度
B.乙容器中加入了某种不与体系反应的气体增大了容器内的压强
C.乙容器中使用了催化剂
D.乙容器中可能既升高了温度又使用了催化剂
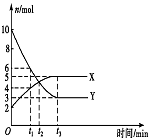 9.一定温度下在密闭容器内进行着某一反应,X气体,Y气体的物质的量随反应时间变化的曲线如右图所示。下列叙述正确的是 ( )
9.一定温度下在密闭容器内进行着某一反应,X气体,Y气体的物质的量随反应时间变化的曲线如右图所示。下列叙述正确的是 ( )
A.反应的化学方程式是5Y![]() X
X
B.t 1时,Y的浓度是X浓度的1.5倍
C.t1时,正、逆反应速率相等
D.t2时,逆反应速率大于正反应速率
10.某温下,反应2A(g)![]() B(g);△H<0,在密闭容器中达到平衡,反应再次平衡,平衡后c(A)/c(B)=a,若改变某一条件,反应再次平衡,此时c(A)/c(B)=b,下列叙述中正确的是
( )
B(g);△H<0,在密闭容器中达到平衡,反应再次平衡,平衡后c(A)/c(B)=a,若改变某一条件,反应再次平衡,此时c(A)/c(B)=b,下列叙述中正确的是
( )
A.在该温度下,保持容积固定不变,向容器内补充了B气体,则a>b
B.保持温度、压强不变,充入惰性气体,则有a=b
C.若其他条件不变,升高温度,则有a>b
D.若a=b,容器中一定使用了催化剂
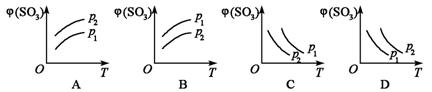
11.如下图所示,反应2SO2(g)+O2(g) ![]() 2SO2(g);△H<0,在不同温度下、不同压强(p1>p2)下达到平衡,混合气体中SO3的体积分数φ(SO3)随温度变化的曲线应为
( )
2SO2(g);△H<0,在不同温度下、不同压强(p1>p2)下达到平衡,混合气体中SO3的体积分数φ(SO3)随温度变化的曲线应为
( )
 |
12.T℃时,将一定量的混合气体在密闭容器中发生反应aA(g)+bb(g)![]() cC(g)+dD(g),平衡后测得B气体的浓度为0.6 mol/L,恒温下,将密闭容器中的容积扩大1倍,重新达到平衡后,测得B气体的浓度为0.4 mol/L,下列叙述正确的是
( )
cC(g)+dD(g),平衡后测得B气体的浓度为0.6 mol/L,恒温下,将密闭容器中的容积扩大1倍,重新达到平衡后,测得B气体的浓度为0.4 mol/L,下列叙述正确的是
( )
A.重新达到平衡时,D的体积分数减小
B.a+b<c+d
C.平衡向右移动
D.重新达到平衡时,A气体浓度增大
 13.如右图所示,外界条件(温度、压强)的变化的对下列反应的影响L(s)+G(g)
13.如右图所示,外界条件(温度、压强)的变化的对下列反应的影响L(s)+G(g) ![]() 2R(g)(正反应为吸热反应),在图中,y轴是指 ( )
2R(g)(正反应为吸热反应),在图中,y轴是指 ( )
A.平衡混合气中R的体积分数
B.平衡混合气体G的体积分数
C.平衡时反应物G的转化率
D.平衡时反应物L的转化率
三、选择题(本题包括5小题,每小题3分,共15分,每小题只有一个选项符合题意)
14.对反应4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g);△H<0。下列有关叙述正确的是
( )
2N2(g)+6H2O(g);△H<0。下列有关叙述正确的是
( )
A.化学反应速率关系是2V(NH3)=3V(H2O)
B.若单位时间内生成a mol NO,同时消耗a mol NH3
C.其他条件不主,增大容积体积,则正反应速率减小,逆反应速率增大
D.其他条件不变,降低温度,NO的物质的量分数将增大
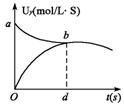 15.在密闭容器中充入X、Y两种物质各2 mol,发生如下反应:当反应达到平衡后,以Y的浓度改为表示反应速率V正,V逆与时间t的关系如图。如果容器的容积固定为2 L,则Y的平衡浓度的表在式(式中的S指对应区域的面积)为
( )
15.在密闭容器中充入X、Y两种物质各2 mol,发生如下反应:当反应达到平衡后,以Y的浓度改为表示反应速率V正,V逆与时间t的关系如图。如果容器的容积固定为2 L,则Y的平衡浓度的表在式(式中的S指对应区域的面积)为
( )
A.2-Saob
B.1-Saob
C.2-Sabd
D.1-Sbod
16.在1只固定容积的密闭容器中,放入3 L气体X和2L气体Y,在一定条件下发生了下列反应:4X(g)+3Y(g)![]() 2Q(g)+nR(g)在平衡后,容器内温度不变,混合气体的压强比原来增大了50%,X的浓度减小1/3,则此反应中的n值是
( )
2Q(g)+nR(g)在平衡后,容器内温度不变,混合气体的压强比原来增大了50%,X的浓度减小1/3,则此反应中的n值是
( )
A.3 B.4 C.5 D.6
17.一定温度下,在带活塞的密闭容器中,反应H2(g)+I2(g) ![]() 2HI(g)(正反应为放热反应)达到平衡后,下列说法中不正确的是
( )
2HI(g)(正反应为放热反应)达到平衡后,下列说法中不正确的是
( )
A.恒压时,通入HI气体,刚开始时正反应速率会减小
B.恒温时,减小容积,平衡不移动,但气体颜色加深
C.恒容时,通入H2,I2的质量分数减小
D.恒容时,升高温度,平衡向逆反应方向移动,正反应速率减小
18.在固定容积的密闭容器中,反应2X![]() Y(g)+Z(s)已达到平衡,此时升高温度则气体混合物的密度增大,下列叙述正确的是
( )
Y(g)+Z(s)已达到平衡,此时升高温度则气体混合物的密度增大,下列叙述正确的是
( )
A.若X为非气态,则正反应为放热反应
B.若正反应为放热反应,则X为气态
C.在平衡混合物中加入少量Z(s),则平衡向左移动
D.压强变化对该平衡没有影响
第Ⅱ卷(选择题,共49分)
四、(本题包括2小题,共13分)
19.(7分)将1 mol I2(g)+ 2 mol H2(g)![]() 2HI(g);△H<0,并达到平衡。HI的体分数为φ(HI)随时间的变化如右图中曲线(Ⅱ)所示:
2HI(g);△H<0,并达到平衡。HI的体分数为φ(HI)随时间的变化如右图中曲线(Ⅱ)所示:
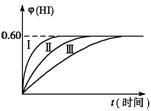 (1)达到平衡时,I2(g)的物质的量浓度为_____ mol·L-1。
(1)达到平衡时,I2(g)的物质的量浓度为_____ mol·L-1。
(2)若改变反应条件,在甲条件φ(HI)的变化如图中曲线(Ⅰ)所示,在乙条件下φ(HI)的变化如图中曲线(Ⅲ)所示,则甲条件可能是______ ,乙条件可能是______ (填入下列条件的序号)。
①恒容条件下,升高温度 ②恒容条件下,降低温度 ③恒温条件下,缩 小反应容器的体积 ④恒温条件下,扩大反应容器的体积 ⑤恒温、恒容的条件下,加入适当催化剂
(3)若保持温变不变,在另一容积也为2 L的密闭容器中加入a molI2(g)、b molH2、 和c mol HI(a、b、c均大于0),发生反应达到平衡时,HI的体积分数仍为0.60,则a、b、c的关系是________。
20.(6分)在直空密闭容器内加入a mol PH4I固体,在一定温度下发生如下反应:
PH4I(s) ![]() PH3(g)+HI(g) 4 PH3(g)
PH3(g)+HI(g) 4 PH3(g) ![]() P4(g)+6H2(g)
P4(g)+6H2(g)
2HI(g) ![]() H2(g)+ I2(g)以上三反应建立平衡后,测得HI为b mol、I2(g)为c mol、H2为 d mol。求:
H2(g)+ I2(g)以上三反应建立平衡后,测得HI为b mol、I2(g)为c mol、H2为 d mol。求:
(1)平衡后,容器内P4(g)和PH3的物质的量(用代数式表示)
n(P4)=__________; n(PH3)=__________;
(2)a、b、c三者的关系服从a>_____ (填含b、c的代数式)。
b、c、d、三者的关系服从b>_____(填c、d的代数式)。
(3)平衡后,增大压强,容器内n(I2)____ , n(PH4I)_____ (填“增加”、“减小”或“不变”)。
五、(本题包括2小题,共12分)
21.(6分)在重铬酸钾(K2Cr2O7)溶液中存在如下平衡:
Cr2O2-7+H20![]() 2HCrO-7
2HCrO-7![]() Cr2O2-4+2H+
Cr2O2-4+2H+
(1)加入H2SO4,使Cr2O72-溶液的pH降低,则溶液中c(Cr2O72-)与c(Cr2O42-)的比值
将______(填“增大”、“减小”或“不变”)。
(2)向K2Cr2O7溶液中加入AgNO3溶液,发生离子互换反应,生成砖红色沉淀且溶液的pH下降,生成的砖红色沉淀的化学式为 __。
(3)重铬酸钾在酸性溶液中是强氧化剂。例如它在H2SO4存在的条件下要把Fe2+离子
氧化成Fe3+离子,本身被还原成Cr3+离子。该反应的离子方程式为_______。
22.(6分) (1)将1 mol CO和1 mol H2O(g)充入某固定容积的反应器,在某条件下达到平衡:
CO(g)+H2O(g)中CO2(g)十H2(g),此时有2/3的CO转化为CO2。
①该平衡混合物中C02的体积分数为______。
②若在相同条件下,向容器中充入1 mol CO2、1 mol H2和1 mol H2O,则达到平衡时与(1)相比较,平衡应向______移动(填“正反应方向”、“逆反应方向”或“不”),此时平衡混合物中CO2的体积分数可能是下列各值中的_____(填编号)
A.22.2% B.27.55% C.33.3% D.36.8%
③假如②中平衡向正反应方向移动时,则下列说法中正确的是_____(填序号)
①生成物的产量一定增加 ②生成物的体积分数一定增加
③反应物的转化率一定增加 ④反应物的浓度一定降低
⑤正反应速率一定大于逆反应速率 ⑥一定使用了催化剂
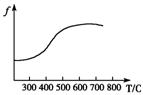 (2)已知在硫酸工业中
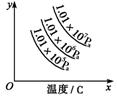
(2)已知在硫酸工业中
①SO2转化为SO3的反应为2SO2+O2 2SO3(正反应放热)
②经测定,在常压下上述反应的平衡混合气体中,SO3的体积
分数为91%。
③催化剂V2O5的催化效率/与温度T有如图关系。
④经除尘去杂后的SO2气体的温度约为200℃,反应后的SO3,气体的温度约为600℃。
请根据以上信息,选择SO2氧化为SO2的适宜生产条件是______________
__________。
六、(本题包括2小题,共12分)
23.(6分)如图所示,某刚性容器内有一活塞和弹簧,B内为真空,A内已充入3 mol H2和1 mol N2,发生可逆反应:3H2(g)十N2(g) ![]() 2NH3(g)(正反应为放热反应),乎衡时,活塞保持静止。此时,
2NH3(g)(正反应为放热反应),乎衡时,活塞保持静止。此时,
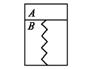 (1)往A内迅速再充人3 mol H2和I mol N2活塞将如何运动?_______________________________;当活塞再次保持静止时,H2的反应速率v与原平衡时H2的反应速率v0的大小关系为v_____v0 (填“<”、“>”或 “二”),同时H2的转化率比原平衡时______(填“增大”、“减小”或“不变”。
(1)往A内迅速再充人3 mol H2和I mol N2活塞将如何运动?_______________________________;当活塞再次保持静止时,H2的反应速率v与原平衡时H2的反应速率v0的大小关系为v_____v0 (填“<”、“>”或 “二”),同时H2的转化率比原平衡时______(填“增大”、“减小”或“不变”。
(2)如果对容器加热,使A内气体温度升高,活塞将向下移动,活塞下滑的原因是
①__________________________________________________________________
②__________________________________________________________________
24.(6分)反应aA(g)十bB(g) ![]() cC(g)十dD(g)在容积不变的密闭容器中达到平衡,且起始时A与B的物质的量之比为a:b。则
cC(g)十dD(g)在容积不变的密闭容器中达到平衡,且起始时A与B的物质的量之比为a:b。则
(1)平衡时,A与B的转化率之比是_______;
(2)若同等倍数地增大A、B的物质的量浓度,要使A与B的转化率同时增大,(a+b)与(c+d)必须满足的关系是(a+b)______(c+d)(填“>”、“<”或“=”)
(3)设定a=2,b=2,c=3,d= 2,在甲、乙、丙、丁四个完全相同的密闭容器中进行上述反应。假使起始时甲、乙、丙、丁四个容器中A的物质的量依次是2 mol、1 mol、2 mol、1mol,B的物质的量依次是1 mol、1 mol、2mol、2mol,C、D的物质的量均为0, 则在相同温度下达到平衡时,A的转化率最大的容器是___________,B的转化率由大到 小的顺序是(填容器代号)______________________。
七、(本题包括2小题,共14分)
25.(6分)恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
(1)若反应进行到某时刻t时,nt(N2) ![]() 13
mol,nt(NH3)=6 mol,计算a的值_____
。
13
mol,nt(NH3)=6 mol,计算a的值_____
。
(2)反应达平衡时,混合气体的体积为716.8L(标准状况下),其中NH3含量(体积分数)为25%。计算平衡时NH3的物质的量_______________。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始):n(平)=_______。
(4)原混合气体中,N2和H2 的转化率之比a(N2):b(H2)=________。
(5)达到平衡时,N2和H2的转化率之比,n(N2):n(H2)=____________。
(6)平衡混合气体中,n(N2):n(H2): n(NH3)_____________________。
26.(8分)在一个带活塞的密闭不锈钢筒中,吸入一定量的炭粉(足量)和1 g水,加热至100℃,发生反应:
![]() C(s)+H2O(g)
C(s)+H2O(g) ![]() CO(g)+H2(g)。一会儿,钢筒处于图所
CO(g)+H2(g)。一会儿,钢筒处于图所
示状态,活塞位于A处。
(1)在1000℃和1.01×105Pa时,钢筒中气体的体积______5.8 L(填“大于”、“等于”或“小于”),其原因是__________________________。
(2)当温度不变时,将活塞向右推进至B处时,混合气体的相对分子质量________。(填“增大”、“不变”或“减小”),其原因是____________________。
(3)如果开始时吸入的是一定量的炭粉(足量)以及x mol H20、y mol CO和z mol H2,控制在1000℃和1.01×105Pa,一会儿把活塞向右推,发现混合气体的平均相对分子质量变化与(2)中变化刚好相反,则x、y、z应满足什么条件?原混合气体CH2O为气态)的平均相对分子质量应满足什么条件?
化学反应速度 化学平衡
1.A 2.B 3.C 4.D 5.C 6.C 7.A 8.C 9.B 10.A 11.C 12.A 13.B 14.D 15.B 16.D 17.D 18.D
19.(1)0.05 (2)③⑤ ④(3)2b-4a=c
20.(1)1/6(d- c) mol [2/3(3 c-d)+ b]mol (3) d+2 c 2/3(d-4c) (3)减少 增加
21.Ⅰ.(1)增大 (2)Ag2CrO4 (3)Cr2O2-7+6Fe2++14H+=2Cr3++6Fe3++7H2O
22.(1)①33.3% ②正反应方向;D ③①②⑤
(2)O2或空气适当过量,常压,450-500℃,使用热交换器。
23.(1)活塞先向下运动,后缓慢向上运动 > 增大
(2)①根据平衡移动原理,升温平衡向逆反应方向移动,这导致气体物质的量增大,从而压强增大; ②升高温度,气体本身受热膨胀,从而压强增大。
24.(1)1:1 (2)> (3)丁 甲>乙>丙>丁
25.(1)16 (2)8 mol (3)5:4 (4)2:3 (5)1:2 (6)3:3:2
26.(1)大于 由pV:nRT可知,1gH20在1000℃的体积V=nRT/ p=5.8L,反应向正反应方向进行,正反应为气体体积增加的反应,所以钢筒中气体体积大于5.8L
(2)增大 右端CO和她的平均相对分子质量=(28+2)/2= 1.5,左端H2O(g)的相对分子质量为18,加压平衡向左移动,即向相对分子质量增加的方向移动,所以加压到B处的平均相对分子质量增大。
(3)3x+8y<5z 平均相对分子质量应满足M(初)<12