高考化学第一轮总复习试卷(九)
几种重要的金属 命题人:张艳飞
第Ⅰ卷 (选择题 共54分)
一、选择题(本题包括18小题,每小题3分,共54分。每小题只有一个选项符合题意)
1.2004年7月15日晚,一场盛大的焰火晚会在存瑞中学西操场举行,把庆祝该校04高考再创辉煌活动推向高潮。焰火绽放出的五颜六色是一些金属离子魅力的展示。焰火的主要原料是黑火药,还有草酸钠、碳酸铜(发出绿色的光)等发色剂和氯酸钾、镁铝合金粉等添加剂。下列说法正确的是
A.碳酸铜因为受热分解才发出绿色的光 B.氯酸钾的主要用途是产生紫色的焰火
C.镁铝合金粉在焰火中发出耀眼的白光 D.黑火药的主要成分是木炭、硫磺
2.“纯净水”、“太空水”、“蒸馏水”等商品作为日常饮用水,因缺少某些成分而不利于少年儿童健康,你认为制备上述商品饮用水时至少还需要添加微量的化学物质是( )
A.钙和镁的碳酸氢盐 B.含碘酸盐的食盐
C.漂白粉等消毒剂 D.小苏打
3.在氯化铁、氯化铜和盐酸混和溶液中加入铁粉,待反应结束,所剩余的固体滤出后能被磁铁吸引,则反应后溶液中存在较多的阳离子是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
4.欲除去铝壶底的水垢,所加的试剂为( )
A.浓盐酸 B.浓![]() C.浓
C.浓![]() D.浓NaOH溶液
D.浓NaOH溶液
5.镁粉在焰火、闪光粉、鞭炮中是不可缺少的原料,工业制造镁粉是将镁蒸气在某冷却剂中冷却,下列可作为冷却剂的是( )
①空气 ②![]() ③Ar ④
③Ar ④![]() ⑤
⑤![]() ⑥
⑥![]()
A.①② B.③④ C.③⑥ D.③⑤
6、下列各组无色溶液的离子组在pH=l时能大量共存的是
A、NH4+、C1—、Mg2+、SO42— B、A13+、Cu2+、SO42—、C1—
C、Ba2+、K+、NO3—、OH— D、 Ca2+、Na+、C1—、A1O2—
7、镁铁混合物4.9g,溶解在过量某浓度的稀硝酸中,完全反应得到标况下气体2.24L(假设气体全为NO),则向反应后的溶液中加入足量的烧碱,则可生成沉淀的量是
A.6g B.8g C.10g D.12g
8.下列离子方程式书写正确的是
A.NaHCO3的水解: HCO3-+H2O![]() H3O+
+CO32-
H3O+
+CO32-
B.氯化铝溶液加入过量氨水 Al3+ + 4OH- = AlO2- + 2H2O
C.碳酸钙溶于醋酸 CaCO3 + 2CH3COOH = Ca2+ + 2CH3COO- + H2O + CO2
D.次氯酸钙溶液中通入过量CO2 Ca2+ + 2ClO- + H2O + CO2 = CaCO3¯ + 2HClO
9、化合物Fe0.95O具有NaCl型结构。由于n(Fe)∶n(O)<1,所以晶体存在缺陷,Fe0.95O可表示为
A. ![]() B.
B. ![]() C.
C. ![]() D.
D.![]()
10.下列变化中不可能通过一步实验直接完成的是( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
11.下列生产目的能达到的是( )
A.![]() 溶液与
溶液与![]() 溶液反应制
溶液反应制![]() B.用浓
B.用浓![]() 与溴化钠反应制取溴化氢
与溴化钠反应制取溴化氢
C.用铝粉与软锰矿(含![]() )可制得锰 D.用镁粉和空气反应可制得
)可制得锰 D.用镁粉和空气反应可制得![]()
12.将3.9g镁铝合金投入到500mL ![]() 的盐酸中,金属完全溶解,再加入
的盐酸中,金属完全溶解,再加入![]() 的NaOH溶液。若要生成的沉淀最多,则加入这种NaOH溶液的体积为( )
的NaOH溶液。若要生成的沉淀最多,则加入这种NaOH溶液的体积为( )
A.560 mL B.200mL C.250 mL D.无法计算
13.甲、乙、丙、丁分别是![]() 、
、![]() 、NaOH、
、NaOH、![]() 四种物质中的一种,若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失,丁溶液滴入甲溶液时,无明显现象发生,据此可推断丙物质是( )
四种物质中的一种,若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失,丁溶液滴入甲溶液时,无明显现象发生,据此可推断丙物质是( )
A.![]() B.NaOH C.
B.NaOH C.![]() D.
D.![]()
14.2004年5月,保利集团在香港拍卖会上花费3000多万港币购回在火烧圆明园时流失的国宝:铜铸的牛首、猴首和虎首。普通铜器时间稍久容易出现铜绿,其主要成份是![]() 。这三件1760年铜铸的国宝在240年后看上去仍然熠熠生辉不生锈,下列对其原因的分析,最可能的是( )
。这三件1760年铜铸的国宝在240年后看上去仍然熠熠生辉不生锈,下列对其原因的分析,最可能的是( )
A.它们的表面都电镀上一层耐腐蚀的黄金 B环境污染日趋严重,它们表面的铜绿被酸雨溶解
C.铜的金属活动性比氢小,因此不易被氧化D.它们是含一定比例金、银、锡、锌的铜合金
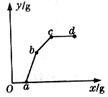 15.图13-1中y轴表示沉淀质量,x轴表示向某溶液中滴加的试济的质量。该图能表示下列过程中的(
)
15.图13-1中y轴表示沉淀质量,x轴表示向某溶液中滴加的试济的质量。该图能表示下列过程中的(
)
A.向用盐酸酸化的![]() 溶液中滴加
溶液中滴加![]() 溶液
溶液
B.向磷酸溶液中滴加澄清石灰水
C.向硫酸溶液中滴加![]() 溶液
溶液
D.向![]() 溶液中滴加NaOH溶液并煮沸
溶液中滴加NaOH溶液并煮沸
16. 把一块Al、Fe合金放入足量盐酸中,通入足量的Cl2 ,再加过量NaOH 溶液、过滤,把滤渣充分灼烧,得到固体残留物恰好与原合金质量相等,则合金中Fe、Al质量比为( )
A、1:1 B、3:1 C、1:4 D、7:3
| A | B |
| |
| 甲 | 8g | 4g | 11g |
| 乙 | 7g | 5g | 11g |
17.金属A和非金属B可以直接化合生成化合物![]() 。甲、乙两同学分别做A和B化合的实验,每人所用A和B的质量不相同,但总质量12g,甲、乙所用A、B质量和得到的化合物
。甲、乙两同学分别做A和B化合的实验,每人所用A和B的质量不相同,但总质量12g,甲、乙所用A、B质量和得到的化合物![]() 的质量如下:则A、B所发生的反应为
的质量如下:则A、B所发生的反应为
A.![]() B.
B.![]() C.
C.![]()
D.![]()
18、向K2SO4 和FeCl3 的混合溶液中滴入Ba(OH)2溶液,当SO42-离子完全沉淀时,Fe3+离子也同时被完全沉淀,则原混合溶液中K2SO4 和FeCl3 的物质的量浓度之比为( )
A、3:1 B、3:2 C、2:1 D、2:3
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | |||||||||
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
第Ⅱ卷 (非选择题材 共46分)班级 分数
二、实验题
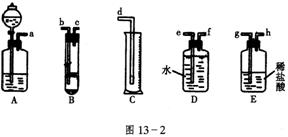
19.(10分)欲在13-2室温和![]() 条件下测定镁的相对原子质量。请利用图13-2给定的仪器(盛放镁条的隔板有小孔)组成一套实验装置(每仪器只允许用一次)。
条件下测定镁的相对原子质量。请利用图13-2给定的仪器(盛放镁条的隔板有小孔)组成一套实验装置(每仪器只允许用一次)。
 请回答下列问题:
请回答下列问题:
(1)假设气流方向为左→右,则各仪器的接口连接的先后顺序为(用小写字母填写)_________________________________。
(2)连接好仪器后,要进行的操作有以下几步:①待仪器B中的物质恢复至室温时,测量量筒C中水的体积(若假定将测定的体积换算成标准状况下V mL);②擦掉镁条表面的氧化膜,将其置于天平上称量(假定其质量为m并将其投入试管B中);③检查各装置的气密性;④旋开仪器A上分液漏斗活塞,当镁条完全溶解时再关闭活塞。上述几步操作的先后顺序是________________。
(3)根据实验数据可算出镁的相对原子质量,其数学表达式为________________________。
(4)若未将试管B冷却至室温就测量量筒C中水的体积,这将会使所测镁的相对原子质量数据(填“偏高”、“偏低”、“无影响”)_______________。
(5)若未擦净镁条表面氧化膜就进行实验,这将会使所测镁的相对原子质量数据(填“偏高”、“偏低”、“无影响”__________________。
三、(本题包括4小题,共29分)
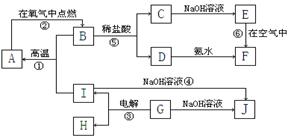 20、(10分)A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。请填写下列空白:
20、(10分)A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含同一种元素在周期表中位置___________________。
(2)写出C、G物质的化学式。C____________________ G______________________
(3)写出①、④、⑥反应的化学方程式。
反应①:___________________________________________________________
反应⑥:___________________________________________________________
(4)从能量变化的角度看,①②③反应中属于△H<0的反应是___________。(填序号)
21. (5分)在![]() 胶体溶液中,逐滴加入HI溶液,会发生一系列变化,请简述原因。
胶体溶液中,逐滴加入HI溶液,会发生一系列变化,请简述原因。
(1)开始出现红褐色沉淀,原因是_____________________________。
(2)随后沉淀溶解,溶液显黄色,原因是__________________________________,有关离子方程式为___________________________________.
(3)最后溶液颜色加深,原因是_________________________________________,有关离子方程式为___________________________________。
22.(4分)铜是生命必需的元素,也人类最早使用的金属之一,铜的生产和使用对国计民生各个方面产生了深远的影响。在化学反应中,铜元素可表现为0、+1、+2价。
(1)在西汉古籍中曾有记载:曾青得铁则化为铜[即:曾青(![]() )跟铁反应就生成铜]。试写出该反应的化学方程式:_____________________________。
)跟铁反应就生成铜]。试写出该反应的化学方程式:_____________________________。
(2)铜器表面有时会生成铜绿[![]() ],这层铜绿可用化学方法除去。试写出去铜绿而不损伤器物的反应的化学方程式:_________________________。
],这层铜绿可用化学方法除去。试写出去铜绿而不损伤器物的反应的化学方程式:_________________________。
23.(10分)我国首创的铝、空气、海水电池为能源的新型海水标志灯已研制成功。这种灯以海水为电解质,靠空气中的氧使铝不断氧化而产生电流。
(1)上述新型电池_________为负极,正极的电极反应式为_____________________
(2)自然界存在的铝矿物主要有铝土矿,它是含有少量氧化铁和石英等杂质的氧化铝,工业上制备单质铝需要纯净的氧化铝,试写出以铝土矿、海水、贝壳(主要成分为碳酸钙)为原料提纯氧化铝的化学方程式。要求只写含有铝的化合物参加的化学反应方程式,是离子反应的要求写离子方程式。____________________________________ ______
四、计算题
24.(7分)将1.05g铝和过氧化钠的混合物放入一定量的水中,充分反应后固体无剩余。再向其中加入50mL 1 mol·L一1的盐酸,可恰好使反应过程中产生的沉淀消失。求原混合物中铝、过氧化钠各多少克?