高考化学试题汇编 氮族元素
在一定条件下,NO跟NH3可以发生反应生成N2和H2O。现有NO和NH3的混合物1 mol,充分反应后所得产物中,若经还原得到的N2比经氧化得到的N2多1.4g。
(1)写出反应的化学方程式并标出电子转移的方向和数目。
(2)若以上反应进行完全,试计算原反应混合物中NO与NH3的物质的量可能各是多少。
(1)
(2)0.3 mol NO和0.7 mol NH3 或0.2 mol NH3和 0.8 mol NO
下列现象的产生与人为排放大气污染物氮氧化物无关的是
A . 闪电 B .光化学烟雾 C .酸雨 D .臭氧层空洞
(2000春季10)已知元素砷(As)的原子序数为33,下列叙述正确的是
A.砷元素的最高化合价为+3 B.砷元素是第四周期的主族元素
C.砷原子的第3电子层含有18个电子 D.砷的氧化物的水溶液呈弱碱性
已知KNO3、Cu(NO3)2、AgNO3三种硝酸盐的热分解反应方程式如下:
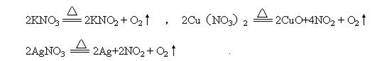
今有某固体可能由上述三种硝酸盐中的一种或几种组成,取适量该固体充分加热,得到一定量气体。若该气体经水充分吸收后,剩余气体的体积在同温同压下为吸收前的1/6,通过计算(忽略氧在水中的溶解)回答:
(1) 该固体是否可能只是由一种盐组成的?若可能,指出是哪种盐。
(2) 若固体是混合物,指出它的可能组成(物质的量之比)。
(1)可能,是纯AgNO3 (2)是KNO3与Cu(NO3)2按1:1混合 或三种盐KNO3与Cu(NO3)2物质的量1:1,而AgNO3物质的量可任意变动
铜和镁的合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL的NO2气体和336mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为
A.9.02g B.8.51g C.8.26g D.7.04g
关于氮族元素(用R代表)的下列叙述正确的是
A.最高化合价是+5 B.氢化物的通式为RH5 C.非金属性由上到下递增 D.其含氧酸均为一元强酸
有一种磷的结构式是![]() ,有关它的下列叙述不正确的是
,有关它的下列叙述不正确的是
A.它完全燃烧时的产物是P2O5 B.它不溶于水
C.它在常温下呈固态 D.它与白磷互为同分异构体
金属加工后的废切削液中含2~5%的NaNO2,它是一种环境污染物。人们用NH4Cl溶液来处理此废切削液,使NaNO2转化为无毒物质。该反应分两步进行:第一步:NaNO2+NH4Cl→NaCl+NH4NO2
第二步:NH4NO2![]() N2↑+2H2O 对第二步反应的叙述中正确的是
N2↑+2H2O 对第二步反应的叙述中正确的是
① NH4NO2是氧化剂② NH4NO2是还原剂③ NH4NO2发生了分解反应④ 只有氮元素的化合价发生了变化 ⑤ NH4NO2既是氧化剂又是还原剂
A.①③ B.①④ C.②③④ D.③④⑤
已知脊椎动物的骨骼中含有磷。以下是测定动物骨灰中磷元素含量的实验方法。称取某动物骨灰样品0.103 g,用硝酸处理,使磷转化成磷酸根。再加入某试剂,使磷酸根又转化成沉淀。沉淀经灼烧后得到组成为P2Mo24O77的固体(其式量以3.60×103计)0.504 g。试由上述数据计算该骨灰样品中磷的质量分数。(磷的相对原子质量以31.0 计。)
8.43%
亚硝酸钠外观类似食盐,可能因误食而发生食物中毒事故。欲鉴定之,可将亚硝酸钠及食盐用水溶解后,分别加入下列哪种溶液
A.NaNO3 B.AgNO3 C.KNO3 D.Cu(NO3)2
汽车排放的尾气中因含有氮的氧化物,而污染大气,造成产生氮的氧化物的主要原因是
A.燃烧含氮化合物燃料引起的 B.燃烧含铅汽油引起的
C.是由于燃烧不充分引起的 D.是在气缸中N2被氧化生成的
N2是空气的主要组成部分。因此有科学家根据蒸汽机的原理,设计制造出了液氮蒸汽机,即利用液态氮的蒸发来驱动机车,从而达到环境保护的目的。其原理主要依据是
A.液态氮的沸点为-195.8℃,远低于常温 B.N2在空气中燃烧放热
C.N2和H2反应放热 D.N2在空气中约占78%(体积分数)
(2001综合科化学试测题12)氮是蛋白质的基本组成元素之一,所有生物体均含蛋白质,氮循环涉及到生物圈的全部领域,以下关于氮的生物体的吸收途径正确的是
(1)氮在大气中高达78%,可被生物体直接利用。
(2)通过高能固氮可将空气中游离的氮转化为硝酸盐和氨,而被植物吸收。
(3)所有植物都具有生物固氮作用,其根部根瘤菌可是氮气转变成硝酸盐,而被植物吸收。
(4)动物以植物为食而获得氮并转化为动物蛋白
(5)动物死亡后,遗骸中的蛋白质被微生物分解成NH4+、NO3-、NH3,又回到土壤中和水体中,被植物再次吸收。
A.(1)(5) B.(3)(5) C.(2)(4)(5) D.(2)(4)
(1)磷在自然界里主要以 的形式存在于矿石中。磷的单质有多种同素异形体,其中最常见的是有毒的 和无毒的 。
(2)磷在不充足的氯气中燃烧的化学方程式为: 。
而在过量的氯气中燃烧的化学方程式则是: 。
(3)磷(原子量为31)在空气中燃烧生成的氧化物通常可用作强干燥剂。制备100g这种干燥剂所消耗的空气的体积约为 L(在标准状况下)。
(4)有机磷农药“乐果”的结构简式是: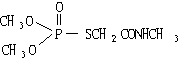 其中所含的双键有
个。
其中所含的双键有
个。
(1)磷酸盐 白磷 红磷
(2)2P+3Cl2![]() 2PCl3 2P+5Cl2
2PCl3 2P+5Cl2![]() 2PCl5
2PCl5
(3)188(空气中O2含量按21%计算)或197(空气中O2含量按1/5计算)
(4)2
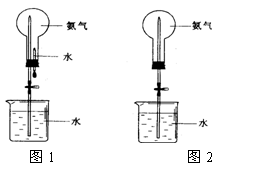
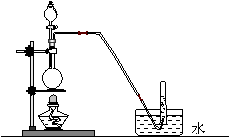
制取氨气并完成喷泉实验(图中夹持装置均已略去)。
(1)写出实验室制取氨气前化学方程式: 。
 (2)收集氨气应使用
法,要得到干燥
(2)收集氨气应使用
法,要得到干燥
的氨气可选用 做干燥剂。
(3)用图1装置进行喷泉实验,上部烧瓶已装
满干燥氨气,引发水上喷的操作
是 。该
实验的原理是 。
(4)如果只提供如图2的装置,请说明引发喷
泉的方法。
(1)2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O
(2)向下排空气 碱石灰
(3)打开止水夹,挤出胶头滴管中的水。
氢气极易溶解于水,致使烧瓶内气体压强迅速减小。
(4)打开夹子,用手(或热毛巾等)将烧瓶捂热,氢气受热膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉。
将H2、N2、O2三种气体分别放入不同容器中,使它们的温度、密度相同,则其压强(p)大小的关系,符合(原子量:H 1 N 14 O 16)
A.p(H2)>p(O2)>P(N2) B. p(O2)>P(N2)>p(H2) C.p(H2)>P(N2)>p(O2) D. P(N2)>p(O2)>p(H2)
0.03mol铜完全溶于硝酸,产生氮的氧化物NO、NO2、N2O4混合气体共0.05mol。该混合气体的平均相对分子质量可能是
A.30 B.46 C. 50 D.66
Ag/α-Al2O3是石油化学工业的一种重要催化剂,其中Ag起催化作用,α-Al2O3是载体且不溶于硝酸,该催化剂的回收实验如下图所示。其中的转化反应为:6AgCl+Fe2O3→3Ag2O+2FeCl3
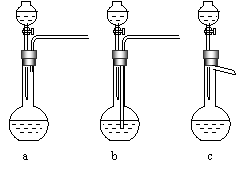
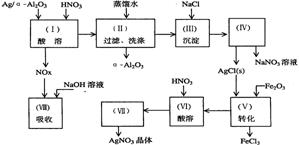
阅读上述实验流程,完成下列填空:
(1)Ag/α-Al2O3加酸溶解应该选用装置 (选填a、b、c)。
(2)在实验操作(Ⅱ),如果用自来水代替蒸馏水进行洗涤,将会发生化学反应的离子方程式
。
(3)实验操作(Ⅳ)所需玻璃仪器为 (填写三种)。
(4)实验操作(Ⅶ)从AgNO3溶液获得AgNO3晶体需要进行的实验操作依次为: (多选扣分)。
(a)蒸馏 (b)蒸发 (c)灼烧 (d)冷却结晶
(5)已知:NO+NO2+2NaOH→2NaNO2+H2O; 2NO2+2NaOH→NaNO3+NaNO2+H2O
NO和NO2的混合气体的组成可表示为NOx。该混合气体通入NaOH溶液被完全吸收时,x的值为
(a)x<1.5 (b)x=1.2 (c)X≥1.5
(6)已知Ag/α-Al2O3中Ag的质量分数,若计算Ag的回收率,还必须知道的实验数据为
和 。
(1)a (2)Ag++Cl-→AgCl↓ (3)漏斗、烧杯、玻棒
(4)b、e、d (5)c (6)催化剂的质量,AgNO3的质量
发射卫星的运载火箭,其推进剂引燃后发生剧烈反应,产生大量高温气体从火箭尾部喷出。引燃后产生的高温气体主要是CO2、H2O、N2、NO,这些气体均为无色,但在卫星发射场看到火箭喷出大量红烟,产生红烟的原因是
A.高温下N2遇空气生成NO2 B.NO遇空气生成NO2
C.CO2与NO反应生成CO和NO2 D.NO与H2O反应生成H2和NO2
1.下面是实验室制取氨气的装置和选用的试剂,其中错误的是
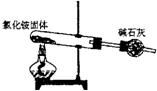


A B C D
(统编教材25)有混合气体x,它是由NO、H2、CO2组成,通入足量的Na2O2层后,变成混合气体y,将y用电火花引燃使其充分反应,只得到浓度为70%的HNO3溶液,无其他任何气体,求x中各气体体积之比。
2∶4∶7
(实验修订)25)有一硫酸与硝酸的混合溶液,取出10 mL加入足量BaCl2溶液,过滤、洗涤、烘干后得到9.32 g的沉淀;滤液与4.0 mol·L-1 NaOH溶液反应,用去35 mL碱液时恰好完全中和。试求:
(1)混合液中H2SO4、HNO3的物质的量浓度各是多少?
(2)另取10 mL原混合液,加入3.2 g铜粉共热时,在标准状况下收集到气体的体积为多少毫升?
(1)c(H2SO4)=4mol·L-1 c(HNO3)=6mol·L-1 (2)V(NO)=392mL
同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是①NO和NO2,②NO2和O2,③NH3和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列关系正确的是
A.V1>V2>V3 B.V1>V3>V2 C.V2>V3>V1 D.V3>V1>V2
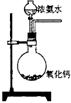
为了检验Pb(NO3)2热分解的产物,有人用示意图中的装置进行实验。(图中铁架台、铁夹和加热设备均略去)
 实验时在试管中放入研细的Pb(NO3)2晶体;实验结束后,试管中得到黄色粉末(PbO),U型管下部有少量液体X,集气瓶中收集到无色气体Y。(如图)
实验时在试管中放入研细的Pb(NO3)2晶体;实验结束后,试管中得到黄色粉末(PbO),U型管下部有少量液体X,集气瓶中收集到无色气体Y。(如图)
回答下面问题:
(1)在装置中试管和U型管上的橡皮塞最好用锡箔包住,用橡皮管连接的两玻璃管口要相互紧靠,原因是
。(2)液体X可能是 ;气体Y可能是 。
(3)导管口不再有气泡冒出时,停止反应,这时在操作上应注意 ,理由是 。
(4)用简单的实验证实(2)中的判断对X的判断②对Y的判断(要求:怎样从水槽中取出集气瓶、实验方法、现象、结论)
(1)NO2气体会损坏橡胶(2)N2O4(答液态的NO2同样给分);O2
(3)先把导气管移出水面,然后熄灭火焰;防止水槽中的水反吸到U型管中。
(4)①在通风橱中取下U型管放置,观察到U型管中液体迅速消失,管中充满红棕色气体,证明X是液态N2O4。(其他合理答案同样给分)
②在水槽,用玻璃片盖住集气瓶口,按住玻璃片,小心把集气瓶移出水面,正放在桌上,用带火星的木条插入瓶口,木条迅速燃烧,证明Y是O2
上世纪80年代后期人们逐渐认识到,NO在人体内起着多方面的重要作用。下列关于NO的说法不正确的是
A.NO分子中有极性共价键 B.NO是造成光化学烟雾的因素之一
C.NO是汽车尾气的有害成分之一 D.NO分子所含电子总数为偶数
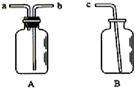 用仪器A、B和胶管组成装置收集NO(①收集仪器
用仪器A、B和胶管组成装置收集NO(①收集仪器
A已经气密性检查;②除水外不能选用其它试剂)。正确的操
作步骤是_______________________________________;
在A中加满水,盖紧瓶塞,用胶管连接b和c接口,由a导入NO
气体,水通过b和c排入B中。
我国研制的长征捆绑式火箭在第一、二级发动机中用“偏二甲(基)肼”和四氧化二氮作为液体燃料。
(1)已知偏二甲(基)肼的相对分子质量为60,其中含碳40%,含氢13.33%,其余为氮;又知其分子中有一个氮原子不与氢原子相连。通过计算写出偏二甲肼的化学式和分子结构简式:_____________________________________;
(2)在发动机中偏二甲(基)肼在四氧化二氮中充分燃烧,写出该燃烧反应的化学方程式(反应中所有的氮元素均转化为N2)。_________________________________
(1) C2H8N2
(2)C2H8N2 + 2N2O4=2CO2↑ + 4H2O↑ + 3N2↑
资料显示:“氨气可在纯氧中安静燃烧……”。某校化学小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验。
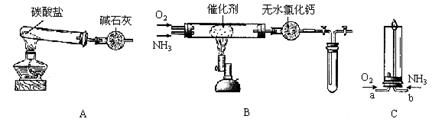
(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是__________;碱石灰的作用是___________
____________________。
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:
<1>氨催化氧化的化学方程式是___________________________________________;试管内气体变为红棕色,该反
应的化学方程式是_____________________________。
<2>停止反应后,立即关闭B中两个活塞。一段时间后,将试管浸入冰水中,试管内气体颜色变浅,请结合化学方程式说明原因__________________________________________________________________________________________
___________________________________________________________________________________________________。
(3)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气:
<1>两气体通入的先后顺序是_______________________________________________,其理由是______________
________________________________________________________________________________________________。
<2>氨气燃烧的化学方程式是_______________________________________________。
(1)<1>![]() [或
[或![]() ] <2>吸收水和二氧化碳
] <2>吸收水和二氧化碳
(2)<1>![]()
![]()
![]()
(3)<1>先通入O2,后通入NH3。若先通氨气,氨在空气中不能点燃,逸出造成污染。
<2>![]()
(新)48)农作物生长发育需要大量的氮养分,除了可用人工固氮方法(合成氨)获得氨态氮外,自然界雷电现象也是一种固氮途径,经由雷电固定的氮是硝态氮(硝酸或硝酸盐形式),其相关的化学方程式为
, ,
|
N2+O2 2NO 2NO+O2 2NO2 3NO2+H2O 2HNO3+NO
I. 合成氨工业对化学的国防工业具有重要意义。写出氨的两种重要用途
。
II. 实验室制备氨气,下列方法中适宜选用的是 。
① 固态氯化铵加热分解 ② 固体氢氧化钠中滴加浓氨水
③ 氯化铵溶液与氢氧化钠溶液共热 ④ 固态氯化铵与氢氧化钙混合加热
III. 为了在实验室利用工业原料制备少量氨气,有人设计了如下装置(图中夹持装置均已略去)。
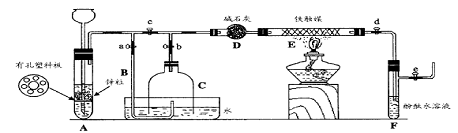
[实验操作]
① 检查实验装置的气密性后,关闭弹簧夹a、b、c、d、e。在A中加入锌粒,向长颈漏斗注入一定量稀硫酸。打开弹簧夹c、d、e,则A中有氢气发生。在F出口处收集氢气并检验其纯度。
② 关闭弹簧夹c,取下截去底部的细口瓶C,打开弹簧夹a,将氢气经导管B验纯后点燃,然后立即罩上无底细口瓶C,塞紧瓶塞,如图所示。氢气继续在瓶内燃烧,几分钟后火焰熄灭。
③ 用酒精灯加热反应管E,继续通氢气,待无底细口瓶C内水位下降到液面保持不变时,打开弹簧夹b,无底细口瓶C内气体经D进入反应管E,片刻后F中的溶液变红。
回答下列问题:
(1)检验氢气纯度的目的是 。
(2)C瓶内水位下降到液面保持不变时,A装置内发生的现象是 ,防止了实验装置中压强过大。此时再打开弹簧夹b的原因是 ,C瓶内气体的成份是 。
(3)在步骤③中,先加热铁触媒的原因是 。反应管E中发生反应的化学方程式是
。
I. 制化肥、制硝酸 II. ②④
III. (1)排除空气,保证安全
(2)锌粒与酸脱离 尽量增大氢气的浓度以提高氮气的转化率 N2 H2
(3)铁触媒在较高温度时活性增大,加快氨合成的反应速率
N2+3H2 ![]() 2NH3
2NH3
将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的体积为 L,NO2的体积为 L。
(2)待产生的气体全部释放后,向溶液加入VmL amol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为 mol·L-1。
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水 g。
(1)5.8 5.4 (2)(aV·10-3+0.5)/0.14 (3)57.8
32.(2004试测题17) 将a mol的NH3与b mol的O2混合后,充入一密闭容器,在Pt存在下升温至700℃,充分反应后,冷却至室温。
![]() (1)请讨论b∕a的取值范围及与之对应的溶液的溶质及其物质的量,将结果填于下表中:
(1)请讨论b∕a的取值范围及与之对应的溶液的溶质及其物质的量,将结果填于下表中:
| b∕a的取值范围 | 溶质 | 溶质物质的量 |
(2)当a=2.00,b=4.00,在室温下得到的产物是什么?若该产物的密度为1.44g.ml-1,则其溶质的质量分数和物质的量浓度各是多少?
(1) 4NH3+5O2=4NO+6H2O 2NO+O2=2NO2
3NO2+H2O=2HNO3+NO
| b∕a的取值范围 | 溶质 | 溶质物质的量 |
| 0<b∕a<5∕4 | NH3 | (a-4b∕5)mol |
| b∕a=5∕4 | / | / |
| 5∕4<b∕a<2 | HNO3 | (4b-5a) ∕3mol |
| b∕a≥2 | HNO3 | amol |
(2) HNO3 ω(HNO3)=(2.00×63.0∕2.00×63.0+2.00×18.0)×100%=77.8%
c(HNO3)=1000×1.44×77.8%∕63.0 mol.L-1=17.8 mol.L-1
3、据报道,科学家已成功合成了少量N4,有关N4的说法正确的是( )
A、N4是N2的同素异形体 B、N4是N2的同分异构体
C、相同质量的N4和N2所含原子个数比为1:2 D、N4的摩尔质量是56g
7、已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10)如下图,则下列判断错误的是( )
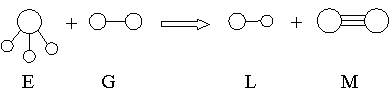

A、G是最活泼的非金属单质 B、L是极性分子
C、E能使紫色石蕊试液变蓝色 D、M化学性质活泼
26.已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如下图所示:
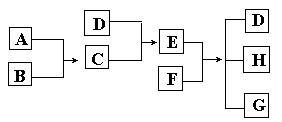
⑴ D的化学式(分子式)是_____________,E的化学式(分子式)是_____________。
⑵ A和B反应生成C的化学方程式是______________________________。
⑶ E和F反应生成D、H和G的化学方程式是___________________________________。
![]() 26.(1)NH3 NH4Cl (2)
26.(1)NH3 NH4Cl (2)
(3)
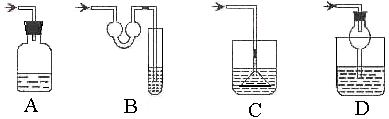
 7.下列气体的制备可采用右图装置的是
7.下列气体的制备可采用右图装置的是
A.铜与浓硝酸反应制NO2
B.铜与稀硝酸反应制NO
C.乙醇与浓硫酸反应制乙烯
D.氯化钠与浓硫酸反应制HCl
(05江苏)14.下列有关试剂的保存方法,错误的是
A 浓硝酸保存在无色玻璃试剂瓶中 B 少量的钠保存在煤油中
C 氢氧化钠溶液保存在具橡皮塞的玻璃试剂瓶中 D 新制的氯水通常保存在棕色玻璃试剂瓶中
15、对于某些离子的检验及结论一定正确的是( )
A、加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32¯
B、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42¯
C、加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+
D、加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
19、以下各种尾气吸收装置中,适合于吸收易溶性气体,而且能防止倒吸的是(BD )
29.(8分)某同学拟用氯化钙固体、碳酸钠溶液和稀硝酸等试剂,先制得碳酸钙,最终制得纯净的硝酸钙晶体。
(1)写出制取过程中反应的离子方程式: 、
(2)请帮助该同学完成下列实验操作步骤(不要求回答使用的仪器)
①用蒸馏水完全溶解CaCl2后,加入 。
②将反应后的混合物过滤,并用适量蒸馏水洗涤沉淀至无Cl-。
③加入 ,使沉淀完全溶解。 ④ ,得到纯净的硝酸钙晶体。
29.(共8分)
(1)Ca2++CO32-=CaCO3↓(2分) CaCO3+2H+==Ca2++CO2↑+H2O(2分)
(2)①碳酸钠溶液(1分) ⑧稀硝酸(1分) ④蒸发 结晶(各1分)
(05全国卷Ⅱ)13.等质量的CuO和MgO粉末分别溶于相同体积的硝酸中,得到的Cu(NO3)2和Mg(NO3)2溶液的浓度分别为amol·L-1和bmol· L-1。则a与b的关系为 ( )
A.a=b B.a=2b C.2a=b D.a=5b
17.Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为1∶1时,实际参加反应的Cu2S与HNO3的物质的量之比为
A.1∶7 B.1∶9 C.1∶5 D.2∶9
29.磷在氧气中燃烧,可能生成两种固态氧化物。3.1g的单质磷(P)在3.2g的氧气中燃烧,
至反应物耗尽,并放出X KJ热量。
⑴ 通过计算确定反应产物的组成(用化学式表示)是_______________,其相应的质量(g)为_______________。
⑵ 已知单质磷的燃烧热为Y KJ/mol,则1mol P与O2反应生成固态P2O5 的反应热△H = ________________。
⑶ 写出1mol P与O2反应生成固态P2O3 的热化学反应方程式:__________________________________________。
29.⑴ P2O3 P2O5
2.75 3.55
⑵ -(20X-Y) KJ/mol
⑶ P(s) + 3/4O2(g) == 1/2 P2O3(s);△H = -(20X-Y) KJ/mol