扬州中学2005-2006学年第一学期高三年级第二次月考
化 学 试 卷 2005.12
附:可能用到的相对原子质量 Na-23 C-12 O-16 S-32 I-127
第Ⅰ卷(选择题 共74分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1、据称2004年冬季将是自1869年人类有气象观测记录以来的四大暖冬之最。江苏气温预计较常年偏高4-6℃。这与下列各组中的两种气体在大气中的含量都有关系的是
A.SO2、CO2 B.NO2、CO C.CO2、CH4 D.NO、O3
2、(NH4)2SO4在一定条件下发生如下反应:
4(NH4)2SO4=N2↑+6NH3↑+3SO2↑+SO3↑+7H2O
将反应后的混合气体通入BaCl2溶液,产生的沉淀为
A.BaSO4 B.BaSO3 C.BaS D.BaSO4和BaSO3
3、现仅有下列仪器:烧杯、铁架台(带铁圈)、三脚架、分液漏斗、石棉网、酒精灯、玻璃棒、蒸发皿和圆底烧瓶,从缺少仪器的角度分析,不能进行的实验是 ( )
A.过滤 B.蒸发 C.升华 D.萃取
4、据最新科技报道,用10B合成的10B20有非常好的抗癌、治癌作用,下列有关说法正确的是
A.10B和10B20互为同位素 B.10B20是一种高熔点、硬度大的物质
C.10B和10B20互为同分异构体 D.10B中子数与核外电子数相同
5、已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10)如下图,则下列判断错误的是( )
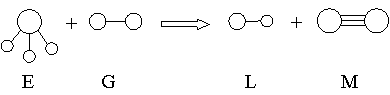
A、M化学性质活泼 B、L是极性分子
C、E能使紫色石蕊试液变蓝色 D、G是最活泼的非金属单质
6、下列说法正确的是(NA表示阿伏加德罗常数)
A.SiO2晶体中,有NA个Si就有2NA个Si-O键
B.P4分子中P和P-P键的比为2:3
C.常温常压下,1mol碳烯(:CH2)所含电子数为10NA
D.在10.6gNa2CO3固体中CO32-数目不到0.1NA
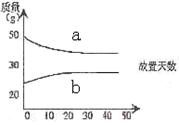 7、浓硫酸和2mol/L的稀硫酸,在实验室中敞口放置。它们的质量和放置天数的关系如右图,分析a、b曲线变化的原因是( )
7、浓硫酸和2mol/L的稀硫酸,在实验室中敞口放置。它们的质量和放置天数的关系如右图,分析a、b曲线变化的原因是( )
A、a升华、b冷凝
B、a挥发、b吸水
C、a蒸发、b潮解
D、a冷凝、b吸水
8、下列说法正确的是
A.分子晶体的熔点一定比金属的熔点低 B.在共价化合物中,各原子都能形成8电子结构
C.稀有气体的原子能形成分子晶体 D.离子化合物中一定含有金属元素
二、选择题(本题包括10小题,第9~16题每小题4分,第17、18题每小题5分,共42分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
9、水蒸气中常含有部分(H2O)2,要确定(H2O)2的存在,可采用的方法是( )
A、1L水蒸气冷凝后与足量金属钠反应,测产生氢气的体积
B、1L水蒸气通过浓硫酸后,测浓硫酸增重的质量
C、该水蒸气冷凝后,测水的pH
D、该水蒸气冷凝后,测氢氧原子比
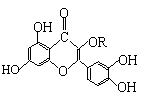 10、天然维生素P(结构如右图)存在于槐树花蕾中,它是一种营养增补剂。下列关于维生素P的叙述正确的是
10、天然维生素P(结构如右图)存在于槐树花蕾中,它是一种营养增补剂。下列关于维生素P的叙述正确的是
A.可以和溴水发生取代反应
B.属于不饱和酯类物质
C.分子中有三个苯环
D.1mol维生素P最多可以和7molH2反应
11、将0.1mol铜与40mL10mol•L-1HNO3充分反应后,溶液中含amolH+,由此可知
A.生成的气体在标准状况下的体积为4.48L
B.生成的气体在标准状况下的体积为1.49L
C.被还原的硝酸的物质的量为(0.2-a)mol
D.反应后溶液中所含的NO3-的物质的量为0.2mol
12、下列反应的离子方程式书写正确的是
A.除去KNO3溶液中的Fe3+: Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B.硝酸铝溶液中加过量氢氧化钠溶液:Al3++3OH-=Al(OH)3↓
C.硫酸铜溶液中加入氢氧化钡溶液:Ba2++SO42-=BaSO4↓
D.硫酸亚铁溶液中加入过氧化氢溶液:2Fe2++H2O2+2H+=2Fe3++2H2O
13、阿伏加德罗常数约为6.02×1023mol-1。下列叙述中正确的是
A.标准状况下,2.24L苯中约含有3.612×1023个碳原子
B.常温常压下,氧气和臭氧的混合物16g中约含有6.02×1023个氧原子
C.25℃时,1L pH=13的氢氧化钠溶液中约含有6.02×1023个氢氧根离子
D.0.5molCH4中约含有3.01×1023个电子
14、常温下,0.1mol/LHX的pH=2,0.1mol/LCH3COOH pH约为2.9,下列说法正确的是
A.HX是一种强酸
B.将0.1mol的HCl与0.1mol的HX溶于水配成1L溶液,所得溶液的C(H+)=0.11mol/L
C.等物质的量浓度等体积的HX与NaX两溶液混合,溶液中离子浓度大小关系为:
c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
D.在同体积的0.1mol/L HX和0.1mol/L CH3COOH溶液中,分别加入0.1mol/L的NaOH溶液,欲使两者pH均等于7,则消耗氢氧化钠溶液的体积前者大于后者
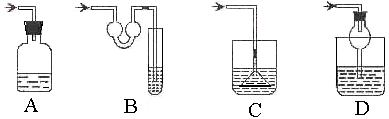
15、以下各种尾气吸收装置中,适合于吸收易溶性气体,而且能防止倒吸的是( )
16、某无色溶液与NH4HCO3作用能产生气体,此溶液中可能大量共存的离子组是( )
A.Cl-、Mg2+、H+、Zn2+、SO![]() B.Na+、Ba2+、NO3-、OH
B.Na+、Ba2+、NO3-、OH![]() 、SO
、SO![]()
C.Ag+、K+、Cl-、H+、SO![]() D.MnO
D.MnO![]() 、NO
、NO![]() 、SO
、SO![]() 、OH-、Na+
、OH-、Na+
17、一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通乙烷和氧气,电极反应式为:C2H6+18OH--14e-=2CO32-+12H2O;7H2O+7/2O2+14e-=14OH-。有关此电池的推断错误的是
A.通氧气的电极为负极 B.参加反应的O2与C2H6的物质的量之比为7∶2
![]() C.电池工作一段时间后,KOH的物质的量浓度将下降 D.在电解质溶液中CO32-向正极移动
C.电池工作一段时间后,KOH的物质的量浓度将下降 D.在电解质溶液中CO32-向正极移动
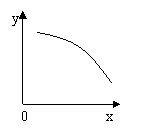 18、在一定条件下,固定容积的密闭容器中反应:2NO2(g) O2(g) + 2NO(g);ΔH>0, 达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是
18、在一定条件下,固定容积的密闭容器中反应:2NO2(g) O2(g) + 2NO(g);ΔH>0, 达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是
A、当X表示反应时间时,Y表示混合气体的密度
B、当X表示压强时,Y表示NO2的转化率
C、当X表示温度时,Y表示NO2的物质的量
D、当X表示NO2的物质的量时,Y表示O2的物质的量
第Ⅱ卷(非选择题 共76分)
三、(本题包括2小题,共20分)
19、(8分)下面是中学化学实验中常见的几种定量仪器:
a、量筒b、容量瓶c、滴定管d、托盘天平e、温度计
(1)其中标示出仪器使用温度的是_____________(填写编号);
(2)实验时用来精确量取液体体积的是__________(填写编号);
(3)使用前要检查仪器是否漏液的是____________________(填写编号);
(4)称取10.5g固体样品(1g以下使用游码)时,将样品放在了天平的右盘,则所称样品的实际质量为_______________g。
20(共12分)、下面是关于硫化氢的部分文献资料
某研究性学习小组对资料中“氢硫酸长期存放会变浑浊”这一记载十分感兴趣,为了探究其原因,他们分别做了如下实验:
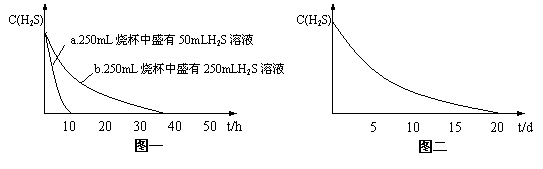
实验一:将H2S气体溶于蒸馏水制成氢硫酸饱和溶液,在空气中放置1~2天未见浑浊现象。用相同浓度的碘水去滴定氢硫酸溶液测其浓度。图一所示为两只烧杯中氢硫酸浓度随时间变化而减小的情况。
 |
实验二:密闭存放的氢硫酸,每天定时取1mL氢硫酸, 用相同浓度的碘水滴定,图二所示为氢硫酸浓度随放置天数变化的情况。
实验三:在饱和氢硫酸溶液中以极慢的速度通入空气
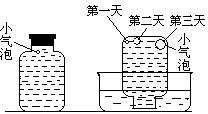 (1~2个气泡/min),数小时未见变浑浊的现象。实验四:盛满试剂瓶,密闭存放的饱和氢硫酸溶液隔2~3天观察,直到略显浑浊;当把满瓶的氢硫酸倒扣在培养皿中观察2~3天,在溶液略显浑浊的同时,瓶底仅聚集有少量的气泡,随着时间的增加,这种气泡也略有增多(大),浑浊现更明显些。
(1~2个气泡/min),数小时未见变浑浊的现象。实验四:盛满试剂瓶,密闭存放的饱和氢硫酸溶液隔2~3天观察,直到略显浑浊;当把满瓶的氢硫酸倒扣在培养皿中观察2~3天,在溶液略显浑浊的同时,瓶底仅聚集有少量的气泡,随着时间的增加,这种气泡也略有增多(大),浑浊现更明显些。
请回答下列问题:
(1)实验一(见图一)中,氢硫酸的浓度随时间变化而减小的主要因素是_______________。
(2)实验一和实验二中,碘水与氢硫酸反应的化学方程式为_______________。两个实验中准确判断碘水与氢硫酸恰好完全反应是实验成功的关键。请设计实验方案,使实验者准确掌握所加碘水恰好与氢硫酸完全反应。___________________________________。
(3) “氢硫酸长期存放会变浑浊”中,出现浑浊现象是由于生成了_______的缘故。
(4)该研究性学习小组设计实验三说明他们认为“氢硫酸长期存放会变浑浊”的假设原因之一是(用文字说明)______________________。此实验中通入空气的速度很慢的主要原因是什么?________________________________。
(5)实验四的实验现象说明“氢硫酸长期存放会变浑浊”的主要原因可能是_________。为进一步证实上述原因的准确性,你认为还应做哪些实验(只需用文字说明实验设想,不需要回答实际步骤和设计实验方案)?_____________________________________。
四、(本题包括2小题,共18分)
21、(8分)已知甲、乙、丙是前三周期元素的单质,A、B、C、D、E、F、C、X均为常见化合物;其中化合物B和X的摩尔质量相同,在一定条件下,各物质相互转化关系如下图所示:

(1)写出X的电子式和C的化学式:X ,C 。
(2) 写出B+H2O反应的化学方程式 。
(3) 工业生产上F与丙反应的压强条件是
22、(10分)下表列出了前20号元素中的某些元素性质的有关数据:
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | - |
| 最低价态 | - | - | -2 | - | -4 | -3 | -1 | - | -3 | -1 |
试回答下列问题:
(1)以上10种元素的原子中,失去核外第一个电子所需能量最少的是 (填写编号)。
 (2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式)
。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于
;若物质Na2R3是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式
。
(2)上述⑤、⑥、⑦三种元素中的某两种元素形成的化合物中,每个原子都满足最外层为8电子稳定结构的物质可能是(写分子式)
。某元素R的原子半径为1.02×10-10m,该元素在周期表中位于
;若物质Na2R3是一种含有非极性共价键的离子化合物,请你写出该化合物的电子式
。
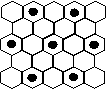
(3)元素⑤的某种单质具有平面层状结构,同一层中的原子构成许许多多的正六边形,此单质与熔融的②单质相互作用,形成某种青铜色的物质(其中的元素②用“●”表示),原子分布如图所示,该物质的化学式为 。
五、(本题包括2小题,共20分)
23、(10分)已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:
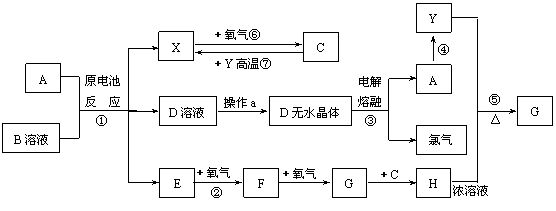 (注意:其中有些反应的条件及部分生成物被略去)
(注意:其中有些反应的条件及部分生成物被略去)
请填写下列空白:
(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为
。
(2)从D溶液制备D的无水晶体的“操作a”为 。
(3)反应②的化学方程式为 。
(4)反应⑤的化学方程式为 。
(5)原电池反应①中正极的电极反应式为 。
24、(10分)A、B、C、D四种短周期元素,原子序数依次增大,离子半径依次减小,A与C可形成原子个数比分别为1:1和1:2的两种离子化合物,A与D的原子序数之和等于B与C的原子序数之和,请回答下列问题:
(1)写出元素符号:B ,D
(2)A、C形成的离子化合物与CO2发生氧化还原反应的化学方程式:
(3)1molC的氢氧化物与1molB单质在一定条件下恰好完全反应,生成一种盐、水及一种气体,写出该反应的化学方程式:
(4)B、C形成的化合物溶于水时,溶液中所有离子的物质的量浓度由大到小的顺序为
六、(本题包括2小题,共18分)
25、(10分)为测定钢铁中硫的含量,称取0.500g试样,高温下在氧气流中燃烧,使试样中的硫全部转化为二氧化硫。将燃烧后的气体通入加有淀粉指示剂的溶液中进行吸收,并用已知浓度的碘溶液进行滴定。
(1)滴定过程中发生反应的化学方程式是
(2)若到达滴定终点时,消耗VmL浓度为amol·L-1的碘溶液,则试样中硫的质量分数的计算式(请化简)为 。
(3)为了快速测定结果,配制一定浓度的碘溶液时,要使每消耗0.1mL碘溶液相当于试样中含硫0.001%。则该碘溶液的物质的量浓度应是多少?
26、(10分)有甲、乙两个容积相等的恒容密闭容器,向甲中通入6mol A和2mol B,向乙中通入1.5molA、0.5molB和3molC,将两容器的温度恒定在770K,使反应
![]() 3A(g)+B(g) xC(g)达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,试回答下列有关问题:
3A(g)+B(g) xC(g)达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,试回答下列有关问题:
(1)若平衡时,甲、乙两容器中A的物质的量相等,则x= ,若平衡时,甲、乙两容器中A的物质的量不.相等,则x= 。
(2)平衡时,甲、乙两容器中A、B的物质的量之比是否相等 (填“相等”或“不相等”),平衡时甲中A的体积分数为 。
(3)若平衡时两容器中的压强不相等,则两容器中压强之比为 。
参考答案及评分标准
一、每小题4分,共32分
1、C 2、D 3、A 4、D 5、A 6、B 7、B 8、C
二、第9~16题每小题4分,第17、18题每小题5分,共42分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。
9、AB 10、A 11、C 12、AD 13、B 14、D 15、BD 16、A 17、AD 18、BC
三、
19、(8分,每空2分)⑴abc ⑵c ⑶bc ⑷9.5
20、(12分)(1)硫化氢的挥发(2分)
(2)H2S+I2==2HI+S↓(1分)向氢硫酸中加入淀粉液,滴加碘水到溶液刚好呈蓝色。(2分)
(3)S或硫(1分)
(4)氢硫酸被空气中氧气氧化(1分)防止因通入空气过快而使硫化氢大量挥发(2分)
(5)硫化氢自身分解(1分)确证生成的气体是氢气(2分)
四、
21、(8分,每空2分) (1)Na+[:![]() :]2-Na+, NaOH (2) 2Na2O2+2H2O
=4NaOH+O2↑
:]2-Na+, NaOH (2) 2Na2O2+2H2O
=4NaOH+O2↑
(3)常压
22、(10分,每空2分) ⑴② ⑵PCl3或CCl4 第三周期、ⅥA族 ![]() ⑶KC8
⑶KC8
|
23、(10’) (1)2Mg+CO2=2MgO+C; (2’)
(2)将D溶液在HCl气流中蒸干;(2’)
|
|
(4)⑤C+4HNO3(浓)=CO2↑+4NO2↑+2H2O (2’)
(5)2NH4++2e- = 2NH3↑+H2↑ (2’)
24、(10分)(1)F Mg(各2分)
(2)2Na202+2CO2=2Na2CO3+O2(2分)
(3)2F2+2 NaOH =2NaF+ H2O +OF2(2分)
(4)c(Na+)>c(F-)>c(OH-)>c(H+)(2分)
六、
25、(共8分)
(1)I2+SO2+ 2H2O ==H2SO4+ 2HI(2分)
(2)6.4aV%(2分)
(3)I2-SO2-S
n(I2)=n(S)=1.56X10-7mol
C(I2)= 1.56X10-3mol/L(4分)
26、(共10分)(1)2(2分) 4(2分) (2)相等(2分) 0.6(2分) (3)8:5(2分)