北京市东城区2005—2006学年度第一学期期末教学目标检测
高三化学 2006.1
有关的相对原子质量:H 1 C 12 N 14 O 16 Na 23 P 31 S 32 Cl 35.5
K 39 Fe 56
第Ⅰ卷 (选择题 共70分)
一、选择题(本题包括10小题,每小题3分,共30分,每小题只有一个选项符合题意)
1.下列各组物质的晶体,化学键类型相同,晶体类型也相同的是 ( )
A.SO2和SiO2 B.CO2和NaCl C.NH4Cl和HCl D.H2O2和C3H6
2.最近科学家发现了氧元素的一种新的粒子O4。对于这种新粒子,下列说法不正
确的是 ( )
A.它是氧元素的一种同素异形体 B.它是氧元素的一种同位素
C.它的摩尔质量为64 g · mol – 1 D.它具有很强的氧化性
3.下列物质加入水中,能使水的电离程度增大,且所得溶液显酸性的是 ( )
A.CH3COOH B.Al2(SO4)3 C.NaOH D.Na2CO3
4.下列现象或应用中,不涉及胶体性质的是 ( )
A.在饱和氯化铁溶液中逐滴加入NaOH溶液,产生红褐色沉淀
B.清晨,在茂密的树木中,常常可以看到从枝叶间透过的道道光柱
C.用半透膜分离淀粉和食盐的混合液
D.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
5.氢气是人类最理想的能源。已知在25℃、101kPa下,1 g氢气完全燃烧生成液态水时放出热量142.8 kJ,则下列热化学方程式书写正确的是 ( )
A.2H2 + O2 2H2O;△H = – 142.9 kJ/mol
B.2H2(g) + O2(g)
2H2O(l);△H = – 142.9 kJ/mol
C.2H2(g) + O2(g)
2H2O(l);△H = – 571.6 kJ/mol
D.2H2(g) + O2(g)
2H2O(l);△H = + 571.6 kJ/mol
6.下列关于铜电极的叙述中正确的是 ( )
A.铜锌原电池中铜是负极
B.用电解法精炼粗铜时粗铜作阳极
C.在铁上电镀铜时用铜作阴极
D.电解稀硫酸时用铜作阳极,阳极产物为氧气
7.目前,科学家拟合成一种“二重构造”的球形分子,即把足球型的C60分子融进Si60的分子中,外面的硅原子与里面的碳原子以共价键结合。下列说法正确的是 ( )
A.它是由两种单质组成的混合物 B.它是一种硅酸盐
C.它是一种新型化合物 D.它是一种高聚物
![]() 8.一定条件下,氨气与一氧化氮发生反应:NH3 +
NO N2
+ H2O(未配平)。在该反应中,被氧化与被还原的氮原子数之比为 ( )
8.一定条件下,氨气与一氧化氮发生反应:NH3 +
NO N2
+ H2O(未配平)。在该反应中,被氧化与被还原的氮原子数之比为 ( )
A.2 : 3 B.3 : 2 C.4 : 5 D.5 : 6
9.下列有机物中,既能发生加成反应,又能发生酯化反应,还能被新制备的Cu(OH)2悬浊液氧化的物质是 ( )
A.CH2 CH—CHO B.CH3CH2COOH
C.CH2 CH—COOCH3 D.CH2OH(CHOH)4CHO
10.下列除去杂质所用试剂或方法错误的是 ( )
A.除去Na2CO3固体中混有的少量的NaHCO3:置于坩埚中加热
B.除去苯中溶有的少量苯酚:加入适量NaOH溶液,反应后分液
C.除去乙酸乙酯中混有的少量乙酸:加入乙醇并加热
D.除去CO2中混有的少量HCl:通入饱和NaHCO3溶液中洗气
二、选择题(本题包括10小题,每小题4分,共40分,每小题只有一个选项符合题意)
11.NA代表阿伏加德罗常数,下列说法正确的是 ( )
A.常温常压下,22.4 L H2所含氢原子数目为2NA
B.1.8g NH![]() 离子所含电子数目为NA
离子所含电子数目为NA
C.58.5 g NaCl晶体中所含的氯化钠分子数目为NA
D.1 L 1 mol/L Na2CO3溶液中所含的CO![]() 离子数目为NA
离子数目为NA
12.t℃时,甲、乙两个烧杯中各盛有浓度相同、质量相等的不饱和的KCl溶液,一份蒸发掉m g水,冷却到原温度,析出a g晶体(不含结晶水);另一份蒸发掉 n g水,冷却到原温度,析出b g晶体。则t℃时KCl的溶解度是 ( )
A.![]() × 100 g B.
× 100 g B.![]() g
g
C.![]() × 100 g D.
× 100 g D.![]() × 100 g
× 100 g
13.将0.2 mol · L – 1的一元弱酸HA溶液和0.1 mol · L – 1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是( )
A.c (HA) < c (A – ) B.c (Na+) > c (A – )
C.c (Na+) = c (A – ) + c (OH – ) D.c (HA) + c (A – ) = 0.2 mol · L – 1
14.如图是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是 ( )
①X的气态氢化物与Y的最高价氧化物对应的水化物能发生反应生成盐
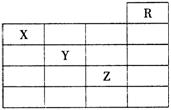 ②Y、Z的气态氢化物水溶液的酸性Y
< Z
②Y、Z的气态氢化物水溶液的酸性Y
< Z
③Z的单质在常温下是液体,可与铁粉反应
④Z的原子序数比Y大19
⑤Z所在的周期中含有32种元素
A.①②③④ B.①②③④⑤
C.只有③ D.只有①④
15.根据等电子原理,由短周期元素组成的粒子,只要其原子数相同,各原子的最外层电子数之和也相同,可互称为等电子体。等电子体之间结构相似、物理性质相近。以下各组粒子不能互称为等电子体的是 ( )
A.CO和N2 B.O3和SO2 C.CO2和N2O D.N2H4和C2H4
16.下列离子方程式中书写正确的是 ( )
A.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:Fe2+ + 2H+ + H2O2 = Fe3+
+ 2H2O
B.铁与稀硫酸反应:2Fe + 6H+ = 2Fe3+ + 3H2↑
C.向氯化铝溶液中加入过量的氨水:Al3+ +
3NH3 · H2O = Al(OH)3↓+ 3NH![]()
D.碳酸氢铵溶液中加入过量的氢氧化钠溶液:HCO![]() + OH – = CO
+ OH – = CO![]() + H2O
+ H2O
17.将一定量Fe和Fe2O3的混合物放入2 mol · L – 1的HNO3溶液25 mL中,反应完全后,无固体剩余,生成224mL NO气体(标准状况),再向反应后的溶液中加入1 mol · L – 1的NaOH溶液,要使铁元素全部沉淀下来,所加NaOH溶液的体积最少是 ( )
A.45mL B.50mL C.40mL D.无法确定
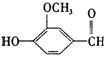 18.香兰素的结构简式如下图所示,它有宜人的气味,存在于香草豆、香脂、安息香、丁子油和香茅油中,是制作巧克力的辅助原料。下列关于香兰素的判断不正确的是
( )
18.香兰素的结构简式如下图所示,它有宜人的气味,存在于香草豆、香脂、安息香、丁子油和香茅油中,是制作巧克力的辅助原料。下列关于香兰素的判断不正确的是
( )
A.可与银氨溶液反应
B.可与氢氧化钠溶液反应
C.分子中所有原子都在同一平面上
D.可与浓溴水发生取代反应
19.用溶质的物质的量浓度均为0.1 mol · L – 1的氨水和氢氧化钠溶液,分别和等体积pH = 2的盐酸反应,当盐酸恰好被完全中和时,消耗氨水和氢氧化钠溶液的体积分别是V1和V2,则V1和V2的关系正确的是 ( )
A.V1 < V2 B.V1 = V2 C.V1 > V2 D.V1≤V2
20.有一瓶无色溶液,可能含有K+、Al3+、Mg2+、NH![]() 、Cl –、SO
、Cl –、SO![]() 、HCO
、HCO![]() 、MnO
、MnO![]() 离子中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的
( )
离子中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的
( )
A.肯定有Al3+、Mg2+、NH![]() 、Cl – B.肯定有Al3+、Mg2+、HCO
、Cl – B.肯定有Al3+、Mg2+、HCO![]()
C.肯定有K+、HCO![]() 、MnO
、MnO![]() D.肯定有Al3+、Mg2+、SO
D.肯定有Al3+、Mg2+、SO![]()
第Ⅱ卷(非选择题,共80分)
三、(本题包括2小题,共20分)
21.(8分)将1 mol I2(g)和2mol H2(g)置于某2L密闭容器中,在一定温度下发生反应:
I2(g)
+ H2(g) ![]() 2HI(g);△H < 0,并达到平衡。HI的体积分数Φ(HI)随时间变化如图中曲线(Ⅱ)所示:
2HI(g);△H < 0,并达到平衡。HI的体积分数Φ(HI)随时间变化如图中曲线(Ⅱ)所示:
(1)达平衡时,I2(g)的物质的量浓度为______mol · L – 1。
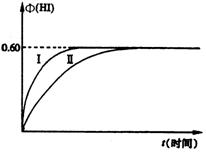 (2)若改变反应条件,在某条件下Φ(HI)的变化如曲线(I)所示,则该条件可能是________(填入下列条件的序号)。
(2)若改变反应条件,在某条件下Φ(HI)的变化如曲线(I)所示,则该条件可能是________(填入下列条件的序号)。
①恒容条件下,升高温度
②恒容条件下,降低温度
③恒温条件下,缩小反应容器体积
④恒温条件下,扩大反应容器体积
⑤恒温、恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2L密闭容器中加入a mol I2(g)、b mol H2(g)和c mol HI(g)(a、b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.60,则a、b、c应满足的关系为_________________(用一个含a、b、c的代数式表示)。
22.(12分)有A、B、C、D、E五种短周期元素,它们的原子序数依次增大。已知:A和C、B和D分别位于同主族,且B、D质子数之和是A、C质子数之和的2倍;E在同周期元素中原子半径最小。
(1)A2B和A2D的沸点较高者是 ____________(填化学式),其原因是____
_____________;
(2)由A、B、C、D四种元素形成的两种化合物相互间反应的离子方程式为_______________。
(3)A、B、C三种元素所形成的化合物的电子式为____________。
(4)用多孔的石墨电极电解滴有酚酞的C和E形成的化合物的饱和溶液。接通电源一段时间后,_________极(填电极名称)附近出现红色;另一极的电极反应式为____________,可用________________检验该极所得产物。
四、(本题包括2小题,共22分)
23.(10分)A—J是中学化学常见的物质,它们之间的转化关系如下图所示(部分产物已略去)。已知A是一种高熔点物质,D是一种红棕色固体,H的焰色反应呈黄色。
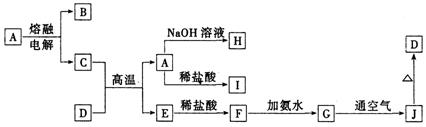
请回答下列问题:
(1)A物质的化学式为________,H物质的名称为_________________。
(2)G→J的化学方程式为_________________________________。
(3)D物质与盐酸恰好反应的离子方程式为_______________________,所得
溶液显酸性的原因是___________________(用离子方程式表示)。
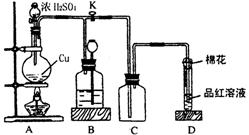 24.(12分)某化学兴趣小组为探究铜跟浓硫酸的反应,用下图所示装置进行有关实验。请回答:
24.(12分)某化学兴趣小组为探究铜跟浓硫酸的反应,用下图所示装置进行有关实验。请回答:
(1)装置A中发生的化学反应方程
式为_____________________
_________________________。
(2)装置D中试管口放置的棉花中
应浸一种液体,这种液体是
_________________________,
其作用是_________________
_____________________________________________。
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是______________________________________________________。B中应放置的液体是(填字母)_____________。
a.水 b.酸性KMnO4溶液 c.浓溴水 d.饱和NaHSO3溶液
(4)实验中,取一定质量的铜片和一定体积18 mol · L – 1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是_____________
_________________________________________________________。
②下列药品中能用来证明反应结束后的烧瓶中确有余酸的是________(填
字母)。
a.铁粉 b.BaCl2溶液 c.银粉 d.Na2CO3溶液
五、(本题包括2小题,共24分)
25.(8分)已知某有机物的结构简式为: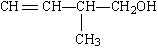
(1)该有机物中所含官能团的名称是_______________________________。
(2)该有机物发生加成聚合反应后,所得产物的结构简式为______________。
(3)写出该有机物发生消去反应的化学方程式(注明反应条件):
______________________________________________________________
26.(16分)有机化学反应因反应条件不同,可生成不同的有机产品。例如:
(1)HX + 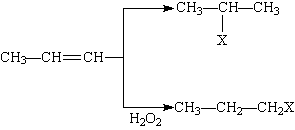 (X为卤素原子)
(X为卤素原子)
(2)苯的同系物与卤素单质混合,若在光照条件下,侧链上氢原子被卤素原子取代;若在催化剂作用下,苯环上的氢原子被菌素原子取代。
工业上利用上述信息,按下列路线合成结构简式为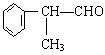 的物质,该物质是一种香料。
的物质,该物质是一种香料。
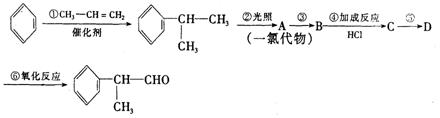
请根据上述路线,回答下列问题:
(1)A的结构简式可能为____________________________________。
(2)反应①、③、⑤的反应类型分别为________、________、_______。
(3)反应④的化学方程式为(有机物写结构简式,并注明反应条件):
_________________________________________________________。
(4)工业生产中,中间产物A须经反应③④⑤得D,而不采取直接转化为D的方法,其原因是_____________________________________________。
(5)这种香料具有多种同分异构体,其中某些物质有下列特征:①其水溶液遇FeCl3溶液呈紫色 ②分子中有苯环,且苯环上的一溴代物有两种。写出符合上述条件的物质可能的结构简式(只写两种):
____________________________________________________________。
六、(本题包括1小题,共14分)
27.(14分)现有等物质的量的NaHCO3和KHCO3的混合物a g与100 mL盐酸反应。(题中涉及的气体体积以标准状况计,填空时可以用带字母的数学工表示,不必化简。)
(1)该混合物中NaHCO3和KHCO3的质量比为_________________。
(2)如果反应后盐酸不足量,要计算生成CO2的体积,还需知道_________,
理由是_______________________________________________。
(3)若该混合物与盐酸恰好完全反应,则盐酸中HCl的物质的量浓度为多少?(请写出计算过程)
(4)若NaHCO3和KHCO3不是以等物质的量混合,则a g固体混合物与足量的盐酸完全反应时,生成CO2的体积(V)的取值范围是_______________。
化学参考答案
第Ⅰ卷(1—10题每小题3分,11—20题每小题4分,共70分)
1.D 2.B 3.B 4.A 5.C 6.B 7.C 8.A 9.D 10.C 11.B 12.A 13.B 14.A 15.D 16.C 17.C 18.C 19.B 20.D
第Ⅱ卷(共80分)
21.(共8分)(1)(2分)0.05; (2)(2分)③⑤ (3)(4分)2b – 4a = c
22.(共12分)(1)(1分)H2O;(2分)在H2O分子之间存在着氢键的作用
(2)(2分)H+ + HSO3 – = H2O + SO2↑ (3)(2分)Na+ [![]() H] –
H] –
(4)(1分)阴;(2分)2Cl – – 2e – = Cl2↑;(2分)湿润的碘化钾淀粉试纸(其他合理答案均可给分);
23.(共10分,每空2分)(1)Al2O3、偏铝酸钠
(2)4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
|
24.(共12分)(1)(2分)Cu + 2H2SO4 (浓) CuSO4 + SO2↑+ 2H2O
(2)(每空1分)碱液(其他合理答案均可给分);吸收多余的二氧化硫,防止污染空气
(3)(每空2分)试剂瓶中液面下降,长颈漏斗中液面上升;d
(4)(每空2分)①反应过程中浓硫酸被消耗,逐渐变稀,而铜不和稀硫酸反应
②a、d
25.(共8分)(1)(各2分)碳碳双键、羟基;
(2)(2分)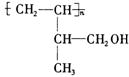
(3)(2分)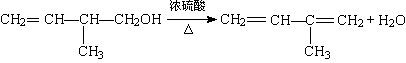
26.(共16分)
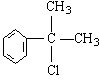
(1)(各1分)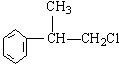 、
、
(2)(各2分)加成;消去;水解或取代
(3)(2分)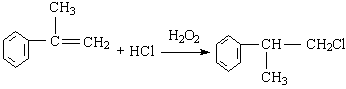
(4)(2分)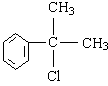 的水解产物
的水解产物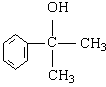 不能经氧化反应⑥而得到产品(或A中
不能经氧化反应⑥而得到产品(或A中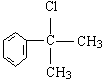 的水解产物
的水解产物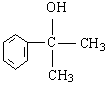 中的—OH不在链端,不能氧化成—CHO)(其他合理答案均可给分)
中的—OH不在链端,不能氧化成—CHO)(其他合理答案均可给分)
(5)(各2分)
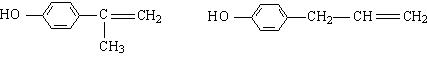
(或
![]() 或
或 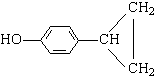 )
)
27.(共14分)(1)(2分)84:100 (2)(每空2分)盐酸中HCl的物质的量浓度;如果盐酸不足量,应该以HCl的物质的量为计算标准,则必须知道盐酸中HCl的物质的量浓度。
(3)(4分)c (HCl) =![]() mol · L – 1
mol · L – 1
(4)(4分)![]() 提示:考虑两个极限情况:全为碳酸氢钠生成的二氧化碳为22.4 a /
84 L,全为碳酸氢钾生成的二氧化碳为22.4 a / 100 L,则a g固体混合物与足量的盐酸完全反应时,生成CO2的体积(V)的取值范围是
提示:考虑两个极限情况:全为碳酸氢钠生成的二氧化碳为22.4 a /
84 L,全为碳酸氢钾生成的二氧化碳为22.4 a / 100 L,则a g固体混合物与足量的盐酸完全反应时,生成CO2的体积(V)的取值范围是![]()