上海市高三化学月考试卷(附答案)
(时间:120分钟,满分:150分)
本卷可能用到的相对原子质量:
H—1 B—10.8 C—12 O—16 S—32 Na—23 K—39 Cu—64 Ba—137 N-14
第Ⅰ卷(共66分)
一、选择题(本题共10分,每小题2分,只有一个正确选项)
1.引起现代家庭装饰室内空气质量下降的有毒物质是( )
A.一氧化碳 B.甲烷 C.甲醇 D.甲醛
2.人体内的微量元素共有20多种,这些总和虽不足人体质量的千分之一,但对机体的生理作用却不可忽视,碘元素就是其中的一种。人类日常食用的加碘盐是指在食盐中加入了( )
A.单质碘 B.碘化钾 C.碘酸钾 D.含碘有机物
3.下列物质用途错误的是( )
A.天然气用于民用燃料 B.纯酒精用作医用消毒
C.苯酚用于制杀菌剂 D.福尔马林用于浸制生物标本
4.光缆通讯能同时传输大量信息,一条光缆通路可同时容纳十亿人通话,也可以同时传送多套电视节目,是一种现代化通讯手段。制造电缆主要材料是( )
A.光导纤维 B.氧化铝陶瓷
C.合成纤维 D.天然有机高分子材料
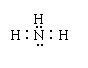 5.下列表达式中错误的是( )
5.下列表达式中错误的是( )
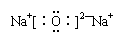 A.氨分子的电子式:
A.氨分子的电子式:
![]() B.氧化钠的电子式:
B.氧化钠的电子式:
C.氯离子的离子结构示意图 :
D.硫离子的核外电子排布式: 1s22s22p63s23p4
二、选择题(本题共36分,每小题3分,只有一个正确选项)
 6.对于右图所示装置的叙述正确的是( )
6.对于右图所示装置的叙述正确的是( )
A.Zn为正极,电极上有氢气放出
B.Cu为负极,电极上有氢气放出
C.这是一个原电池的装置,Cu为正极,Zu为负极
D.这是电解稀硫酸的装置,Cu为阳极,Zn为阴极
7.下列各组离子能在同一溶液中大量共存的是( )
A.Cu2+、K+、S2—、Cl— B.NH4+、Na+、SO42—、AlO2—
C.Na+、HCO3—、Ba2+、NO3— D.H+、Ba2+、NO3—、I—
8.为了确定某物质是否变质,所选试剂(括号内物质)达不到实验要求的是( )
A.K2SO3是否被氧化(BaCl2) B.FeSO4是否被氧化(KSCN)
C.KI是否被氧化(淀粉溶液) D.漂粉精是否变质(盐酸)
![]()
![]() 9.可逆反应:(Ⅰ)2A(g)
+ B(g) 2C(g) + Q(Q>0),(Ⅱ)3A(g) D(g) + E(g) + Q(Q<0),下列条件均能使反应(Ⅰ)、(Ⅱ)中A的转化率增大的是( )
9.可逆反应:(Ⅰ)2A(g)
+ B(g) 2C(g) + Q(Q>0),(Ⅱ)3A(g) D(g) + E(g) + Q(Q<0),下列条件均能使反应(Ⅰ)、(Ⅱ)中A的转化率增大的是( )
①增大压强 ②升高温度 ③增加A的浓度
A.仅① B.①③ C.①②③ D.都不能
10.在下列有关晶体的叙述中错误的是( )
A.离子晶体中,一定存在离子键 B.含有阳离子的晶体中,一定存在阴离子
C.原子晶体中,只存在共价键 D.稀有气体的原子能形成分子晶体
11.在25℃时,浓度均为1 mol/L 的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2(硫酸亚铁铵)三种溶液中,测得其中c(NH4+)分别为 a、b、c(mol/L),则下列判断正确的是( )
A.a>b>c B.c>a>b C.b>a>c D.a>c>b
12.“绿色化学”对化学反应提出了“原子经济性”(即节约原子)的新概念,理想的原子经济性反应是原料分子中原子全部转化在所要得到的产物中,不产生副反应,实现零排放。下列反应可能符合这一要求的是 ( )
①取代反应 ②化合反应 ③消去反应 ④加成反应 ⑤加聚反应
A.①③⑤ B.②④⑤ C.①②③ D.②③④⑤
13.在2KI + O3 + H2O→2KOH + O2↑ + I2的反应中,下列有关叙述不正确的是( )
A.O2既不是氧化产物,又不是还原产物
B.该反应的电子转移总数为2e
C.氧化产物与还原产物物质的量之比为1∶1
D.有1mol I2生成时,被还原的O3的物质的量为1mol
14.为了除去NO、NO2、N2O4对大气的污染,常采用氢氧化钠溶液进行吸收处理(反应方程式:3NO2 + 2NaOH→2NaNO3 + NO + H2O;NO2 + NO + 2NaOH→2NaNO2)。现有由a mol NO、b mol NO2、c mol N2O4组成的混合气体恰好被V L氢氧化钠溶液吸收(无气体剩余),则此氢氧化钠溶液的物质的量浓度最小为( )
A.![]() mol/L
B.
mol/L
B.![]() mol/L
mol/L
C.![]() mol/L D.
mol/L D.![]() mol/L
mol/L
15.已知氯化铁溶液中通入硫化氢可发生反应:2FeCl3+H2S→2FeCl2+S↓+2HCl。在标准状况下,向100mLFeCl3溶液中通入a L的H2S气体恰好反应后,再加入足量的铁粉充分反应。所得溶液经测定金属阳离子的浓度为3mol/L,若反应过程中溶液体积不变,则原FeCl3溶液的物质的量浓度为( )
A.1.5mol/L B.1 mol/L C.2 mol/L D.无法确定
16.下列离子方程式书写错误的是( )
A.FeCl2溶液中通入Cl2:2Fe2+ + Cl2→2Fe3+ + 2Cl—
B.AlCl3溶液中加入过量氨水:Al3+ + 4OH—→AlO2— + 2H2O
C.苯酚钠溶液中通入过量的二氧化碳:
![]() + CO2
+ H2O →
+ HCO3—
+ CO2
+ H2O →
+ HCO3—
D.FeS固体放入稀硫酸溶液中:FeS + 2H+ →Fe2+ + H2S↑
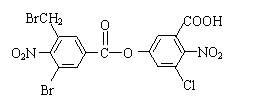 17.已知卤代烃在碱性条件下,易水解。某有机物的结构简式如下:
17.已知卤代烃在碱性条件下,易水解。某有机物的结构简式如下:
lmol该有机物与足量的NaOH溶液混合共热,充分反应最多可消耗amolNaOH,将所得溶液蒸干后再与足量的碱石灰共热,又消耗bmolNaOH,则a与b的值分别是( )
A.5mol,10mol B.6mol,2mol C.8mol,4mol D.8mol,2mol
三、选择题(本题共20分。每小题4分,每小题有一个或两个正确选项。只有一个正确选项的,多选不给分,有两个正确选项的,选对一个给2分,选错一个该小题不给分)
18.有一瓶无色气体,可能含有H2S、CO2、HBr、HCl、SO2中的一种或几种。向其中加入过量氯水,得到无色透明溶液,把溶液分成两份;向其中一份加入盐酸酸化的BaCl2溶液,出现白色沉淀;向另一份中加入硝酸酸化的AgNO3溶液,也有白色沉淀。则下列结论正确的是( )
A.原气体中肯定有SO2 B.原气体中肯定没有H2S和HBr
C.原气体中肯定有SO2和HCl D.原气体中肯定没有CO2
19.为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是( )
| 被提纯的物质 | 除杂试剂 | 分离方法 | |
| A | 溴化钠溶液(NaI) | 氯水、CCl4 | 萃取、分液 |
| B | 氯化铵溶液(FeCl3) | 氢氧化钠溶液 | 过滤 |
| C | 二氧化碳(CO) | 氧化铜粉末 | 通过灼热的CuO粉末 |
| D | 苯(苯酚) | 浓溴水 | 过滤 |
20.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.80g硝酸铵含有氮原子数为2 NA
B.常温常压下,22.4L的D2、H2组成的气体分子数为NA
C.标准状况下,2.24LSO3中含有的氧原子数为0.3 NA
D.1molNa2O2与足量CO2反应转移的电子数NA
21.有机物甲发生银镜反应,甲催化加氢还原成有机物乙,1mol乙跟足量的金属钠反应放出标准状况下氢气22.4L,据此推断乙一定不是( )
A.HOCH2CH2OH B.HOCH2CH(OH)CH3
C.CH3CH2CH2OH D.CH3CH(OH)CH(OH)CH3
22.常温时0.1mol/LHA溶液的pH > 1,0.1mol/LBOH溶液中c(OH-)∶c(H+)=1012,将两溶液等体积混合,以下判断正确的是( )
A.c(H+)< c(OH-)< c(A-)< c(B+) B.c(OH-)< c(H+)< c(B+)< c(A-)
C.c(H+)+ c(B+)= c(A-)+ c(OH-) D.c(A-)= c(B+)>c(H+)= c(OH-)
第Ⅱ卷(共84分)
四、(本题共24分)
23.(8分)H2O2是一种重要的氧化剂,亦具有还原性。下列①~④个涉及H2O2的反应(未配平、条件略)。
①Na2O2 + HCl→NaCl + H2O2
②H2O2 →H2O + O2
③Ag2O + H2O2 →Ag + O2 + H2O
④H2O2 + Cr2(SO4)3+KOH→K2CrO4+K2SO4+H2O。
据此,填写下列空白:
(1)配平上述反应④
[ ]H2O2 +[ ]Cr2(SO4)3+[ ]KOH→[ ]K2CrO4+[ ]K2SO4+[ ]H2O
当0.1mol氧化剂参加反应时,转移电子 个。
(2)H2O2仅体现还原性的反应是 (填代号),此反应中的氧化产物为 。
(3)H2O2体现弱酸性的反应是 (填代号),其理由为
。
24.(8分)含两种元素的化合物E与NH3反应,生成化合物G和H2,化合物G的相对分子质量约为81,G分子中硼元素和氢元素的质量分数分别是40%和7.4%,由此推断:
(1)化合物G的分子式为 ;
(2)反应消耗1mol E可生成4molH2,组成化合物E的元素是 和 ;又已知:1molE和2molNH3恰好完全反应,化合物E的分子式是 ;
(3)化学上把原子数和电子数均相等的微粒称为等电子体(例如CH4和NH4+为等电子体),化合物G的某种等电子体是一种常见的有机物F,F在常温下为液态,其分子中的原子都在一个平面上,则F的分子式为 ;
(4)等电子体具有相似的结构和性质,试写出G分子的结构简式: 。
25.高炉炼铁中发生的基本反应之一如下:FeO(s)+ CO(g)→Fe(s)+ CO2(g)-Q(Q>0)。(1)此反应的平衡常数表达式为;K= ;
(2)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比值 ,平衡常数K值 (填“增大”、 “减小”或“不变”。);
(3)已知1100℃时,K= 0.263,此时测得高炉中c(CO2)= 0.025mol/L,c(CO)= 0.1mol/L,在这种情况下,该反应 (填“是”或“没有”)处于化学平衡状态,此时化学反应速率是v正 v逆(填“大于”、“小于”或“等于”),其原因是 。
五、(本题共24分)
26.在实验室中拟用氧化铜、稀硫酸和锌来制取纯净的铜,甲、乙两位同学分别设计了如下实验方案:
甲:①把CuO溶于适量稀硫酸中;②在①的溶液中加入适量Zn,充分反应后过滤、烘干,即得纯净的Cu。
乙:①锌与稀H2SO4反应制H2;②将H2通入CuO中并加热,充分反应后即得纯净的Cu。
回答下列问题:
(1)若要制得相同质量的纯Cu,所消耗的锌和稀硫酸的量是:甲 乙(填“大于”、“小于”或“等于”),原因是
。
(2)丙同学认为上述两种方案所制得的Cu都难以保证Cu的纯度,应对上述两种方案加以完善。你 (填“是”或“否”)赞同丙同学的看法。
理由①(对甲同学实验而言) ,②(对乙同学实验而言) 。
(3)请你分别对甲、乙两同学的实验加以完善:
① ;
② 。
27.各地电视台的天气预报中都要预报城市的空气质量。预报中一般将城市空气中的SO2含量和可吸入颗粒的含量(可用g/cm3表示)分为8个等级。目前,测定空气中SO2含量时主要用一些氧化还原反应。
已知:SO2气体与酸性KMnO4溶液反应时,MnO4—被还原为Mn2+,SO2被氧化为SO42—。
现有药品:0.1mol/L的酸性KMnO4溶液、颗粒吸附剂、品红试纸、pH试纸。
完成下列各题:
(1)配制200mL0.1mol/L的酸性KMnO4溶液需用的仪器有 、 、玻璃棒、胶头滴管、烧杯等,玻璃棒的作用是引流和 。
(2)在测定SO2和可吸入颗粒时,首先应测定 ,原因是
。
(3)写出SO2与酸性KMnO4溶液反应的离子方程式:
;
若气体的流速为a cm3/min,当t min时,200mL0.1mol/L的酸性溶液恰好褪色,则空气中SO2的含量为 (g/cm3)。
(4)若要测定空气中可吸入颗粒的含量,需要测出的数据有
。
六、(本题共20分)
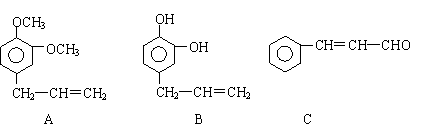 28.从某些植物树叶提取的挥发油中含有下列主要成分:
28.从某些植物树叶提取的挥发油中含有下列主要成分:
(1)写出A的分子式 。
(2)1molB与溴水充分反应,需消耗 mol单质溴。
(3)写出C在一定条件下与足量H2反应的化学方程式:
![]() 。
。
(4)已知: 写出C在强氧化剂条件下生成的有机化合物的结构简式 。
(5)写出A与B在一定条件下相互反应,生成高分子化合物的化学方程式:
。

 29.CO不仅是家用煤气的主要成分,也是重要的化工原料。美国近年来报导了一种低温低压催化工艺,把某些简单的有机物经“羰化”反应后可以最后产生一类具有优良性能的装饰性高分子涂料、粘合剂等。如下图所示:
29.CO不仅是家用煤气的主要成分,也是重要的化工原料。美国近年来报导了一种低温低压催化工艺,把某些简单的有机物经“羰化”反应后可以最后产生一类具有优良性能的装饰性高分子涂料、粘合剂等。如下图所示:
图中G(RCOOR,)的一种同分异构体是E的相邻同系物;而H的一种同分异构体则是F的相邻同系物。已知D由CO和H2按物质的量之比为1∶2完全反应而成,其氧化产物可发生银镜反应;H是含有4个碳原子的化合物。试写出:
(1)结构简式:E 、G 、R,基 。
(2)G的两个同类别同分异构体的结构简式(不带R字母)
及 。
(3)反应类型:X 、Y 、Z 。
![]()
![]() (4)写出下列转化的化学方程式:
(4)写出下列转化的化学方程式:
① A + CO + H2O E; ②F + D H
① ;
② 。
七、(本题共16分)
30.6.4 g Cu与过量硝酸(a mol / L,30mL)充分反应。硝酸的还原产物只有NO2、NO。反应后溶液中含H+为0.1mol。
(1)此时溶液中所含NO3-为 mol。
(2)求生成的气体中NO2和NO的物质的量各为多少(用含有a的式子表示)?
31.为了测定K2CO3和NaHCO3混合物的组成,某学生每次称取一定质量的混合物溶于水配成溶液,向其中加入相同浓度的Ba(OH)2溶液,每次实验均充分反应,实验结果记录如下表:
| 实验次数 | 混合物的质量/g | 所加Ba(OH)2溶液的体积/L | 测得沉淀的质量/g |
| 1 | 0.858 | 0.5 | 1.379 |
| 2 | 1.716 | 0.5 | |
| 3 | 2.574 | 0.5 | 4.137 |
| 4 | 3.432 | 0.5 | 5.516 |
| 5 | 4.290 | 0.5 | 5.516 |
| 6 | 5.148 | 0.5 | 5.516 |
请回答下列问题:
(1)第二次实验中产生沉淀的质量是 g;
(2)求所用Ba(OH)2的溶液的物质的量浓度;
(3)求混合物中K2CO3和NaHCO3的物质的量之比;
(4)在25℃时,取下第3组实验所得溶液体积的![]() ,加水配成500mL溶液,求此溶液pH(要求写出计算过程)。
,加水配成500mL溶液,求此溶液pH(要求写出计算过程)。
参考答案
一~三、
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| D | C | B | A | D | C | C | A | A | B | B |
| 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | |
| B | D | C | C | B | D | AB | C | AD | CD | AC |
四、
23.(共8分)
(1)3,1,10,2,3,8; (3分) 1.204×1023个。 (1分)
(2)③, O2。 (各1分 共2分)
(3)①,此反应中H2O2由其盐与强酸盐酸反应制得。 (各1分 共2分)
24.(共8分)
(1)B3N3H6; (2分) (2)B、H; B2H6; (各1分 共3分)
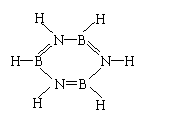 (3)C6H6;
(1分)
(3)C6H6;
(1分)
(4)
(2分)
25.(共8分)
(1)K= c(CO2)/c(CO); (2分)
(2)增大,增大; (各1分 共2分)
(3)没有;大于;c(CO2)/c(CO)<0.263,因温度不变,K值不变,为增大c(CO2)/c(CO)的值,平衡向正反应方向进行,所以v正>v逆。 (各1、1、2分 共4分)
五、
26.(共12分)
(1)小于;乙方案中氢气的作用除了作还原剂外,还需用来排尽装置中的空气和作保护气。
(各1、2分 共3分)
(2)是;甲方案制得的铜中可能混有锌,且过滤后未洗涤;乙方案制得的铜中可能混有氧化铜。(各1、2、2分 共5分)
(3)①将甲过滤所得的固体加入过量的稀硫酸,不断搅拌,至不再放出气体为止,过滤并洗涤、烘干;②将乙所得的固体加入过量的稀硫酸,不断搅拌,充分反应后过滤并洗涤、烘干。(各2分 共4分)(其他合理解释也给分)
27.(共12分)(1)200mL容量瓶、托盘天平;搅拌。(各1分 共3分)
(2)可吸入颗粒;空气中的固体尘粒容易被其它溶液吸收。(各1分 共2分)
(3)5SO2 +
2MnO4— + 2H2O→2Mn2+ + 5SO42—+ 4H+;![]() (各3、2分 共5分)
(各3、2分 共5分)
(4)吸收前和吸收后固体吸附剂和盛放仪器的质量。(2分)
六、
28.(8分)
(1)C11H14O2 (1分) (2)4 (1分)
(3)![]()
![]()
![]()
![]() (2分)
(2分)
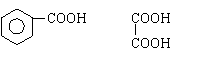
 (4)
(各1分 共2分 )
(4)
(各1分 共2分 )
(5)
(2分)
29.(共12分)
(1)E:CH2=CHCOOH;G:CH2=CHCOOCH3;R,基:—CH3。 (各1分 共3分)(2)HCOOCH2CH=CH2;CH3COOCH=CH2。 (各1分 共2分)
![]() (3)X:加成反应;Y:消去反应;Z:加聚反应。
(各1分 共3分)
(3)X:加成反应;Y:消去反应;Z:加聚反应。
(各1分 共3分)
![]() (4)①HC≡CH + CO + H2
H2C=CHCOOH (各2分
共4分)
(4)①HC≡CH + CO + H2
H2C=CHCOOH (各2分
共4分)
②C H3CH2COOH + CH3OH CH3CH2COOCH3 +H2O
七、
30.(共5分)(1)0.3(2分)
(2)(3分) 设生成气体中NO2、NO的物质的量分别为X mol、Y mol
X=(0.045a-0.55)mol; Y=(0.25-0.015a)mol。
(其他合理解法也给分)
31.(共11分)(1)2.758 (2分)
(2)以第四组数据计算,此时样品混合物过量,
则:Ba(OH)2 ~ Ba2+ ~ BaCO3
c[Ba(OH)2]=![]() mol/L
(2分)
mol/L
(2分)
(3)以第一组数据计算,设样品混合物中NaHCO3和K2CO3的物质的量分别为x mol和y mol
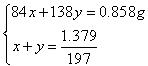
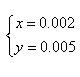
即n(K2CO3)∶n(NaHCO3) = 5∶2 (3分)
(4)设第3次实验中固体混合物中含NaHCO3 x′mol,则含K2CO3 2.5 x′mol
84x′+ 138×2.5 x′= 2.574 x′= 0.006 mol
0.5LBa(OH)2溶液中含OH—:0.056×0.5×2 = 0.056 mol
由:HCO3—+ OH—→CO32— + H2O OH—过量:0.056—0.00 6 = 0.05 mol
∴![]() (4分)
(4分)