高考化学冲刺训练(8)
1.下列有关环境、健康、发展的叙述中,不正确的是
A.可吸入颗粒(例如硅酸盐粉尘)形成气溶胶,对人类健康危害极大
B.开发利用绿色能源(例如太阳能)替代化石燃料是人类可持续发展的必由之路
C.装修材料中的苯主要来自胶、漆等,是强致癌物
D.氟氯烃含量是空气质量报告的主要项目之一
2.在101kPa和25℃时,有反应的热化学方程式:H2(g)+1/2O2(g)=H2O(g);△H=-241.8kJ/mol,H2(g)+1/2O2(g)=H2O(l);△H=-285.8 kJ/mol。下列说法中错误的是
A.H2燃烧生成1 mol H2O(g)时,放出241.8 kJ的热量
B.H2的燃烧热为285.8 kJ
C.O2前面的1/2表示参加反应的O2的物质的量
D.1 mol液态水变成水蒸气时吸收44 kJ的热量
3.下列事实能说明醋酸是弱电解质的是
①醋酸与水能以任意比互溶 ②醋酸溶液能导电
③醋酸溶液中存在醋酸分子 ④0.1 mol/L醋酸的pH比0.1 mol/L盐酸pH大
⑤醋酸能和碳酸钙反应放出CO2 ⑥0.1 mol/L醋酸钠溶液pH=8.9
⑦大小相同的锌粒与相同物质的量浓度的盐酸和醋酸反应,醋酸产生H2速率慢
A.②⑥⑦ B.③④⑥⑦ C.③④⑤⑥ D.①②
4.下列各选项所述的两个量,前者一定大于后者的是
① F2和Br2的沸点 ②纯水在25℃和80℃时的pH值
③同温下分别在100g水中最多能溶解的无水CuSO5和CuSO5·5H2O的质量
④25℃时,等体积的pH值都等于3的盐酸和AlCl3溶液中,已电离的水分子数
⑤在NH3+NO→N2+H2O反应中,被氧化和被还原的N原子数
⑥耐火材料MgO和CaO的熔点
⑦H-和H+离子半径
⑧金刚石晶体和石墨晶体中,每个最小碳环里所含的实际碳原子数
A ①②⑥ B ①②③⑤ C ⑤⑥⑦ D ②⑦⑥
5.设NA代表阿佛加德罗常数,下列说法中正确的是
①常温常压下,17g甲基(—14CH3)所含的中子数为9NA
②常温常压22.4L NO气体的分子数小于NA
③64g的铜发生氧化还原反应,一定失去2NA个电子
④常温常压下,100mL 0.5mol/L 的乙酸溶液中,乙酸的分子数目小于0.05NA
⑤标况时,22.4L二氯甲烷所含有的分子数为4NA
⑥常温常压下,1mol氦气含有的核外电子数为4NA
A.①② B.③④ C.②④ D.⑤⑥
6.化学用语是学习化学的重要工具。下列用来表示物质变化的化学用语中,错误的是
A.钢铁腐蚀时可能发生的正极反应:2H2O + O2 + 4e-== 4OH一
B.明矾水解的离子方程式:Al3+ + 3H2O![]() Al(OH)3 + 3H+
Al(OH)3 + 3H+
C.向KHSO4溶液中滴人Ba(OH)2溶液使pH=7 : SO42-+H++Ba2++OH-=BaSO4↓+H2O
D.1L 0.5mol·L-1稀硫酸与1L 1mol·L-1氢氧化钠溶液反应放出57.3kJ的热: H2SO4(aq)+2NaOH(aq) === Na2SO4(aq)+2H2O(1);ΔH=-57.3kJ/mol
7.室温下,由水电离得到的c(H+)和c(OH—)的乘积为1×10-24的无色溶液中,可能大量共存的离子组是
A.Na+、Fe2+、Br-、Cl- B.AlO2-、K+、NH4+、Na+
C.K+、I-、NO3-、H+ D.K+、S2-、CO32-、OH-
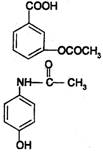
8.在一定条件下,下列药物的主要成分都能发生①取代②加成③水解④中和 四种反应的是
|
|
A.维生素 B.阿司匹林
C.芬必得 D.扑热息痛
9.下列说法中,正确的是
A.Al能与强碱溶液反应,与其同主族的Tl(铊)也能与强碱溶液反应
B.第二周期非金属元素气态氢化物分子间都能形成氢键
C.同温度同物质的量浓度的碳酸钠溶液的pH小于硅酸钠溶液
D.AlCl3晶体的熔点低于MgCl2晶体的熔点
10.恒温下,容积均为2L的密闭容器M、N中,分别有以下列两种起始投料建立的可逆反应3A(g)+2B(g)![]() 2C(g)+xD(s)的化学平衡状态,相关数据如下:M:3 mol A 2 mol
B;2 min达平衡,生成D 1.2 mol,测得从反应开始到平衡C的速率为0.3
mol/(L·min)。N:2 mol C y mol D;达平衡时c(A)=0.6 mol/L。下列推断的结论中不正确的是
2C(g)+xD(s)的化学平衡状态,相关数据如下:M:3 mol A 2 mol
B;2 min达平衡,生成D 1.2 mol,测得从反应开始到平衡C的速率为0.3
mol/(L·min)。N:2 mol C y mol D;达平衡时c(A)=0.6 mol/L。下列推断的结论中不正确的是
A.x=2 B.平衡时M中c(A)<0.6 mol/L C.y>0.8 D.y<0.8
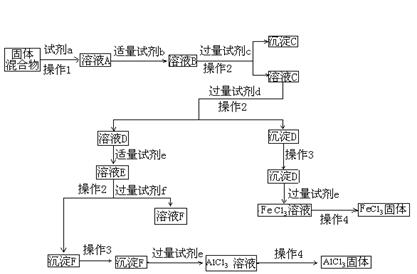 11.固体AlCl3和FeCl3混合物中含有少量FeCl2和Al2(SO4)3。某同学设计如下实验进行分离,以分别得到纯净的AlCl3和FeCl3固体。
11.固体AlCl3和FeCl3混合物中含有少量FeCl2和Al2(SO4)3。某同学设计如下实验进行分离,以分别得到纯净的AlCl3和FeCl3固体。
回答下列问题:
(1) 写出下列试剂的名称:试剂c___________, 试剂d__________,试剂f ,
(2) 操作3是 ,具体操作是 ;
操作4是 ,操作时应注意的问题是
;
(3) 加入试剂b的目的是_________________________________________ ,判断试剂b适量的方法是___________________________________________________。
(4) 由溶液D转变成溶液E的操作中,判断加入的试剂e适量的依据是_______________________________________________________________。
(5) 溶液E中的溶质有:_________________________________。其中杂质是否要另加试剂除去__________(填“是”或“否”),原因是______________________________;
(6) 有同学认为上述实验中最后得到AlCl3和FeCl3固体的步骤不科学,他的理由是:___________________________________________________________________。
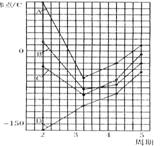 12.Ⅰ右图中A、B、C、D四条曲线是表示
12.Ⅰ右图中A、B、C、D四条曲线是表示
ⅣA、ⅤA、ⅥA、ⅦA族元素的气态氢化物的沸点变化曲线,其中A、D 分别表示______ 、_______族元素气态氢化物的沸点变化;同一族中第3、4、5周期元素的气态氢化物沸点依次升高,其原因是 ;
图中第2周期有三种元素的气态氢化物沸点显著高于相应的同族第3周期元素气态氢化物的沸点,其原因是___________________ ___.
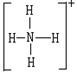
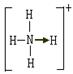 Ⅱ.已知氨分子内键与键的夹角约为107º18’。从反应NH3 +H+→NH4+可知:NH4+中有一根键比较特殊,其结构可表示为A式。但是,虽然有一根键形成过程与众不同,而其结果是完全相同的,都是N、H原子间共用一对电子,键与键的夹角均为109º28’。故NH4+的结构也可表示为B式。
Ⅱ.已知氨分子内键与键的夹角约为107º18’。从反应NH3 +H+→NH4+可知:NH4+中有一根键比较特殊,其结构可表示为A式。但是,虽然有一根键形成过程与众不同,而其结果是完全相同的,都是N、H原子间共用一对电子,键与键的夹角均为109º28’。故NH4+的结构也可表示为B式。
A式 B式
(1)还有一些你熟悉的分子或离子中,也存在上述特殊共价键,如:H3O+, 等。(在下列微粒中选择两种填空:[Ag(NH3)2]+,PCl5,Fe(SCN)3,NH3·H2O)
(2)写出H3O+的电子式 ;
你认为H3O+中键与键的夹角与下列哪个角度最接近?
A.120º B.109º28’ C.107º18’ D.60º
(3)氮化硼(BN)是一种新型无机非金属材料,它有两种晶型:金刚石晶型和石墨晶型。其中,金刚石晶型的氮化硼材料具有硬度大、熔点高等特性,它的结构中也含有上述特殊共价键。则:在金刚石晶型的氮化硼中,每个硼原子与 个氮原子以B─N键连接,原子间相互连接的最小的环上有 个氮原子和 个硼原子。
13.根据下图所示转化顺序及实验现象回答问题。已知D、G焰色反应为紫色(隔蓝色钴玻璃),A、E含有同种阴离子。C、F为同主族单质,其它与反应无关的物质已略去。
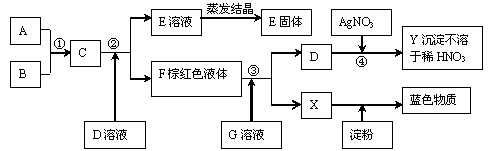 |
(1)写出A~Y各是什么物质(填化学式)
A、 B、 D、 F、 G、 ;
(2)写出①、③对应的离子方程式:
① ③ 。
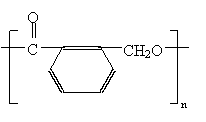
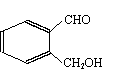 14.某有化合物的结构简式如图所示,回答下列各题:
14.某有化合物的结构简式如图所示,回答下列各题:
(1)该有机物不能发生的化学反应类型是:_____________
A. 加成反应 B. 取代反应 C. 消去反应 D. 氧化反应
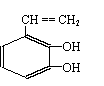
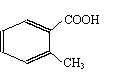
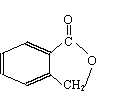
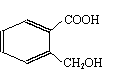 (2) )该有机物有多种同分异构体,下列结构的有机物不是它的同分异构体的是:___________
(2) )该有机物有多种同分异构体,下列结构的有机物不是它的同分异构体的是:___________
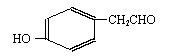
A. B. C. D.
(3) (2)中 选项B的结构简式中共平面的原子最多有:____________
A. 12 B.14 C.16 D.18
(4) )该有机物和新制Cu(OH)2加热煮沸得到的有机物的结构简式如(2)中选项A的结构简式所示,这个有机物可形成多种酯类物质,试写出满足下列要求的有机物的结构简式:
①分子内酯化所得有机物的结构简式:______________________
②形成聚酯类高分子化合物的结构简式:____________________
③两分子酯化形成的有机物的结构简式:____________________
15.(8分)用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路是成熟的传统工艺。化学原理为:2FeCl3+Cu= 2FeCl2+CuCl2。化学兴趣小组的甲、乙、丙三同学为分析某上述厂家的一些技术数据及所得混合溶液(记为A)的组成,各取A 50.0 mL,进行了如下探究。结果如下:
甲:向50.0 mLA中加入足量的AgNO3溶液,析出沉淀86.1 g。
乙:向50.0 mLA中试探性加入1.40 g铁粉,结果全部溶解且未见固体析出。
丙:向50.0 mLA中加入20.0 mL稀硝酸,产生0.448 L NO(标准状况)
(1)该厂所使用的FeCl3溶液的物质的量浓度(反应前后溶液的体积忽略不计)。
(2)A中c(Cu2+)的取值范围。
(3)若向乙同学实验后的溶液中加入足量的稀硝酸,结果生成1.12 L NO(标准状况),试计算A中Cu2+的物质的量浓度。
高考化学冲刺训练(3)
1.D 2.B 3.B 4.D 5.C 6.CD 7.D 8.BD 9.CD 10.BD
11. (14分,每空1分)氯化钡溶液 氢氧化钠溶液 氨水
(1) 洗涤沉淀 向过滤器中注入蒸馏水至浸没沉淀,用玻璃棒轻轻搅拌,至水流尽.重复数次 蒸发溶液 边加热边搅拌,至出现较多的晶体时停止加热.
(2) 使Fe2+氧化为Fe3+ 取少量溶液B,向其中滴加酸性高锰酸钾溶液,看是否褪色,若不褪色,则说明已适量
(3) 生成的沉淀刚好溶解
(4) AlCl3 BaCl2 NaCl 否 在E中加入氨水后过滤,杂质自然分离
(5) 未在酸性氛围中蒸发 AlCl3、 FeCl3会部分水解而得不到纯净的AlCl3 、FeCl3固体
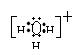 12.(12分)(1)[Ag(NH3)2]+, Fe(SCN)3
12.(12分)(1)[Ag(NH3)2]+, Fe(SCN)3
(2) C
(3)4 ,3, 3
13.(1)A、HCl B、KMnO4或KClO3 D、KBr F、Br2 G、KI(每空1分)
(2)①10Cl-+16H++2MnO4-=2Mn2++5Cl2↑+8H2O
②Br2+2I-=2Br-+I2(每空2分)
14、(12分,每空2分) (1) C (2分) (2) A (2分) (3) C (2分)
 (4)
(4)
① (2分)② (2分)
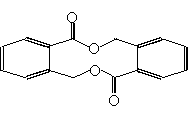
③ (2分)
15、(10分)(1) c(FeCl3)=4mol/L。(2) 0.6mol/L≤c(Cu2+)≤1.5mol/L。(3) c(Cu2+)=0.75mol/L