高考化学冲刺训练(9)
1.诺贝尔奖评委会介绍说,2005年诺贝尔化学奖——“烯烃复分解反应”是朝着‘绿色化学’方向前进的一大步”。因为应用该成果一方面提高了化工生产中的产量和效率,同时减少了副产品;另一方面其副产品主要是乙烯,而乙烯是可以再利用的。下列关于乙烯及其产品的有关叙述不正确的是:
A.乙烯是制造塑料、合成乙醇、乙醛、合成纤维等重要原料
B.聚乙烯是当今世界用量最多的一种塑料
C.由于乙烯存在双键,化学性质活泼,因此,能与氯气取代生成二氯乙烷。
D.碳-碳双键的键能与碳-碳单键相比要高得多,因此要切断前者并使其按照希望的方式重新结合,则需要更高的能量,所以反应条件往往使用催化剂。
2.某有机物X(C4H6O5)广泛存在于许多水果中,尤以苹果、葡萄、西瓜、山楂内为多,经测试,该化合物具有如下性质:①l mol X与足量的金属钠反应产生1.5 mol H2
②X与醇(ROH)或羧酸(RCOOH)在浓H2SO4和加热条件下均可反应生成有香味的产物
③X在一定条件下的分子内脱水产物(不是环状化合物)可和溴水发生加成反应
根据上述信息,下列对X的结构的判断正确的是
A.X分子中肯定有碳碳双键 B.X分子中可能有三个羟基和一个-COOR官能团
C.X分子中可能有三个羧基 D.X分子中可能有一个羟基二个羧基
3. 已知1L溶液中已电离的水是10-3moL,则此溶液中可能大量存在的离子组是
①Na+、K+、NO3-、SO42- ②CO32-、Cl-、Na+、K+ ③NO3-、Cu2+、K+、Cl-
④NO3-、NH4+、SO42-、K+ ⑤Fe3+、Cl-、SO32-、NO3- ⑥S2-、K+、Cl-、ClO-
A.除①外,均可以 B.① C. ②③⑤⑥ D.②③④
 4. 足量的铝粉分别和等体积pH=12的氢氧化钠溶液以及pH=2的某酸溶液反应,放出氢气的体积分别为V1、V2,则在相同状况下,V1、V2的关系可能是
4. 足量的铝粉分别和等体积pH=12的氢氧化钠溶液以及pH=2的某酸溶液反应,放出氢气的体积分别为V1、V2,则在相同状况下,V1、V2的关系可能是
A. V1<V2 B. V1=3V2 C. V1>V2 D.上述三种情况都有可能
5.在硫酸工业生产中,SO3的吸收过程是在吸收塔(如右图)中进行的,
吸收塔里还装入了大量瓷环。下列有关SO3说法中,不正确的是
A.从①处通入SO3,整个吸收操作采取逆流的形式
B.从②处喷下98.3%的硫酸,瓷环的作用是增大接触面积
C.从③处导出的气体只含有少量SO2,可直接排入大气
D.从④处流出的是可用水或稀硫酸稀释的硫酸
6.下列离子方程式书写正确的是
A 等体积的氯气和二氧化硫同时通入一定量水中:Cl2+SO2+2H2O==4H+ +2Cl- +SO42-
B 过量二氧化碳通入偏铝酸钠溶液中 CO2+2H2O+AlO![]() ==Al(OH)3↓+HCO
==Al(OH)3↓+HCO![]()
C 在溶液中亚硫酸氢铵与等物质的量氢氧化钠混合 NH![]() +HSO
+HSO![]() +2OH-==SO
+2OH-==SO![]() +NH3↑+2H2O
+NH3↑+2H2O
D 碳酸氢镁溶液中加入过量石灰水 Mg2++2HCO![]() +Ca2++2OH-==CaCO3↓+2H2O+MgCO3↓
+Ca2++2OH-==CaCO3↓+2H2O+MgCO3↓
7.下列各组物质中,不是按![]() (“→”表示一步完成)关系相互转化的是
(“→”表示一步完成)关系相互转化的是
| 选项 | A | B | C | D |
| a | Fe | CH2=CH2 | Al(OH)3 | HNO3 |
| b | FeCl3 | CH3CH2Br | NaAlO2 | NO |
| c | FeCl2 | CH3CH2OH | Al2O3 | NO2 |
8.500ml KNO3和Cu(NO3)2 的混合溶液中C(NO3—)=6.0mol·L-1 ,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标况下),假定电解后溶液体积仍为500mL,下列说法正确的是
A.原混合溶液中C(K+)为2mol·L-1 B.上述电解过程中共转移4mol电子
C.电解得到的Cu的物质的量为0.5mol D.电解后溶液中C(H+)为2mol·L-1
9.短周期元素A、B、C,原子序数依次递增。已知:A、C同主族,而且三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半。下列叙述正确的是
A.原子半径:A<B<C
B.2.32g四氧化三铁与足量的B完全反应转移0.09mol电子
C.常温下B的硫酸盐溶液pH<7
D.等质量B单质分别与足量A、C单质反应时前者反应放出的热量多
![]() 10.一定条件下,建立平衡2NO2
(g) N2O4(g),以下说法正确的是
10.一定条件下,建立平衡2NO2
(g) N2O4(g),以下说法正确的是
A.恒温恒容,再充入NO2,达到新平衡时,NO2的体积分数增大
B.恒温恒容,再充入N2,达到新平衡时,容器内颜色变浅
C.恒温恒压,再充入N2O4,达到新平衡时,混合气体的平均相对分子质量增大
D.恒温恒压,再充入Ar,达到新平衡时,NO2的转化率降低
11.摩尔盐[(NH4)2SO4·FeSO4·6H2O]在空气中比一般亚铁盐稳定,是分析化学中常见的还原剂。某研究性学习小组设计了下面的实验装置来制备摩尔盐。实验步骤:
(1)把30%NaOH溶液和废铁屑混合、煮沸、冷却,将洗涤铁屑后的NaOH溶液装入F中。
(2)在E中用处理过的Fe屑和稀H2SO4反应制取FeSO4。
(3)将硫酸亚铁溶液与硫酸铵溶液混合,结晶得摩尔盐。
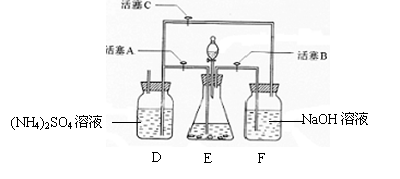
试回答下列问题:
(1)F中的NaOH溶液的主要作用是
(2)Fe屑和稀H2SO4反应产生的氢气可赶走装置中的氧气及(NH4)2SO4溶液中的溶解氧,操作时应先关闭活塞 ,并同时打开活塞 。
请写出Fe屑和稀H2SO4反应产生的氢气的另外一个作用
(3)使摩尔盐结晶可采取两种方法:①蒸发溶液、再自然冷却结晶;②不蒸发溶液、直接自然冷却结晶。你认为较好的方法是 。(填序号)
(4)原料利用率高,副产品少,产生的有害废物少,保护环境是“绿色化学”的主要内涵。
请写出此实验中能体现“绿色化学”的具体做法(至少写出两点):
、 。
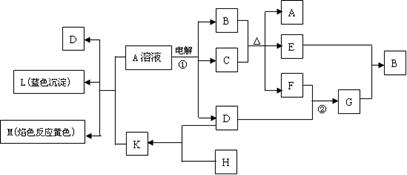
|
(1)G的化学式为___________________,K的电子式为_____________________。
(2) 反应①的离子方程式____________________________________________。
(3) 反应②工业上称F为接触氧化反应,根据化学平衡理论和下表F转化率的实验数据,考虑综合经济效益,你认为提高F转化率工业上应采取的反应条件及有效措施是
_______________________________________________________ 。
| 0.1 MPa | 0.5 MPa | 1 MPa | 10 MPa | |
| 400 ℃ | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 ℃ | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 ℃ | 73.7 | 85.8 | 89.5 | 96.4 |
![]() 13.2005年诺贝尔化学奖授予在烯烃复分解反应研究方面有突出贡献的三位科学家。他们研究发现,两分子烯烃在苯中用一特殊催化剂处理时生成两种新烯烃,如:
13.2005年诺贝尔化学奖授予在烯烃复分解反应研究方面有突出贡献的三位科学家。他们研究发现,两分子烯烃在苯中用一特殊催化剂处理时生成两种新烯烃,如:
![]() 。请回答:
。请回答:
⑴ 对上述反应提出了两种反应机理(虚竖线表示断键位置):
若机理a是:
 | |||
则机理b是:
⑵ 根据课本学过的知识回答:采用何种方法能证明反应机理是a还是b?答:__________________________________________________________________________________________________________________________________________________________________________________________________。
⑶若两分子CH3CH=CHCH2CH3发生复分解反应,则所得新烯烃的结构简式可能为__________________________________________________。
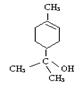
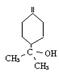
14.(10分)键线式是有机物结构的又一表示方法,如图I所表示物质的键线式可表示为图II所示形式。松节油的分馏产物之一A的结构可表示为图III。
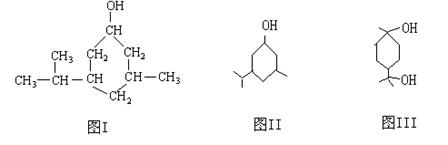
(1) 写出A的分子式___________________
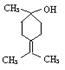
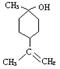
(2) A在浓H2SO4的作用下加热,每一分子A可失去一分子水得不饱和化合物B。写出B可能的结构简式___________________________________________________________________
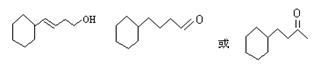
(3) C是B的同分异构体。其分子里也有一个六元碳环,其碳环上的碳原子均是饱和的。如果C分子中六元环上只有一个取代基,则C具有多种结构,请写出其中的两种结构(必须是不同类别的物质,用键线式表示)
___________________________、____________________________________.
15.(12分)为测定一种复合氧化物型的磁性粉末材料的组成,称取10 g样品,将其全部溶于足量稀盐酸后,逐滴加入NaOH溶液,先产生一种红褐色沉淀,在pH约为4时红褐色沉淀不再增多,过滤、洗涤、干燥得到12.84 g沉淀;在滤液(含洗涤液)中继续加入NaOH溶液至过量,过滤、洗涤、干燥又得到0.58 g白色沉淀,将白色沉淀灼烧到高温(化合价不变)得到0.4 g白色固体。
⑴红褐色沉淀是 ,约 mol。
⑵通过计算确定最后得到的0.4 g白色固体的成分及其物质的量。
⑶通过计算确定该复合氧化物型的磁性粉末材料的组成。
参考答案
1.A 2.D 3.D 4.D 5.AB 6.AB 7.C 8.AB 9.CD 10.D
11.(12分)
(1)除去混在氢气中的酸性气体(2分)
(2)A B、C (各1分,共2分)
将E中的产生的硫酸亚铁溶液压入D中(2分)
(3)②(2分)
(4)用氢氧化钠溶液除去混在氢气中的酸性气体;氢氧化钠溶液重复使用;用氢气驱赶氧气,防止亚铁盐被氧化;等其它合理答案(每空2分,共4分)
12.(1)SO3 (4分)
(2) 2Cu2+ +2H2O 2Cu↓ +O2 ↑+4H+ (4分)
(3) 常压,催化剂,400-500oC,并冷却反应后生成的气体 (2分)
13.⑴
⑵利用同位素原子示踪法。利用含重氢的烯烃RCD=CHR′进行反应,若产物为
RCD=CHR和R′CD=CHR′,证明反应机理是a;若产物为RCD=CDR和
R′CH=CHR′,证明反应机理是b。
⑶CH3CH=CHCH3 和CH3CH2CH=CHCH2CH3
14.(10分,(1)、(3)小题每个答案2分,(2)小题每个答案1分))
(1)  C10H20O2
C10H20O2
(2) 
(3)
![]()
15.(12分)⑴Fe(OH)3 0.12 (4分)
⑵设白色沉淀的化学式为M(OH)x,设M的相对原子质量为y,则
2M(OH)x → M2Ox + xH2O
2y+16x 18x
0.58 g 0.4 g
(2y+16x)/0.58 g=18x/0.4 g 化简得y=12x 讨论当x=2时,y=24有解
白色固体为MgO,0.01 mol (4分)
⑶12.84 g红褐色沉淀完全分解后得到9.6 gFe2O3,0.06 mol。MgO与Fe2O3质量之和正好等于样品质量。所以样品化学式为MgO·6Fe2O3。 (4分)