2006届(高三)梅陇中学——(2)
化学试题
相对原子质量:H : 1 C : 12 O : 16 Na : 23 K : 39 Cu : 64 Ba 137 Cr.52
第Ⅰ部分(67分)
(一)选择题(本题包括9小题,每小题3分,共27分,每小题只有一个选项符合题意
1.下列有关叙述正确的是 ( )
A.电解质的导电性和金属晶体的导电性都随温度的升高而降低
B.“加碘食盐”“高钙牛奶”“含氟牙膏”“富硒营养品”等等,这里的碘、钙、氟、硒指的是分子
C.“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高
D.在![]() (g)
(g)![]()
![]() (△H>0)可逆反应中,升温或加入催化剂均可使上述平衡向右移动.
(△H>0)可逆反应中,升温或加入催化剂均可使上述平衡向右移动.
2.下列保存物质的方法正确的是 ( )
A.氢氟酸保存在玻璃瓶中
B.氯水应保存在棕色的细口瓶中
C.NaOH溶液存放在配有磨口玻璃塞的棕色玻璃瓶中
D.金属锂应保存在煤油中防止被氧化
3.下列关于胶体的认识错误的是 ( )
A.鸡蛋清溶液中加入饱和(NH4)2SO4溶液生成白色沉淀,属于物理变化
B.将一束强光通过淀粉溶液,也能产生丁达尔现象
C.水泥厂、冶金厂常用高压电除去烟尘,是因为烟尘微粒带电荷
D.纳米材料微粒直径一般从几纳米到几十纳米(1nm=10-9m),因此纳米材料属于胶体
4.下列物质晶体中,同时存在极性键、非极性键和氢键的是 ( )
A.SO3 B.H2O C.C2H5OH D.C2H6
5.现有三组混合液:①乙酸乙酯和乙酸钠溶液 ②乙醇和丁醇 ⑧溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是 ( )
A 分液、萃取、蒸馏 B 萃取、蒸馏、分液
C 分液、蒸馏、萃取 D 蒸馏、萃取、分液
6.下列说法正确的是 ( )
A.全部由非金属元素形成的化合物中只含有共价键
B.分子晶体的熔点较低,分子晶体中都含有化学键
C.正四面体构型的分子,键角都是109°28′
D.不同原子的化学性质可能相同
| |
A.CH3COO- B.SO32- C.CO32- D.HCO3-
8.下列实验方案合理的是 ( )
A.用湿润的pH试纸测定某盐溶液的pH
B.用稀硫酸清洗长期存放氯化铁溶液的试剂瓶内壁所附着的不溶物
C.用加热法分离I2和NH4Cl的混合物
D.为了更快得到氢气,可以用纯锌代替粗锌与稀硫酸反应
9.2003年10月15日我国成功发射了第一艘载人航天飞船——“神州五号”。从此我国进入了航天大国和航天强国行列。发射“神五”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。已知:N2(g) + 2O2(g) = 2NO2(g);△H = + 67.7kJ/mol。
N2H4(g) + O2(g) = N2(g) + 2H2O(g);△H = – 534kJ/mol。下列关于肼和NO2反应的热化学方程式中,正确的是 ( )
A.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(l);△H = – 1135.7kJ/mol
B.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H = – 1000.3kJ/mol
C.N2H4(g) + NO2(g) = 3/2N2(g) + 2H2O(l);△H = – 1135.7kJ/mol
D.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H = – 1135.7kJ/mol。
二、选择题(本题包括10小题,每小题4分,共40分,每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分)
10.已知I-、Fe2+、SO2、Cl-和H2O2均具有还原性,它们在酸性溶液中还原性的强弱顺序是Cl-< Fe2+<H2O2< I-<SO2 ,则下列反应中不能发生的是 ( )
A、2Fe3++SO2+2H2O 2Fe2++SO42-+4H+
B、SO2+I2+2H2O H2SO4+2HI
C、H2O2+H2SO4 SO2↑+O2↑+2H2O
D、2Fe2++I 2 2Fe3++2 I-
11.用NA表示阿伏加德罗常数,下列叙述中正确的是 ( )
A. 12g的金刚石晶体中含有碳碳键的数目为4NA
B.46g四氧化二氮含有的原子总数为3NA
C. 500mLl.0mol/L的乙酸溶液中含有的H+数为0.5NA
D.1 molFeCl3制成胶体所得胶体的粒子数为NA
12. NaCl晶体中最小重复单元(晶胞)如右图所示。已知:氯化钠的摩尔质量为
M g/mol,某一定条件下NaCl晶体中最邻近的钠离子和氯离子中心间的距离为a cm,晶体的密度为 b g/cm3 。则下列叙述正确的是 ( )
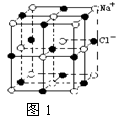 A.每个Na+ 周围最近且等距离的Cl-所围成的空间构型为正六面体
A.每个Na+ 周围最近且等距离的Cl-所围成的空间构型为正六面体
B. 每个Na+ 周围最近且等距离的Cl-所围成的空间构型为正八面体
C. 阿伏加德罗常数NA可表示为M/2a3b
D. 阿伏加德罗常数NA可表示为4M/a3b
13、据报道,某地一辆装载有砒霜的货车因故滑下河道,部分砒霜散落到河中。砒霜的主要成分是As2O3,剧毒,可用于制造杀虫剂和灭鼠剂等。As2O3是两性偏酸性氧化物,其无色晶体在193℃升华,微溶于水生成H3AsO3;其对应的盐也有毒性。其中碱金属对应的盐易溶于水,其他金属对应的盐几乎不溶于水。根据以上信息,下列说法正确的是 ( )
A. As2O3是砷的最高价含氧酸的酸酐
B. B.As2O3的晶体为分子晶体
C.可向河水中投入纯碱,以消除对河水的污染
D.可向河水中撒入生石灰,以消除对河水的污染
14.下列离子方程式书写正确的是 ( )
A.等体积等物质的量浓度的氢氧化钡稀溶液与碳酸氢铵稀溶液混合
Ba2+ + 2OH— + NH4+ + HCO3— = BaCO3↓+ NH3·H2O + H2O
B.氯化铝溶液中加入过量的氨水
Al3+ + 4NH3·H2O = 4NH4+ + AlO2 —+ 2H2O
C.向次氯酸钙溶液中通入过量的二氧化硫
Ca2+ + 2ClO— + SO2 + H2O = CaSO3↓+ 2HClO
D.碳酸钠溶液中加入过量的苯酚
![]()
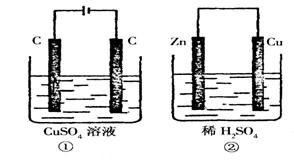 15.如图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.lmol/L,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是. ( )
15.如图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.lmol/L,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是. ( )
A.产生气体的体积:①>②
B.电极上析出物质的质量: ①>②
C.溶液的pH变化:①增大,②减小
D.电极反应式:
①中阳极:![]() ;
;
②中阳极:![]()
16.有一瓶无色气体可能含有CO2、HBr、HCl、SO2中的一种或几种。将此气体通入稀氯水中,恰好完全反应,得无色透明溶液,把此溶液分成两份,分别加入盐酸酸化了的BaCl2溶液和硝酸酸化了的AgNO3溶液,均出现白色沉淀,以下结论正确的是 ( )
A.原气体中肯定有SO2 B.原气体中肯定有HCl
C.原气体中肯定没有CO2 D.原气体中肯定没有HBr
17. X、Y、Z、W均为短周期元素,它们在周期表的位置如图所示,若W原子的最外层电子数是内层电子总数的![]() ,下列说法中正确的是 ( )
,下列说法中正确的是 ( )
![]() A.阴离子的半径从大到小排列顺序为:X > Y > Z > W
A.阴离子的半径从大到小排列顺序为:X > Y > Z > W
B.X、Y、Z、W元素的氢化物分子间都可以形成氢键
C.Y的两种同素异形体在常温下可以相互转化
D.最高价氧化物对应的水化物的酸性:W > Z
18. 一定条件下,向一带活塞的密闭容器中充入2mol![]() 和1mol
和1mol![]() ,发生下列反应:
,发生下列反应:![]()
![]()
![]() 达到平衡后改变下述条件,
达到平衡后改变下述条件,![]() 气体平衡浓度不改变的是
气体平衡浓度不改变的是
A. 保持温度和容器体积不变,充入![]()
B. 保持温度和容器内压强不变,充入![]()
C. 保持温度和容器内压强不变,充入![]()
D. 保持温度和容器内压强不变,充入![]()
![]()
19.将0.2mol/L的KOH溶液与0.lmol/L的H2SO3溶液等体积混合后,溶液中各粒子浓度大小关系正确的是 ( )
A.c(K+)+c(H+)=c(OH—)+c(HSO3—)+c(SO32—)
B.c(K+)+c(OH-)=c(H+)+2c(SO32—)+3c(HSO3-)+4c(H2SO3)
C.c(K+)>c(SO32—)>c(HSO3—)>c(OH—)> c(H+)
D.c(SO32—)+c(HSO3—)+c(H2SO3)=0.lmol/L
第二部分(非选择题共83分)
三、(本题包括 2小题共 24分 )
20.(10分) “过氧乙酸”是抗“非典”中广泛用于医院、地面、门窗、汽车等方面的消毒液。下面是市售过氧乙酸商品标签:
| 过氧乙酸 本品包括甲、乙两种溶液,体积各500mL,把甲、乙溶液各1份在玻璃容器中混合后放置24小时后,其中过氧乙酸浓度不少于10%,应用50倍纯水稀释(浓度为0.2%)稀释后才能使用。 |
有关资料:H2O2是极弱的电解质,在酸性介质中才能稳定存在,是一种强氧化剂。过氧乙酸消毒液是由H2O2、H2O、CH3COOH及少量H2SO4混合后,反应生成过氧乙酸(CH3COOOH),反应的化学方程式CH3COOH+ H2O2→CH3COOOH + H2O。 CH3COOOH容易放出原子氧,它与空气中微生物机体作用,达到灭菌目的,是消毒液的主要成份。
(1)某研究性学习小组为了弄清配制过氧乙酸消毒液的甲、乙溶液的主要成分各是什么?进行以下科学探究,请你完成下列相关内容:
① 提出假设:甲溶液的主要成分为
乙溶液的主要成分为 。
②实验验证:取甲、乙两种溶液少许,分别加入几滴 试液,甲溶液
的现象为 ,乙溶液的现象为 。
③得出结论:甲溶液的主要成分为
乙溶液的主要成分为 。
(2)该校根据“非典”消毒要求,急需配制0.2%过氧乙酸消毒液1m3,需要购进甲溶液_________瓶,乙溶液____________瓶。
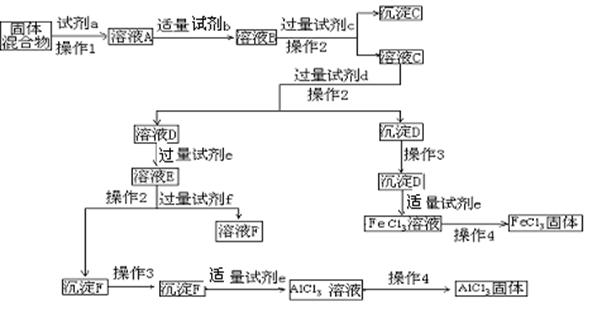
21.(14分)固体AlCl3和FeCl3混合物中含有少量FeCl2和Al2(SO4)3。某同学设计如下实验进行分离,以分别得到纯净的AlCl3和FeCl3固体。
回答下列问题:
(1) 写出下列试剂的名称:试剂c___________, 试剂d__________,试剂f ,
(2) 操作3是 __________________ __ ,
(3) 操作4 _______________________________ _ ,
(4) 加入试剂b(一种气体单质的水溶液)的目的是__________________________ ,溶液E中的溶质有:_________________________________。其中杂质可以不用另加试剂除去,其原因是_______________________________ ;有同学认为上述实验中最后得到AlCl3和FeCl3固体的步骤不科学,他的理由是:
.
四、本题包括 2小题共 21分
22.(10分)已知A、B、C、D、E为中学常见的五种物质,均含元素Y,有的还可能含有元素X、Z,元素X、Y、Z的原子序数依次递增。
①元素Y在A、B、C、D、E中所呈化合价依次递增,其中只有B为单质。
②常温下将气体D通入水中发生反应,生成C和E。
③工业上以A、空气和水为原料,通过催化氧化法制成E。
请回答以下问题:
(1)A分子的空间构型是 ;B分子的电子式为 ;含Y元素的氧化物且属于酸酐还有:________ 。
(2)写出②中反应的化学方程式: 。
(3)由B反应生成1molA放出的热量为46.2kJ,写出该反应的热化学方程式:
__________________________________________________________________________
(4)工业上,若输送Cl2的管道漏气,用A进行检验时可观察到大量白烟,同时有B生成,写出有关反应化学方程式: ;若反应有6NA ( NA表示阿伏加德罗常数)电子发生转移,则有 mol的A被氧化。
23. (11分)下图表示各物质之间的转化关系。已知:A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。
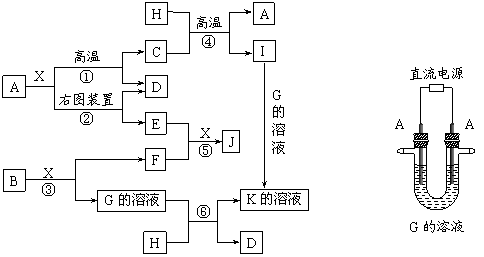
![]()
![]()
![]()
![]()
请按要求填空:
⑴写出B的电子式:______________________。
⑵写出用A作电极电解G溶液,在电极上生成E的反应式:_______________________,反应⑤的现象是___________________________ __ 。
⑶反应①的化学方程式是___________________________________,反应④在生产中有重要应用,被称为____________________反应。
⑷反应⑥的离子方程式是__________________________________________
五、本题包括 2 小题共19 分
24.(9分)2004年是俄国化学家马尔柯夫尼柯夫(V.V.Markovnikov,1838—1904)逝世100周年。马尔柯夫尼柯夫因为提出碳碳双键的加成规则而闻名于世,该规则是指不对称的烯烃与HX或HCN加成时,氢总是加到含氢较多的双键碳原子上。
已知:CH3CH2CN![]() CH3CH2COOH
CH3CH2COOH
以下是某有机物F的合成路线,请填写下列空白。
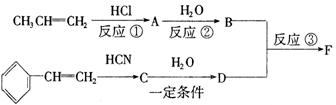
(1)写出下列物质的结构简式A___________,C____________。
(2)反应①的反应类型是__________,反应②的反应类型是___________。
(3)写出③的化学方程式__________________________________________。
(4)写出与D互为同分异构体、结构中含有苯环且苯环上含有一个甲基(苯环上的取代基处于对位)的酯类的结构简式
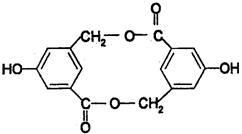
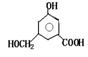
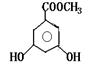
|
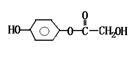
(1)A既能与NaOH溶液反应,又能与NaHCO3溶液反应,写出A和NaHCO3溶液反应的化学方程式
(2)有机物B在浓H2SO4存在下,相互作用生成一种环状酯,如图
|
则有机物B的结构简式为 ,等物质的量B与Na、NaOH、NaHCO3充分反应,消耗Na、NaOH、NaHCO3的物质的量之比为 。
(3)D和B互为同分异构体,且苯环上的一氯代物只两种,D不与NaHCO3反应,能与Na、NaOH反应,等质量的D消耗Na、NaOH的物质的量之比为2:3,则D的结构简式为(只写一种):
(4)1molA、C完全燃烧,消耗O2的质量相等,且1molC能和1molNa完全反应,写出含碳原子数最少的C的结构简式
六、本题包括 2 小题共19 分
26.(8分)铁粉和铜粉的均匀混合物,平均分成四等份,分别加入同浓度的稀硝酸,充分反应后,在标准状况下生成NO的体积与剩余金属的质量如下表(设硝酸的还原产物只有NO):
| 实验编号 | 1 | 2 | 3 | 4 |
| 稀硝酸体积(mL) | 100 | 200 | 300 | 400 |
| 剩余金属(g) | 18.0 | 9.6 | 0 | 0 |
| NO体积(L) | 2 .24 | 4 .48 | 6 .72 | V |
试通过计算填空:
(1)硝酸的浓度为
(2)2中溶解了 g Fe
(3)3中溶解了 g Cu
(4)4中 V=
27、(11分)为了测定溶液中Ba2+的浓度,做了以下实验:
①称取0.1323gK2Cr2O7溶于适量的稀硫酸中,再向其中加入过量的KI溶液与之反应,反应后的溶液加入27.00mLNa2S2O3溶液时恰好反应完全。
②另取50.00mLBa2+溶液,控制适当的酸度,加入足量K2CrO4的溶液,得BaCrO4沉淀,沉淀经过滤、洗涤后,用适量稀盐酸溶解,使CrO![]() 转化Cr2O
转化Cr2O![]() ,再加入过量KI与之反应,反应后再同上述 Na2S2O3溶液反应,反应完全时,消耗Na2S2O3溶液24.00mL,与之有关反应式如下:
,再加入过量KI与之反应,反应后再同上述 Na2S2O3溶液反应,反应完全时,消耗Na2S2O3溶液24.00mL,与之有关反应式如下:
□
Cr2O![]() +□I-+□H+——□Cr3++□I2+□H2O
+□I-+□H+——□Cr3++□I2+□H2O
□I2+□S2O![]() ——□S4O
——□S4O![]() +□I-
+□I-
(1)配平离子方程式。
(2)上述两步可用_________________作指示剂,其现象_____________________________ 。
(3)试计算溶液中Ba2+的物质的量浓度
(2)化学答案
| 题目 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 |
| 答案 | C | B | D | C | C | D | A | B | D | CD | B | BC | BD | AD | B | AD | D | B | B |
20(10分)
(1)②(2分)甲溶液的主要成分可能是H2O2、H2O、H2SO4,乙溶液的主要成分可能是CH3COOH、H2O(设成“H2O2、CH3COOH”共存一瓶则不给分),其它合理假设也可给分。
③(4分)紫色石蕊试剂,甲溶液先变成红色,后又褪为无色;乙溶液由无色变成红色。
④(2分)甲溶液的主要成分是H2O2、H2O、H2SO4,乙溶液的主要成分是CH3COOH、H2O
(2)(2分)20瓶、20瓶
21. (14分)
(1) 氯化钡溶液 氢氧化钠溶液 氨水(3分)
(2) 洗涤沉淀 蒸发溶液(2分)
(3) 使Fe2+氧化为Fe3+ (2分)
(4) AlCl3 BaCl2 NaCl (3分) 在E中加入氨水后过滤,杂质自然分离(2分)
未在酸性氛围中蒸发 AlCl3、 FeCl3会部分水解而得不到纯净的AlCl3 、FeCl3固体(2分)
22.(10分)(1)三角锥形 、 ![]() 、
、 ![]() 、
、![]() (各1分共4分)
(各1分共4分)
(2)![]() (1分)
(1分)
(3) N2(g)+3 H2= 2NH3(g) ;△H = – 92.4kJ/mol(2分)
(4)![]() (2分) 2 (1分)
(2分) 2 (1分)
23. (11分).⑴Na+[![]() ]2-Na+ (2分) ⑵Fe+2OH――2e-=Fe(OH)2(2分)
]2-Na+ (2分) ⑵Fe+2OH――2e-=Fe(OH)2(2分)
白色物质迅速转变为灰绿色最终变为红褐色(2分)
⑶3Fe+4H2O![]() Fe3O4+4H2 (2分) 铝热(1分)
Fe3O4+4H2 (2分) 铝热(1分)
⑷2Al+2OH-+2H2O=2AlO2-+3H2↑(2分)
|
|
(1)HO— —COOH+NaHCO3→HO— —COONa+CO2↑+H2O(2分)
|
| |||
| |||
(3) 或 (只写一种)(2分)
|
(4)
(2分)
25(1)4mol/L(2)16.8(3)9.6 (4)8.96 (各2分共8分)
26(11分)(1)1 6 14——2 3 7(2分) 1 2——1 2(1分)﹤
(2)淀粉(1分)溶液由蓝色变为无色(1分)
(3)解:n(K2Cr2O7)=
![]() =0.moL ………………(1分)
=0.moL ………………(1分)
Cr2O72-~3I2~6S2O32-
n(S2O32-)=6n(Cr2O72-)=6×0.mol=0.002700mol
c(S2O32-)=![]() =0.1000mol/L………………………………(2分)
=0.1000mol/L………………………………(2分)
2Ba2+~2BaCrO4~CrO4~Ct2O72-~3I2~6S2O32-
n(Ba2+)=![]() =
=![]() ·L-1×0.02400L=0.mol(2分)
·L-1×0.02400L=0.mol(2分)
c(Ba2+)=![]() =0.01600mlo/L(1分)
=0.01600mlo/L(1分)