山东省实验中学2005—2006学年度高三第一次诊断性测试
化学试卷
注意事项:
1.本试卷分为第Ⅰ卷和第Ⅱ卷两部分。第Ⅰ卷1~4页为选择题,第Ⅱ卷5~7页为非选择题。考试时间90分钟,满分100分。
2.请将第Ⅰ卷选择题所选答案的标号(A、B、C、D)填涂在答题卡上。
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 Cl 35.5 Ca 40
第Ⅰ卷(选择题 共48分)
一、选择题(本题包括16小题,每小题3分,每小题只有一个选项符合题意)
1.1994年欧洲的一个小组在德国达姆塔特,由62Ni和208Pb经核聚合,并紧接着射出一个中子而产生了第110号元素的一个同位素(元素符号用X 表示),该同位素是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
2.95℃时,水中H+的物质的量浓度为10—6mol/L,若把0.1molNaOH固体溶解在95℃水中配成1 L溶液,溶液的pH为 ( )
A.1 B.4 C.11 D.13
3.下列反应的离子方程式正确的是 ( )
A.铝片跟氢氧化钠溶液反应:Al+2OH— = AlO2—+H2↑
B.硫酸镁溶液跟氢氧化钡溶液反应:SO42—+Ba2+ = BaSO4↓
C.碳酸钙跟醋酸溶液反应:CaCO3+2CH3COOH = Ca2++2CH3COO—+H2O+CO2↑
D.碳酸氢钙溶液中加入足量氢氧化钠溶液:Ca2++HCO3—+OH— = CaCO3↓+H2O
4.下列叙述中错误的是 ( )
A.离子化合物中可能存在非极性共价键
B.离子键只存在于离子化合物中,不存在于共价化合物中
C.由极性共价键结合的分子不一定是极性分子
D.极性分子中一定不含有非极性共价键
5.下列叙述正确的是 ( )
A.原子晶体中,共价键的键能越大,一般熔沸点越高
B.分子晶体中,分子间的作用力越大,该分子越稳定
C.分子晶体中,共价键的键能越大,熔沸点越高
D.某晶体溶于水后,可电离出自由移动的离子,该晶体一定是离子晶体
6.有关3BrF3+5H2O=HBrO3+Br2+9HF+O2反应的叙述正确的为 ( )
A.还原剂与氧化剂物质的量之比为5:3
B.HBrO3和O2是还原产物
C.生成lmolO2,反应共转移6mol电子
D.若有5mol水参加反应时,被水还原的BrF3为10/3mol
![]() 7.已知:298K时,2SO2(g)+O2(g) 2SO3(g);△H=-197kJ·mol-1。在相同温度下,向某密闭容器中通入2molSO2和1molO2,达到平衡时放出热量Q1;向另一容积相同的密闭容器中通入1molSO2和0.5molO2,达到平衡时放出热量Q2。下列关系式中正确的是 ( )
7.已知:298K时,2SO2(g)+O2(g) 2SO3(g);△H=-197kJ·mol-1。在相同温度下,向某密闭容器中通入2molSO2和1molO2,达到平衡时放出热量Q1;向另一容积相同的密闭容器中通入1molSO2和0.5molO2,达到平衡时放出热量Q2。下列关系式中正确的是 ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
8.下列说法正确的是(NA表示阿伏加德罗常数的值) ( )
A.0.1mol/L硝酸钙溶液中NO3-的数目为0.2NA
B.常温常压下,NA个氢分子和NA个氦分子含的质子数相同
C.标准状况下,1L水所含分子数为1/22.4NA
D.含有5.3gNa2CO3的溶液中,有0.05NA个CO32-离子
9.下列各组离子在所给条件下能够大量共存的是 ( )
A.pH =0的溶液中,Fe3+、Mg2+、Cl-、SO42-
B.水电离出的c(H+)=1×10-13mol/L的溶液中, K+、HCO3-、Cl-、S2-
C.使pH试纸显深蓝色的溶液中,Cu2+、NO3-、Fe3+ 、SO42-
D.在AlCl3溶液中,Na+、AlO2-、NO3-、SO42-
10.已知三角锥形分子E和直线形分子G反应,生成直线型分子L和M(已知E、G、L、M分子中元素的原子序数都小于10)。如下图,则下列判断错误的是 ( )
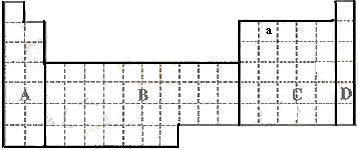
A.G是最活泼的非金属单质 B.L是极性分子
C.E能使湿润的紫色石蕊试液变蓝色 D.M化学性质活泼
11.在容积不变的密闭容器中,在一定条件下发生反应2A(?)![]() B(g)+C(s),达到化学平衡后,其他条件不变,升高温度时,容器内气体的密度增大,则下列叙述正确的是 ( )
B(g)+C(s),达到化学平衡后,其他条件不变,升高温度时,容器内气体的密度增大,则下列叙述正确的是 ( )
A.若正反应是吸热反应,则A为气态
B.若正反应是放热反应,则A为气态
C.在平衡体系中加入少量C,则平衡向逆反应方向移动
D.改变压强对平衡的移动无影响
12.若使0.1mol/L醋酸溶液的电离程度和pH值均增大,应采取的措施是 ( )
A.加水 B.加盐酸 C.加醋酸钠 D.加热
13.已知0.1mol/LHCN溶液的pH=4,0.1mol/LNaCN溶液的pH=12,现将0.2mol/LHCN溶液与0.1mol/LNaOH溶液等体积混合,溶液中各离子浓度的关系正确的是 ( )
A.c(Na+)>c(CN-)>c(OH-)>c(H+) B.c(Na+)>c(CN-) >c(H+) >c(OH-)
C.c(CN-)+c(OH-)>c(H+) +c(Na+) D.c(CN-)>c(Na+)> c(H+) >c(OH-)
 14.下列图象能正确地表达可逆反应3A(g)+B(g)
14.下列图象能正确地表达可逆反应3A(g)+B(g) ![]() 2C(g)(△H<0)的是 ( )
2C(g)(△H<0)的是 ( )
15.等物质的量的苛性钠溶液分别用pH为2和3的醋酸溶液中和,设消耗醋酸溶液的体积依次为Va、Vb,则两者的关系时 ( )
A.Va>10Vb B.Va=10Vb C.Vb <10Va D.Vb >10Va
16.在一定温度下,氯化银的饱和溶液中,Cl-浓度和Ag+浓度的乘积为一常数。现将足量的氯化银分别加入到:①10mL水,②30mL0.1mol/L稀盐酸,③50mL0.5mol/L食盐水,④50mL0.3mol/L氯化铝溶液中,得到的各饱和溶液中Ag+浓度由大到小的顺序是( )
A.①②④③ B.①②③④ C.①③②④ D.④②③①
第Ⅱ卷(非选择题 共52分)
二、填空题(本题包括5小题,共28分)
17.(4分)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式:
。 若1g水蒸气转化为液态水放热2.44 kJ ,则反应H2(g)+1/2O2 (g) =H2O(l)的 △H = kJ/mol。氢气的燃烧热为 kJ/mol。
18.(3分) 在V mLBaCl2溶液中加入一定体积的0.5mol/L H2SO4溶液时,两者恰好完全反应,且反应后溶液的pH=1,则原BaCl2溶液的物质的量浓度为____________。(计算结果保留两位有效数字,溶液体积变化忽略不计)
19.(6分)25℃时将0.01molCH3COONa与0.002molHCl溶于水,形成1L溶液.
(1)该溶液中共含有 种不同的粒子;
(2)在这些粒子中, 和 两种粒子的物质的量之和等于0.01mol;
(3) 和 两种粒子的物质的量之和比H+的物质的量多0.008mol。
20.(8分)
(1)在上面元素周期表中全部是金属元素的区域为 。
A.A B.B C.C D.D
(2)根据NaH的存在,有人提议可把氢元素放在VII A族,那么根据其最高正价与最低负价的绝对值相等,又可把氢元素放在周期表中的 族;元素a的最高价氧化物的电子式为 。
(3)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
①用元素符号将甲、乙两种元素填写在上面元素周期表中对应的位置。
②甲、乙两元素相比较,金属性较强的是 (填名称),可以验证该结论的实验是 。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
21.(6分)甲、乙两容器,甲的容积固定,乙的容积可变。在一定温度下,向甲中通入3molN2和4 molH2,反应达到平衡时,生成NH3的物质的量为a mol。
(1)相同温度下,向乙中通入2mol NH3,且保持容积与甲相同,欲使反应达到平衡时,各物质的浓度与甲中平衡时相同,则起始时乙中还需通入 molN2
和 molH2。
(2)相同温度下,向乙中通入6molN2和8molH2,且保持压强与甲相同,当反应达到平衡时生成NH3的物质的量为b mol,则a/b 1/2.若乙与甲的容积始终相等,达到平衡时,生成NH3的物质的量为c mol,则a/c 1/2.(填>,或<,或=)
三、实验题(共9分)
22.现需设计一套实验装置来电解饱和食盐水,并测量电解产生的氢气的体积约6mL和检验氯气的氧化性(不应将多余的氯气排入空气中)。
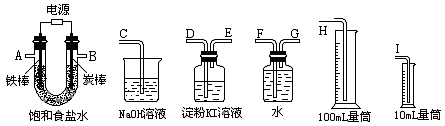
(1)试从上图中选用几种必要的仪器,连成一整套装置,各种仪器接口的连接顺序(填编号)是:A接__________________________,B接__________________________;
(2)炭棒接直流电源的________极;
(3)能说明氯气具有氧化性的实验现象是_________________________________ _;
(4)假定装入的饱和食盐水为50mL(电解前后溶液体积变化可忽略),当测得的氢气为5.6mL(标准状况)时停止通电。摇匀U形管内的溶液后溶液的pH约为__________。
四、计算题(本题包括2小题,共16分)
23.(8分)在一定条件下,氯气与足量氨气反应有白烟和一种无色无味气体生成,回答下列问题:
(1)写出上述反应的化学方程式,并标出电子转移的方向和数目。
(2)氧化剂与氧化产物的物质的量之比为____________。
(3)当有68gNH3参加反应时,被氧化的物质是_________ g,生成还原产物______ g。
24.(8分)常温下,将体积比为1:1的A、B两气体分别充入两个体积不变且相同的密闭容器中,发生反应A(气)+2B(气)
![]() 2C(气)。第一个容器中的反应在常温下达平衡,此时气体压强为原来气体压强的80%
。第二个容器中的反应在200℃ 时达平衡,此时气体A的体积分数为35% 。试计算两种不同温度下A的转化率并说明该反应为吸热反应还是放热反应 。
2C(气)。第一个容器中的反应在常温下达平衡,此时气体压强为原来气体压强的80%
。第二个容器中的反应在200℃ 时达平衡,此时气体A的体积分数为35% 。试计算两种不同温度下A的转化率并说明该反应为吸热反应还是放热反应 。
山东省实验中学2003级第一次诊断性测试
化学试题参考答案及评分标准
一、选择题(本题包括16小题,每小题3分,每小题只有一个选项符合题意)
1.B 2.C 3.C 4.D 5.A 6.C 7.B 8.B 9.A 10.D 11.B 12.A 13.A 14.D .15.D .16.B
二、填空题(本题包括5小题,共27分)
17. H2(g)+1/2O2 (g) =H2O(g); △H = -241.8 kJ/mol(2分);
-285.72 (1分); 285.72(1分)。
18.0.056mol/L(3分)
19. (1)7 (2分);(2)CH3COO-,CH3COOH(2分);(3)CH3COO-,OH-(2分)。
20.(1)b(1分);(2)ⅣA (1分);(电子式2分)
(3)① (各1分);②镁(1分);bc(1分)
21.(1)2,1(2分);(2)=(2分);(3)<(2分)
三、实验题(本题包括1小题,共9分)
22.(1)G、F、I(2分);D、E、C(2分);(2)正(1分);
(3)淀粉-KI溶液变成蓝色(2分);(4)12(2分)
四.计算题(本题包括2小题,共12分)
23.(1)(3分)(方程式2分,电子转移1分)
(2)3:1(1分) (3)17(2分);160.5(2分)
24.常温时,A的转化率40%(3分),
200℃时,A的转化率46%(3分),
吸热反应(2分)