山西省实验中学
2005—2006学年度高三年级第三次月考
化学试卷
YCY
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分100分。考试时间120
分钟。
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 K:19 Fe:56 Ba:137
第Ⅰ卷(选择题,共50分)
一、(本题包括10小题,每小题2分,共20分,每小题仅有一个选项符合题意)
1.为维持人体内电解质平衡,人在大量出汗后应及时补充的离子是 ( )
A.Mg2+ B.Ca2+ C.Na+ D.Fe3+
2.在下列反应中水既不是氧化剂,又不是还原剂的氧化还原反应是 ( )
A.氟气溶于水 B.金属钠溶于水
C.过氧化钠溶于水 D.五氧化二磷溶于热水
3.下列盐溶液中,加入BaCl2溶液后有白色沉淀生成,再加入稀硝酸,白色沉淀不消失的是 ( )
A.NaHCO3 B.Na2CO3 C.Na2SO4 D.Na3PO4
4.限用硫酸、盐酸、醋酸、钠盐、钾盐、钡盐相互反应,符合离子方程式2H++SO32—=H2O+SO2的化学方程式个数的是 ( )
A.4 B.5 C.8 D.12
5.下列各组离子在溶液中能大量共存,当加入过量氨水后也不产生沉淀的是 ( )
A.Na+、Ba2+、Cl—、SO42— B.K+、AlO2—、NO3—、OH—
C.H+、NH4+、Al3+、SO42— D.H+、Cl—、CH3COO—、NO3—
6.下列物质的性质比较,正确的是 ( )
A.热稳定性:Na2CO3>NaHCO3>H2CO3
B.熔点:K>Na>Li
C.溶解度:NaHCO3>Na2CO3
D.氧化性:K+>Na+>Li+
7.向0.1mol/L NaOH溶液中通入过量CO2后,溶液中存在的主要离子是 ( )
A.Na+、CO32— B.Na+、HCO3— C.HCO3—、CO32— D.Na+、OH—
8.下列反应的离子方程式不正确的是 ( )
A.氨气通入稀硫酸中:NH3+H+=NH4+
B.小苏打溶液和烧碱溶液反应:HCO3—+2OH—=CO32—+H2O
C.一小块金属钠投入水中:Na+2H2O=Na++OH—+H2↑
D.澄清石灰水中加入过量硝酸:H++OH—=H2O
9.某溶液中含有NO3—、CO32—、AlO2—、OH—等四种阴离子,若向其中加入过量的盐酸溶液,微热并搅拌,再加入过量的NaOH溶液,则溶液中大量减少的阴离子是 ( )
A.NO3—YCY B.CO32— C.AlO2— D.OH—
10.下列各组物质混合后,有气体生成,最终又有沉淀或固体析出的是 ( )
A.过量氢氧化钠溶液和硫酸铝溶液
B.氢氧化钠溶液和过量碳酸氢钠溶液
C.少量铜粉和氯化铁溶液
D.过氧化钠和少量氯化亚铁溶液
二、(本题包括10小题,每小题3分,共30分,每小题仅有一个选项符合题意)
11.在反应aBrF3+bH2O=cHBrO3+dHBr+eHF+fO2中(a, b, c, d, e, f是各物质的化学计量数),若0.3mol H2O被氧化,则被水还原的BrF3的物质的量是 ( )
A.0.15molYCY B.0.2mol C.0.3mol D.0.4mol
12.试管装有足量的煤油和水的混合物,静置后投入一小块碱金属,可观察到金属在煤油和水的界面附近上下往复运动,下列说法不正确的是 ( )
A.此碱金属可能是钾或钠
B.煤油会剧列燃烧,放出大量的热
C.碱金属上下运动是由于与水反应产生了氢气
D.若是金属锂则不能观察到上述现象
13.一种科学、简便的检测司机是否酒后驾车的方法是使驾车人呼出的气体接触载有硫酸酸化处理过的三氧化铬(CrO3)的硅胶。如果呼出的气体中有乙醇蒸气,乙醇就会被氧化成乙醛,同时三氧化铬被还原为硫酸铬[Cr2(SO4)3],下列说法不正确的是 ( )
A.CrO3和Cr2(SO4)3的颜色不同
B.CrO3中铬元素的化合价为+6
C.生成1mol的Cr2(SO4)3时,发生转移的电子为6mol
D.CrO3与稀硫酸反应生成Cr2(SO4)3和水
14.将一定量的NaHCO3和Na2O2混合后,在密闭容器中加热到250℃,充分反应,最终残留的固体物质是 ( )
A.一定存在Na2CO3 B.可能只有NaOH
C.可能有NaHCO3、NaOH和Na2O2 D.一定不存在Na2O2
15.我国发射的“神舟六号”载人飞船的燃料是铝粉与高氯酸铵的混合物。点燃时,铝粉氧化放热引发高氯酸铵反应2NH4ClO4=N2↑+4H2O+Cl2↑+O2↑;△H<0。关于该反应叙述不正确的是 YCY ( )
A.该反应属于分解反应、氧化还原反应、放热反应
B.该反应瞬间能产生大量高温气体,推动飞船飞行
C.在高温下能引发NH4ClO4分解
D.反应中NH4ClO4只起到氧化剂的作用
16.对于①a g Na2CO3 ②a g Na2CO3和NaHCO3的混合物,下列描述正确的是 ( )
A.分别配成等体积的溶液,②的pH大
B.分别与盐酸反应时,②耗酸量大
C.分别与足量盐酸反应,②放出CO2多
D.分别配成等体积的溶液,②中Na+浓度大
17.向CaCl2、MgBr2、KI的混合溶液中通入Cl2后,若溶液中存在Br2,则一定不会存在的离子是 ( )
A.I— B.Cl2 C.Br— D.Cl—
18.已知反应: AgF+ Cl2+ H2O 9AgCl+ AgClO3+ HF+1O2;下列说法正确的是
( )
A.反应中的还原剂只是H2O
B.每生成9mol的AgCl时,消耗掉10mol的AgF
C.反应中的氧化剂是AgF
D.生成1mol O2时,被还原的Cl2为5mol
19.已知2H2(g)+O2(g)=2H2O(l);△H=-483.6kJ/mol,则对反应H2O(g)=![]() H2(g)+O2(g)的△H判断正确的是 ( )
H2(g)+O2(g)的△H判断正确的是 ( )
A.等于+483.6kJ/mol B.等于+241.8kJ/mol
C.吸热,数值小于241.kJ/mol D.放热,数值483.6kJ/mol
20.某温度下,将Cl2通入KOH溶液中,反应中得到KCl、KClO、KClO3的混合物,经测定c(ClO—): c(ClO3—)=1:3,则此反应中被还原氯元素与被氧化氯元素的质量比为
( )
A.21:5 B.11:3 C.3:1 D.4:1
第Ⅱ卷(非选择题 共50分)
三、(本题包括4小题,共28分)
21.(6分)据2002年3月5日的《环球时报》报道:意大利警方一举摧毁了四名摩洛哥人针对美国驻意大利大使馆的恐怖事件。警方从摩洛哥人的住宅中搜出了5kg爆竹,2.5kg蜡烛和2kgK4[Fe(CN)6]。据审讯,四名恐怖分子准备将爆竹作炸药,蜡烛作引爆剂,K4[Fe(CN)6]在爆炸中可分解成一种剧毒盐KCN。试根据要求回答下列问题:
(1)已知爆竹爆炸后,K4[Fe(CN)6]会发生分解,除生成剧毒盐KCN外,还生成三种稳定的单质。试写出化学反应方程式:
(2)恐怖分子打算将产生的剧毒KCN用来污染水源,含CN—的污水危害很大。处理该污水时,可将浓缩后含CN—的废水在催化剂TiO2作用下用NaClO氧化,使CN—的转化成CNO—的。CNO—在酸性条件下继续被NaClO氧化成N2与CO2,最后溶液中c(Cl—)增大。请写出上述反应的离子方程式 ; 。
22.(6分)肼又叫联氨,其化学式为(NH2)2,为无色中烯性液体,熔点275K,沸点386.5K,1g肼燃烧时放出19.5kJ的热量(通常状况下测定),是一种清洁的能源物质。古典的Rasching法制备肼是以次氯酸钠和足量的氨反应,获得肼的稀溶液,经分析确定该溶液中含有氯离子。回答下列问题:
(1)写出肼的电子式 。
(2)古典Rasching法制备肼的化学方程式 。
(3)写出肼燃烧的热化学方程式 。
23.(6分)甲、乙、丙、丁分别是盐酸、碳酸钠、氯化钙、硝酸银四种溶液中的一种。将它们两两混合后,观察到的现象是:①甲与乙或丙混合都产生沉淀。②丙与乙或丁混合也产生沉淀;③丁与乙混合产生无色气体。回答下面的问题:
(1)这几种溶液分别是甲: ,丙: 。
(2)写出乙与丁反应的离子方程式: 。
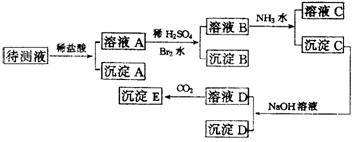
24.(10分)在上列框图中的待测夜中可能含有Fe2+、Fe3+、Ag+、Al3+、Ba2+、NH4+、Ca2+等离子。实验中所加酸、碱、氨水、溴水都是过量的:
|
根据实验结果,回答问题:
(1)判断待测液中有无Ca2+、Ba2+离子 ,并写理由 。
(2)写出沉淀D的化学式 。
(3)写出从溶液D生成沉淀E的可能的离子方程式 ; 。
四、(本题包括1小题,共10分)
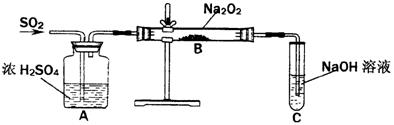
25.(10分)有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。
|
请回答下列问题:
(1)第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是:
。
(2)请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3。
。
(3)第2小组同学认为Na2O2与SO2反应生成了Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:
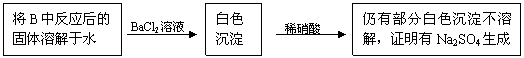 |
上述方案是否合理 。请简要说明理由:
① ;② 。
五、(本题包括2涉题,共12分)
26.(4分)已知常温下,在水溶液中能发生如下反应:
2Fe3++Cu 2Fe2++Cu2+。现将22.4g含铜粉与氧化铁的混合粉末加入1mol/L的H2SO4溶液中进行反应。若硫酸过量,反应后溶液的体积为1L,Fe2+的浓度为0.1mol/L,则原混合物中铜的质量m(Cu)=
。
27.(8分)为了测定K2CO3和NaHCO3混合物的组成,某学生每次称取一定质量的混合物溶于水配成溶液,向其中加入相同浓度的Ba(OH)2溶液,每次实验均充分反应,实验结果记录如下表:
| 实验次数 | 混合物的质量/g | 所加Ba(OH)2溶液的体积/L | 测得沉淀的质量/g |
| 1 | 0.858 | 0.5 | 1.379 |
| 2 | 1.716 | 0.5 | |
| 3 | 2.574 | 0.5 | 4.137 |
| 4 | 3.432 | 0.5 | 5.516 |
| 5 | 4.290 | 0.5 | 5.516 |
| 6 | 5.148 | 0.5 | 5.516 |
请回答下列问题:
(1)第二次实验中产生沉淀的质量是 g。
(2)混合物中K2CO3和NaHCO3的物质的量之比为 。
(3)在25℃时,取下第3组实验所得溶液体积的1/10,加水配成500mL溶液,求此溶液pH(要求写出计算过程)。
高三化学参考答案
第Ⅰ卷(选择题 共50分)
1.C 2.C 3.C 4.A 5.B 6.A 7.B 8.C 9.B 10.D 11.A 12.B 13.D 14.A 15.D 16.C 17.A 18.B 19.C 20.D
|
21.(1)K4[Fe(CN)6] 4KCN+Fe+N2↑+2C
|
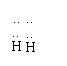 CN—+ClO—
CN—+ClO— CNO+Cl—
22.(1)H:N:N:H
|
(3)(NH2)2(l)+O2 N2(g)+2H2O(l);△H=-624kJ/mol
23.(1)CaCl2 AgNO3
(2)CO32—+2H+=CO2↑+H2O
24.(1)至少含有Ca2+、Ba2+中的一种 BaSO4难溶于水,CaSO4微溶于水
(2)Fe(OH)3
(3)2AlO2—+CO2+3H2O 2Al(OH)3↓+CO32—
AlO2—+CO2+2H2O Al(OH)3+HCO3—
25.(1)2Na2O2+2SO2 2Na2SO3+O2
(2)取少量白色固体,加入稀盐酸(或稀硫酸),若产生能使品红褪色的气体,则生成的白色固体中含有Na2SO3
(3)不合理:稀硝酸能将亚硫酸钡氧化为硫酸钡;如果反应后的固体中还残留Na2O2,溶于水后能将亚硫酸根氧化成硫酸根。
26.3.2g 14.4g
27.(1)2.758 (2)以第一组数据计算,设样品混合物中NaHCO3和K2CO3的物质的量分别为x mol和y mol
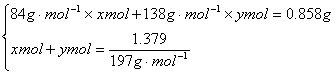
![]()
(3)设第4次实验中CO32—、HCO3—恰好生成沉淀,沉淀质量为5.516g,
则n(BaCO3)=n(Ba(OH)2)=0.028mol
由于第三次实验的样品质量为:2.574g总物质的量为0.028mol
其中:n(NaHCO3)=0.006mol 消耗n(OH—)=0.006mol
剩余的n(OH—)=0.028mol×2-0.006mol=0.05mol
c(OH—)=0.05mol×![]() ÷0.5L=0.01mol/L
÷0.5L=0.01mol/L
c(H+)=10—12mol/L pH=12