![]()
 永州一中高三第三次月考化学试卷
永州一中高三第三次月考化学试卷
命题人:龙路云 审题人:邓华林
本试卷分第Ⅰ卷和第Ⅱ卷两部分,共110分,考试时间90分钟。
可能用到的原子量:H ;1 O:16 C:12 N:14 Cl:35.5 Mg:24 P :31
Na: 23 K: 39 Cu :64 S:32
第Ⅰ卷(选择题 共48分)
一、选择题(每小题只有一个选项符合题意。每小题3分,共48分)
1.下列属于钠离子性质正确的是
A.极易被氧化 B.有银白色金属光泽
C.能置换CaCl2溶液中的Ca2+ D.焰色反应为黄色
2.某物质一定量的溶液,其质量分数为0.2 a , 当加入同体积的水稀释后, 其质量分数为0.12a 。则原溶液的密度
A.大于水的密度 B.等于水的密度 C.小于水的密度 D.无法确定
3.储存氯气的钢瓶,为防止腐蚀,装氯气前必须
A.清洗干净 B.充入惰性气体 C.充分干燥 D.除去铁锈
4.以NA表示阿伏加德罗常数的值,下列说法中正确的是
A.在31g白磷中含有NA个P-P键
B.0.1 mol Al分别与盐酸或氢氧化钠溶液充分反应生成H2时,失去的电子数均为0.3NA
C.1.8g重水(D2O)中含NA个中子
D.标准状况下11.2L臭氧中含NA个氧原子
5.下列反应既属于氧化还原反应,又属于吸热反应的是
A.Fe片与稀H2SO4的反应 B.Ba(OH)2·8H2O和NH4Cl反应
C.灼热的焦炭与水蒸气的反应 D.镁条在氯气中加热反应
6.下列各组中,两种气体的分子数一定相等的是
A.温度相同、体积相同的O2和N2 B.质量相等、密度不等的N2和C2H4
C.体积相等、密度相等的CO2和 C2H4 D.压强相同、体积相同的N2和O2
7.鉴别FeCl3溶液和Fe(OH)3胶体的最简便的方法是
A.电泳 B.渗析 C.布朗运动 D.丁达尔效应
8.下列离子方程式正确的是
A. 氢氧化钙悬浊液中加入碳酸钠溶液: Ca2++CO32-=CaCO3↓
B. 向硫酸氢钠溶液中滴入氢氧化钡溶液至pH=7:Ba2++OH-+H++SO42-=BaSO4↓+H2O
C. 铜跟稀硝酸反应:3Cu+8H++2NO3-![]() 3Cu2++2NO↑+4H2O
3Cu2++2NO↑+4H2O
D. 电解饱和食盐水:2Cl—+2H2O H2↑+C12↑+2OH—
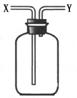 9.现有简易洗气瓶(如右图),正放在桌面上,可分别实现下列实验目的,其中适用于从y口进入的是:
9.现有简易洗气瓶(如右图),正放在桌面上,可分别实现下列实验目的,其中适用于从y口进入的是:
①瓶内盛一定量液体干燥剂,用于干燥气体
②瓶内盛一定量液体洗涤剂,用于除去气体中的某些杂质
③瓶内盛水,用于测量难溶于水的气体体积
④瓶内贮存难溶于水的气体,加入水使气体排出
⑤用于收集密度大于空气的气体
⑥用于收集密度小于空气的气体
A.①③ B.②④ C.③⑤ D.③⑥
10.下列关于氯水的说法,正确的是
A.新制的氯水中只含Cl2和H2O分子 B.光照氯水有气泡逸出,该气体是Cl2
C.氯水放置数天后pH将变小,几乎无漂白性D.新制的氯水可使红色石蕊试纸先变蓝后褪色
11.在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的是
A.滴加石蕊试液显红色的溶液:Fe3+ 、NH![]() 、Cl- 、SCN-
、Cl- 、SCN-
B.无色透明的溶液:K+、Na+ 、Mg2+、NO![]()
C.水电离出来的c(H+)=10-13mol/L的溶液:K+、HCO![]() 、Br-、Ba2+
、Br-、Ba2+
D.所含溶质为Na2SO4的溶液:K+ 、CO![]() 、NO
、NO![]() 、Al3+
、Al3+
12.按照下列实验方法可以达到目的的是
A.将铜丝用盐酸洗涤后,蘸取NaCl溶液,在酒精灯上灼烧观察焰色为黄色证明含有Na+
B.采用加热煮沸的方法除去碳酸钠溶液中的碳酸氢钠
C.为提高高锰酸钾的氧化能力可以用浓盐酸酸化
D.用焰色反应可以鉴别NaCl、KCl、CuCl2
13.下列事实与氢键有关的是
A.水加热到很高温度都难以分解
B.水结成冰体积膨胀,密度变小
C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
14.将标准状况下的VLHCl(气)溶于1000g水中,得到的盐酸密度为ρg/cm3,则该盐酸的物质的量浓度为
A.![]() B.
B.![]()
C.![]() D.
D.![]()
15.在60 oC恒温条件下,将含溶质A的某溶液200g分成甲、乙两等分,甲蒸发掉10g水后,析出5g A的无水晶体。乙蒸发掉20g水后,析出的15gA的无水晶体。则A在60oC时的溶解度为( )
A.50g B.100g C.150g D.200g
16.铜和镁的合金a g完全溶于浓硝酸,若反应中硝酸被还原只产生b mol的NO2气体和c mol的N2O4气体,在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为 ( )
A.(a+46b+92c)g B.(a+34b+68c) g C.不能确定 D.(a+17b+34c) g
选择题答题卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
第Ⅱ卷(非选择题共62分)
二、(每空2分,共28分)
17.已知:AgF + Cl2 + H2O → AgCl + AgClO3 + HF + O2(未配平)。若Cl2系数为a,则AgF的系数为___________,判断的依据是__________________________;若AgClO3的系数为b,O2系数为c,则AgCl的系数为_____________,判断的依据________________________________。
18.实验室配制500mL0.1mol/L Na2CO3溶液,回答下列问题:
(1)应用托盘天平称取十水碳酸钠晶体 g
(2)用托盘天平和小烧杯称出碳酸钠晶体的质量,其正确操作顺序的标号为 ADF FEB(同一步骤可用多次)(2分)
A.调整零点 B.将游码移至刻度尺的零刻度处
C.将碳酸钠晶体放入小烧杯中称量 D.称量空的小烧杯
E.将砝码放回砝码盒内 F.记录称量的结果
19.由某一元强酸稀溶液和一元强碱稀溶液反应生成1g水放出热量a kJ,写出该反应的热化学方程式 。
20.油画所用颜料含有某种白色铅的化合物,置于空气中,天长日久会生成黑色的PbS,从而使油画的色泽变暗,若用H2O2来“清洗”,则可将PbS转变成PbSO4而使油画复原,请填空:
(1) 上述清洗反应的化学方程式: 。
(2) H2O2的电子式: 。
(3)若有0.1molPbS参加反应,则在反应中转移的电子数目应该为 mol。
21.在纯碱溶液中滴入酚酞,溶液变红。若在该溶液中再滴入过量的氯化钡溶液,所观察到的现象是 、 ,其原因是(以离子方程式和简要文字说明): 、 。
三、(本题包括两小题,第21题10分,第22题13分,共23分)
22.现有一种简单可行的测定阿伏加德罗常数的方法,具体步骤为:⑴将固体NaCl细粒干燥后,准确称取m克NaCl固体并转移到定容仪器A中;⑵用滴定管向仪器A中加苯,不断振荡,继续加苯至A仪器的刻度处计算出NaCl固体的体积为V ml,请回答下列问题:
⑴步骤⑴中A仪器最好用
A、量筒 B、烧杯 C、容量瓶 D、试管
⑵步骤⑵中应该用酸式滴定管还是碱式滴定管: (1分),理由是
;
⑶能否用水代替苯 (1分),理由是 。
⑷已知NaCl晶体中,靠得最近的钠离子与氯离子间的平均距离为a cm,用上述方法测得的阿伏加德罗常数的表达式为 。
23.实验室用浓盐酸、MnO2共热制Cl2,并用Cl2和Ca(OH)2反应制少量漂白粉。已知反应:2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O;△H<0,温度稍高即发生副反应:6Cl2+6Ca(OH)2=Ca(ClO3)2+
5CaCl2+6H2O。现有甲、乙、丙三们同学分别设计的三套实验装置如下图所示:
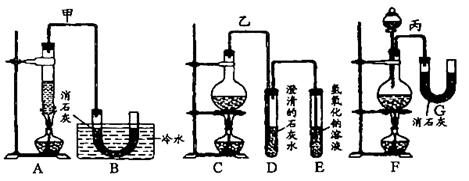
![]()
![]()
| 优点 | 缺点 | |
| ①甲装置 | ||
| ②乙装置 | ||
| ③丙装置 |
(1)有下列几项优、缺点:a.不容易控制反应速率;b.容易控制反应速率;c.有副反应发生;d.可控制副反应发生;e.污染环境;f.可防止污染环境。请从上面几个方面对图所示的甲、乙、丙三套装置的优缺点作出评析,选择符合题目要求的选项填在右表空格内。(9分)
(2)图中所示装置中,甲由A、B两部分组成;乙由C、D、E三部分组成;丙由F、G两部分组成。请从图A~G各部分装置中选取合理的组成部分,组装一套较完整的实验装置,这些组成部分的连接顺序(按气流从左到右的流向)是(填所选组成部分的编号) ____________________。
(3)实验中若用12mol/L的浓盐酸100mL,与足量的MnO2反应,最终生成Ca(ClO)2的物质的量总是小于0.15mol,其可能的原因是(假定各步反应均无反应物损耗且无副反应发生)___________________________________________________________。(3分)
四、(本题包括一小题,共11分)
24.现在由等物质的量的NaHCO3和KHCO3组成的混合物a g,与100mL盐酸反应。(题中涉及的气体体积均以标准状况计,填空时可以用带字母的式子表示。)
(1)该混合物中NaHCO3与KHCO3的质量之比为 。
(2)如碳酸氢盐与盐酸恰好完全反应,则盐酸的物质的量浓度为 mol·L—1。
(3)如果盐酸过量,生成CO2的体积为 L。
(4)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成CO2的体积,还需要知道 。
(5)若NaHCO3和KHCO3不是以等物质的量混合,则a g固体混合物与足量的盐酸完全反应时生成CO2的体积[V(CO2)]范围是 。(3分)(不要求写计算过程)
永州一中高三第三次月考化学试卷答案
一、选择题(每小题只有一个选项符合题意。每小题3分,共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | D | A | C | B | C | B | D | C | D | C | B | D | B | A | B | D |
第Ⅱ卷(非选择题共62分)
二、(每空2分,共28分)
17.2a,质量守恒;5b+4c、得失电子守恒。
18. (1)14.3 (2) BADFCFEB
19.H+(aq)+OH-(aq)=H2O(l);△H=-18akJ/mol
20.(1)PbS +4H2O2=PbSO4+4H2O (2)略 (3)0.8
21.有白色沉淀生成、 溶液由红色变无色
![]() CO32-+Ba2+=BaCO3↓
、
CO32-+H2O HCO3-+OH-, CO32-浓度减小水解平衡左移,OH-减少
CO32-+Ba2+=BaCO3↓
、
CO32-+H2O HCO3-+OH-, CO32-浓度减小水解平衡左移,OH-减少
三、(本题包括两小题,第21题10分,第22题13分,共23分)
22.(1)A
(2)酸式
,因为苯容易腐蚀碱式滴定管下端的橡皮管;
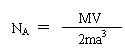
(3)不能,
因为氯化钠溶于水,使测得的氯化钠固体的体积不准确
;⑶
(4)
23.(1)①d; a 、e ②f; a 、c ③b; c、e (2)F、B、E (3)浓盐酸随反应的进行而变为稀盐酸,从而使反应不再生成Cl2,故用1.2molHCl不可能制得0.15molCa(ClO)2.
四、(本题包括一小题,共11分)
24. 84:100、 a/9.2、 22.4a/92、 盐酸的物质的量浓度、 22.4a/100 L<V(CO2)< 22.4a/84 L,但22.4a/92除外