【同步教育信息】
一. 本周教学内容:
有机物组成、结构和性质
二. 教学要求:
1. 掌握有机化合物的组成及表示方法。
2. 掌握有机物的基本碳架结构。
3. 掌握各类烃、烃的衍生物中各种碳碳键、碳氢键、碳氧键、碳卤键的性质和主要化学性质,并能够结合同系物原理加以应用。
三. 知识分析:
1. 物质组成的表示方法:
化学式:用元素符号表示物质组成的式子。(分子式、实验式、结构式都属于化学式)
分子式:用元素符号表示分子组成的式子。
注意:不是以分子构成的物质,如离子晶体、原子晶体、金属晶体等都不存在分子,所以![]() 等仅表示其组成及原子个数比,不是它们的分子式。
等仅表示其组成及原子个数比,不是它们的分子式。
实验式:(又叫最简式)仅表示化合物中各元素的原子个数最简比。有机化合物中往往会出现不同的化合物而具有相同的实验式。例如乙炔和苯的实验式都是CH,甲醛,乙酸,葡萄糖等的实验式都是![]() 。
。
结构式:用价键表示分子里各个直接相连原子的结合情况的式子。
说明:
(1)在结构式中连结原子的短线,用来表示形成共价键的电子对,叫做价键。
(2)在有机化合物中,同分异构的现象比较普遍。结构不同,性质迥异。用分子式不能区别分子组成相同,而结构相异的物质,因此在这种情况下,结构式更显得重要。
(3)通常所书写的结构式,多半只表示分子中各原子的结合方式和顺序,并不表示分子中各原子的空间排列。
结构简式和示性式:通常把结构中跟碳原子相连的氢原子写在一起,仅标出官能团的式子,叫结构简式。例如:![]() 为乙醇的结构简式。为了书写更方便,除标出官能团外,把分子中其它各原子都分别合在一起写的式子,叫示性式,例如
为乙醇的结构简式。为了书写更方便,除标出官能团外,把分子中其它各原子都分别合在一起写的式子,叫示性式,例如![]() 是乙醇的示性式。结构简式或示性式是简化的结构式,简化之后仍保持结构的特点。
是乙醇的示性式。结构简式或示性式是简化的结构式,简化之后仍保持结构的特点。
电子式:用·或 × 表示最外层电子的式子。
2. 有机物组成规律:
(1)烃及烃的含氧衍生物中,氢原子个数一定为偶数,相对分子质量亦为偶数。
(2)烃类物质中,烷烃随碳原子数目的增多,含碳量增大,![]()
![]() ;炔烃、苯的同系物随碳原子数增多,含碳量减小,其含碳量最大值亦等于85.71%,烯烃含碳量为一常数,其值等于85.71%。
;炔烃、苯的同系物随碳原子数增多,含碳量减小,其含碳量最大值亦等于85.71%,烯烃含碳量为一常数,其值等于85.71%。
(3)最简式相同的有机物,无论以何种比例混合,某元素的质量分数为常数。
常见最简式同为CH的有:乙炔、苯、苯乙烯;
同为![]() 的有:单烯烃和环烷烃;
的有:单烯烃和环烷烃;
同为![]() 的有:甲醛、乙酸、甲酸甲酯、葡萄糖。
的有:甲醛、乙酸、甲酸甲酯、葡萄糖。
(4)烷烃与较它少一个碳原子的饱和一元醛相对分子质量相等;饱和一元醇比它少一个碳原子的饱和一元羧酸相对分子质量相等。
(5)![]() 是所有烃分子中唯一只有一个碳原子的分子,若混合烃平均碳原子数大于1,小于2,则混合烃一定有
是所有烃分子中唯一只有一个碳原子的分子,若混合烃平均碳原子数大于1,小于2,则混合烃一定有![]() ;
;
![]() 的式量为16,是有机物中最小的,若混合烃平均式量大于16,小于26或28,则混合烃中一定有
的式量为16,是有机物中最小的,若混合烃平均式量大于16,小于26或28,则混合烃中一定有![]() 。
。
![]() 是有机物中含氢量最高的烃。
是有机物中含氢量最高的烃。
3. 烃的分子结构:
![]() :正四面体,若是
:正四面体,若是![]() 则仅是四面体,不正。
则仅是四面体,不正。
![]() :6个原子在同一平面上
:6个原子在同一平面上
![]() :4个原子在同一直线上
:4个原子在同一直线上
![]() :12个原子在同一平面上
:12个原子在同一平面上
4. 有机物结构与性质的关系:
有机物有许多特征官能团,如![]() ,
,![]() ,
,![]() ,
,![]() ,
,![]() ,
,![]() 等各自体现出特性,相同的官能团连在不同的“基”上,其性质既会有相同点(同系物原理),但有时也会产生一定的差异(官能团间的相互影响)
等各自体现出特性,相同的官能团连在不同的“基”上,其性质既会有相同点(同系物原理),但有时也会产生一定的差异(官能团间的相互影响)
(1)透过结构式,分析、记忆断键位置,加深对物质性质的理解。
例如:乙醇的结构式:
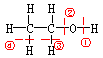
乙醇在化学反应中断键方式与对应化学性质有:
1)从①断键:与金属![]() 反应出
反应出![]() ,酯化反应。
,酯化反应。
2)从①、③断键:催化氧化变为乙醛。(醇催化氧化的必要条件是连接![]() 的碳原子上必须有氢原子)。
的碳原子上必须有氢原子)。
3)从②、④断键:消去反应生成乙烯。
4)两分子间分别从①、②断键;取代反应生成乙醚。
5)所有键全部断开:燃烧生成![]() 和
和![]()
(2)透过结构式,分析,理解烃基和官能团之间的相互影响。
例如:苯酚:![]()
1)羟基对苯环的影响,导致苯环上的邻、对位氢原子更易被取代。(如卤代、硝化)
2)苯环对羟基的影响,导致苯酚的水溶液显很弱的酸性。
【典型例题】
[例1]
描述![]() 分子结构的下列叙述中,正确的是( )
分子结构的下列叙述中,正确的是( )
A. 6个碳原子有可能都在一条直线上
B. 6个碳原子不可能都在一条直线上
C. 6个碳原子有可能都在同一平面上
D. 6个碳原子不可能都在同一平面上
解析:结合乙烯分子的平面结构和乙炔分子的直线结构可得下图。
答案:B、C
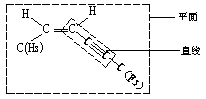 或
或 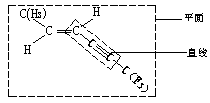
点评:中学课本里无法找出题中所示的分子。面对陌生的“情境”,首先应以熟悉的分子为类比换型,并把其看作是乙烯分子中的两个氢原子和乙炔分子中两个氢原子分别被![]() 和
和![]() 所取代,可以推出该分子至少有8个,最多有10个原子在同一平面上,同时一定有4个,且只有4个碳原子在同一直线上。
所取代,可以推出该分子至少有8个,最多有10个原子在同一平面上,同时一定有4个,且只有4个碳原子在同一直线上。
[例2]
阿斯匹林的结构简式如下图所示,图中(1)(2)(3)(4)(5)(6)分别标出了其分子中的不同的键。将阿斯匹林与足量![]() 溶液共煮时,发生反应的化学键是( )。
溶液共煮时,发生反应的化学键是( )。
A. (1)(4) B. (2)(5) C. (2)(6)
D. (3)(4) E. 只有(6)
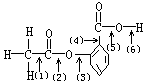
解析:分析阿斯匹林的结构如下:
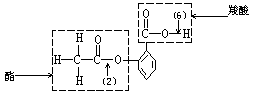
可以看出兼有羧酸的酯的结构,考虑这两种结构与![]() 溶液的反应:羧基可与
溶液的反应:羧基可与![]() 中和,生成相应的盐,即图中(6)键发生反应;酯基与
中和,生成相应的盐,即图中(6)键发生反应;酯基与![]() 反应实际上是在碱性条件下的水解,水解产物应为羧酸盐和酯,但此题中
反应实际上是在碱性条件下的水解,水解产物应为羧酸盐和酯,但此题中![]() 直接连在
直接连在![]() 上,所以相应的产物应为羧酸盐和酚钠,∴ 可生成
上,所以相应的产物应为羧酸盐和酚钠,∴ 可生成![]() 与
与![]() ,即在(2)处断键。
,即在(2)处断键。
答案:C
点评:有机化学中,结构特点![]() 性质,是核心问题,抓住各类物质的结构特征给予正确认识是解答本题的基础。
性质,是核心问题,抓住各类物质的结构特征给予正确认识是解答本题的基础。
[例3] A、B都是芳香族化合物,![]() A水解得到
A水解得到![]() B和
B和![]() 醋酸。A、B的分子量都不超过200,完全燃烧都只生成
醋酸。A、B的分子量都不超过200,完全燃烧都只生成![]() 和
和![]() ,且B分子中碳和氢元素总的质量百分含量为65.2%(即质量分数为0.652),A溶液具有酸性,不能使
,且B分子中碳和氢元素总的质量百分含量为65.2%(即质量分数为0.652),A溶液具有酸性,不能使![]() 溶液显色。
溶液显色。
(1)A、B分子量之差为 。
(2)1个B分子中应该有 个氧原子。
(3)A的分子式是 。
(4)B可能的三种结构简式是 、 、 。
解析:(1)A水解可写为:
![]()
![]() 18 60
18 60 ![]()
∴ ![]() + 18 = 60 +
+ 18 = 60 + ![]()
![]() -
-![]() = 42
= 42
(2)A显酸性,可水解,推测A应为含羧基的酯,即至少有4个氧原子。
B是A的水解产物,且另一产物![]() ,则B中至少含
,则B中至少含![]() 和
和![]() ,因为
,因为![]() 为A中原有的,
为A中原有的,![]() 为水解生成的,因此B至少有3个氧原子。
为水解生成的,因此B至少有3个氧原子。
若假设B有3个氧原子,且B中氧原子的质量分数为1-0.652
= 0.348,则![]() 可能为:
可能为:
![]() ,则
,则![]() = 138 + 42 = 180,则
= 138 + 42 = 180,则![]() 、
、![]() 均小于200,符合题意。
均小于200,符合题意。
再假设一次B有4个氧原子,则![]() = 184,
= 184,![]() = 225 > 200,不符合题意。
= 225 > 200,不符合题意。
确定B中必含3个氧原子。
(3)依据残基法:
B中有一个![]() 和
和![]() ,还至少有一个
,还至少有一个![]() ,
,
所以残基部分式量 = 138-17-45-76 = 0。因此B的结构简式为![]() ,另外还可能为
,另外还可能为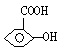 、
、![]() ,分子式为
,分子式为![]() ,
,
则A为:![]()
答案:(1)42 (2)3 (3)![]()
(4) 、
、![]() 、
、![]()
点评:本题给出了多种限制条件,考查了对“官能团决定化合物性质”这一基本观点。
关键是在推导分子式时利用已知给的必要但不是很充分的条件,先大胆假设B中有3个氧原子。在利用式量< 200这一限制条件,确定下来,另外残基法也是推断有机物分子式常用解法。
【模拟试题】
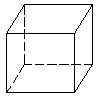
1. “立方烷”是新合成的一种烃,其分子为正立方体结构,如图所示:
(1)写出“立方烷”的分子式
(2)其二氯代物共有 种同分异构体。
2. 蒽的结构简式为![]() ,如果将蒽的分子中减少3个碳原子而氢原子数保持不变,形成的稠环烃的两种结构简式为
、
。
,如果将蒽的分子中减少3个碳原子而氢原子数保持不变,形成的稠环烃的两种结构简式为
、
。
3. [1993年全国高考试题] A是一种酯,分子式是![]() ,A可以由醇B跟羧酸C发生酯化反应而得,A不能使溴的
,A可以由醇B跟羧酸C发生酯化反应而得,A不能使溴的![]() 溶液褪色,氧化B可得到C,则A、B、C的结构简式为A
,B
,C
。
溶液褪色,氧化B可得到C,则A、B、C的结构简式为A
,B
,C
。
4. [2000年全国高考试题] 某期刊封面上有如图所示的一个分子的球棍模型图,图中“棍”代表单键或双键或三键。不同颜色的球代表不同元素的原子,该模型图可代表一种( )。
A. 卤代羧酸 B. 酯 C. 氨基酸 D. 醇钠
5. [2000年上海高考试题] 有效地利用现有能源和开发新能源已受到各国的普遍重视。
(1)可用改进汽油组成的办法来改善汽油的燃烧性能。例如,加入![]() 来生产“无铅汽油”。
来生产“无铅汽油”。![]() 分子中必存在的原子间连接形式有
(填写编号,多选倒扣)
分子中必存在的原子间连接形式有
(填写编号,多选倒扣)
①![]() ②
②![]() ③
③![]() ④
④![]()
(2)天然气的燃烧物无毒、热值高、管道输送方便,将成为我国西部开发的重点之一。天然气常和石油伴生,其主要成分是 。
能说明它是正四面体而非正方形平面结构的理由是 (填写编号,多选倒扣)
① 其一氯取代物不存在同分异构体
② 其二氯取代物不存在同分异构体
③ 它是非极性分子
④ 它的键长和键角都相等
(3)1980年我国首次制成一辆燃氢汽车,乘员12人,以50公里/小时行驶了40公里。为了有效发展用氢能源,首先需制得廉价的氢气,下列可供开发又较经济的制氢方法是
(填写编号,多选倒扣)
①电解水 ②锌和稀硫酸反应 ③光解海水
其次,制得纯氢气后还需解决的问题是 (写其中一个)
6. [2000年上海高考试题] 维生素C的结构简式为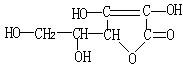 有关它的叙述错误的是( )
有关它的叙述错误的是( )
A. 是一个环状的酯类化合物 B. 易起氧化及加成反应
C. 可以溶解于水 D. 在碱性溶液中能稳定地存在
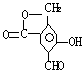
7. 某有机物A的结构简式为:
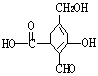
A与过量的![]() 完全反应时,A与参加反应的
完全反应时,A与参加反应的![]() 的物质的量之比为 ;A与新制的
的物质的量之比为 ;A与新制的![]() 反应时,A与被还原的
反应时,A与被还原的![]() 的物质的量之比为 ;A在浓
的物质的量之比为 ;A在浓![]() 作用下,发生分子内脱水生成酯的结构简式为 。
作用下,发生分子内脱水生成酯的结构简式为 。
8. 据测定,指示剂酚酞的结构简式可表示为
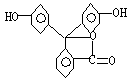
则(1)酚酞的分子式为: 。
(2)1![]() 酚酞与氢气完全加成时最多消耗
酚酞与氢气完全加成时最多消耗 ![]() 氢气。
氢气。
(3)1![]() 酚酞若与
酚酞若与![]() 溶液共热,最多可消耗
溶液共热,最多可消耗![]()
![]() ,化学方程式为: 。
,化学方程式为: 。
9. 判断生成下列高聚物的反应物
(1)合成![]() 的单体是
。
的单体是
。
(2)合成
![]() 的单体是 。
的单体是 。
(3)合成![]() 的单体是 。
的单体是 。
(4)合成一种酚醛塑料的结构式为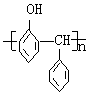 ,其单体是
。
,其单体是
。
10. ![]() 摩
摩![]() 和
和![]() 摩
摩![]() 加聚形成高聚物A,A在适量的氧气中恰好完全燃烧生成
加聚形成高聚物A,A在适量的氧气中恰好完全燃烧生成![]() 、水蒸气、氮气,其中
、水蒸气、氮气,其中![]() 占总体积的57.14%,则
占总体积的57.14%,则![]() 约为( )
约为( )
A. ![]() B.
B.
![]() C.
C. ![]() D.
D.
![]()
11. [2001年全国高考理科综合试题] 具有单双键交替长链
(如:![]() )的高分子有可能成为导电塑料。2000年诺贝尔(Nobel)化学奖即授予开辟此领域的3位科学家。下列高分子中可能为导电塑料的是( )。
)的高分子有可能成为导电塑料。2000年诺贝尔(Nobel)化学奖即授予开辟此领域的3位科学家。下列高分子中可能为导电塑料的是( )。
A. 聚乙烯 B. 聚丁二烯 C. 聚苯乙烯 D. 聚乙炔
12. [1995年全国高考试题] 碳正离子如![]() 等是有机反应中重要的中间体,欧拉因在此领域研究中的卓越成就而荣获1994年诺贝尔化学奖。碳正离子
等是有机反应中重要的中间体,欧拉因在此领域研究中的卓越成就而荣获1994年诺贝尔化学奖。碳正离子![]() 可以通过
可以通过![]() 在“超强酸”中再获得一个
在“超强酸”中再获得一个![]() 而得到,
而得到,![]() 失去
失去![]() 可得
可得![]() 。
。
(1)![]() 是反应性很强的正离子,是缺电子的,其电子式是 。
是反应性很强的正离子,是缺电子的,其电子式是 。
(2)![]() 中4个原子是共平面的,三个键角相等,键角应是 。
中4个原子是共平面的,三个键角相等,键角应是 。
(3)![]() 在
在![]() 的水溶液中反应得到电中性的有机分子,其结构简式是 。
的水溶液中反应得到电中性的有机分子,其结构简式是 。
(4)![]() 去掉一个
去掉一个![]() 后,将生成电中性的有机分子,其结构简式是 。
后,将生成电中性的有机分子,其结构简式是 。
13. 某烃的结构简式为![]() ,四面体碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数最多为b,一定在同一平面内的碳原子数最多为c,则a、b、c分别为( )。
,四面体碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数最多为b,一定在同一平面内的碳原子数最多为c,则a、b、c分别为( )。
A. 3,3,6 B. 2,3,5 C. 2,5,4 D. 4,6,4
14. 在![]() 分子中,处于同一平面上的原子数最多可能是( )。
分子中,处于同一平面上的原子数最多可能是( )。
A. 12个 B. 14个 C. 18个 D. 20个
15. 下列分子中的14个碳原子不可能处在同一平面上的是( )
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. 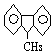
16. 某有机物结构简式为![]() ,有关该有机物的叙述正确的是( )
,有关该有机物的叙述正确的是( )
A. 该物质分子中所有原子在同一平面内
B. 该物质分子中所有碳原子在同一平面内
C. 该物质分子中,最多可能16个原子在同一平面内
D. 该物质是苯的同系物

【试题答案】
1. (1)![]() (2)3
(2)3
2. 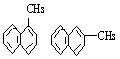
3. A. 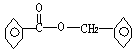 B.
B. ![]() C.
C. ![]()
4. C
5. (1)③; (2)甲烷、② (3)③,氢气的运输和贮存(注:其他合理也给分)
6. D
7. ![]() ;
;![]() ,
,
8. (1)![]() (2)9 (3)3,方程式;(略)
(2)9 (3)3,方程式;(略)
9. (1)![]() 和
和![]() ;
;
(2)![]() 、
、![]() 、
、![]()
(3)![]()
![]()
(4)![]() 、
、![]()
10. B 11. D
12. (1)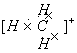 ;(2)
;(2)![]() ;(3)
;(3)![]() ;(4)
;(4)![]()
13. A 14. D 15. B 16. B