珠海市高三年级统一测试
化 学 试 卷
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分
第Ⅰ部分(选择题 共72分)
可能用到的原子量:H 1 C 12 N 14 O 16 Cl 35.5 K 39 Na 23
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1.当今化学界关注的热点之一C60,它可以看成是金刚石的
A.同素异形体 B.同分异构体
C.同位素 D.同系物
2.放在敞口容器中的下列溶液,久置后溶液中该溶质的浓度会变大的是
A.浓硫酸 B.氢氧化钠 C.氯水 D.氯化钠
3.2004年诺贝尔化学奖授予以色列科学家Aaron Ciechanover、Avran Hershko和美国科学家Irwin Rose,以表彰他们发现了泛素调节的蛋白质降解。泛素(Ubiquitio)是一种由76个氨基酸构成的小分子蛋白质。下列关于Ubiquitio的说法不正确的是
A.Ubiquitio是一种由氨基酸通过加聚反应生成的高分子化合物
B.Ubiquitio分子结构中仍然存在氨基和羧基
C.Ubiquitio相对分子质量可能小于10000
D.Ubiquitio是一种多肽,其结构可能有多种
4.据报道,俄罗斯特种部队在某次解救人质时,除使用了非致命武器芬太奴外,还使用了一种麻醉作用比吗啡强100倍的氟烷 (F3CCHBrCl),它的同分异构体数目为( )
A.3 B.4 C.5 D.6
5.已知在25℃,101kPa下,1gC8H18燃烧生成CO2和H2O(l)放出48.40kJ热量,则C8H18的燃烧热为
A.48.40kJ·mol-1 B.4646.40kJ·mol-1
C.5517.60kJ·mol-1 D.11035.2 0kJ·mol-1
6.下列关于实验现象的描述不正确的是
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
C.用铜片做阳极,铁片做阴极,电解氯化铜溶液,铁片表面出现一层铜
D.铁片与盐酸反应时,滴入几滴氯化铜溶液,气泡放出速率加快
7.t℃时将一定量的某物质的不饱和溶液均分为三份,分别加热蒸发溶剂,然后把温度降到t℃。已知从三份溶液中蒸发的溶剂分别为10g、20g、30g,析出的晶体不含结晶水,其质量分别为ag、bg、cg,则a、b、c三者的关系正确的是
A.c=a+b B.c=2a+b C.c=2b-a D.c=a+2b
8.下列叙述正确的是
A.在氧化还原反应中,有一种元素被氧化,肯定有另一种元素被还原
B.有单质参加或生成的反应一定属于氧化还原反应
C.失电子难的原子,获得电子的能力一定强
D.元素由化合态变成游离态时,它可能被氧化,也可能被还原
二.选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,但只要选错一个,该小题就为0分。)
9.“绿色化学”是21世纪化学发展的主导方向。“绿色化学”要求从根本上消灭污染。其中“化学反应的绿色化”要求原料物质中所有的原子完全被利用且全部转入期望的产品中。下列符合“化学反应的绿色化”的是
①用铁屑、氧化铜、稀硫酸为原料制取铜:
CuO+H2SO4=CuSO4+H2O,Fe+CuSO4=FeSO4+Cu
②用甲烷、一氧化碳合成乙酸乙酯:2CH4+2CO→CH3COOC2H5
③乙烯催化氧化制乙醛: 2C2H4+O2 →CH3CHO
④2M+N=2P+2Q,2P+M=Q (M、N为原料,Q为期望产品)
A.②③④ B.①②④ C.①③④ D.①②③
10.将31.2g的KOH和KHCO3的混合物在密闭容器内加热到250℃,排气冷却后,测得混合物的质量减少了3.85g。若原混合物中KOH和KHCO3的物质的量分别为a mol 和 b mol,则a与b的关系为 ( )
A.a<b B.a=b C.a>b D.无法确定
11.下列反应的离子方程式正确的是
A.碳酸氢镁溶液与足量的烧碱溶液反应
|
B.氯化铵溶液与澄清石灰水混合并微热 NH![]() +OH-= NH3↑+H2O
+OH-= NH3↑+H2O
C.CuSO4溶液与Ba(OH)2溶液混合 Ba2+ +SO![]() = BaSO4↓
= BaSO4↓
D.向偏铝酸钠溶液中加入少量的NaHSO4溶液 AlO![]() + H+ + H2O = Al(OH)3 ↓
+ H+ + H2O = Al(OH)3 ↓
12.某市曾是全国酸雨最严重的十四个城市之一,该市某校研究性学习小组获取的一次雨样品,经环保部门帮助分析后知:c (NH4+)=0.000002mol·L-1,c(NO3-)=0.000023 mol·L-1,c(C1-)=0.000006
mol·L-1,c(Na+) = 0.000003 mol·L-1,c(SO![]() )=0.000038 mol·L-1,则这种雨水的pH是 ( )
)=0.000038 mol·L-1,则这种雨水的pH是 ( )
A.3 B.4 C.5 D.6
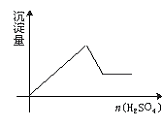 13.向一无色透明的溶液中滴加稀硫酸时有沉淀生成,且所得沉淀量与所加硫酸的关系如图所示,则原溶液可能是
13.向一无色透明的溶液中滴加稀硫酸时有沉淀生成,且所得沉淀量与所加硫酸的关系如图所示,则原溶液可能是
A.NaAlO2与Na2S2O3的混合溶液
B.Na2SiO3与Na2CO3的混合溶液
C.AlCl3和CuSO4的混合溶液
D.Na2S和Na2SO3的混合溶液
14.将足量的NO2和一定量的SO2混合气体通入BaCl2溶液中,产生的沉淀是
A.不可能是BaSO4 B.一定是BaSO3
C.一定是BaSO4 D.一定是BaSO3和BaSO4
15.X、Y是元素周期表ⅦA族中的两种元素。下列叙述中能说明X的非金属性比Y强的是 A.X原子的电子层数比Y原子的电子层数多
B.X的气态氢化物比Y的气态氢化物稳定
C.X的氢化物的沸点比Y的氢化物的沸点高
D.X的单质能将Y从熔融NaY中置换出来
16.可逆反应:![]() 在密闭容器中反应,达到平衡状态的标志是
在密闭容器中反应,达到平衡状态的标志是
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2 的同时,生成2n mol NO
③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥ 混合气体的平均相对分子质量不再改变的状态
A. ①④⑥ B.②③⑤ C.①③④ D. ①②③④⑤⑥
17.在 0.1 mol/L Na2CO3溶液中,下列关系正确的是
A.c(Na+) = 2[c(CO32-)+c(HCO3-)+c(H2CO3) ] B.c(OH-) = 2c(H+)
C.c(HCO3-) > c(H2CO3) D.2c(Na+) = c(CO32-)+c(HCO3-)+c(H2CO3)
18.已知反应BeCl2+2NaBeO2+2H2O=2NaCl+2Be(OH)2↓完全进行,则下列推断中正确的是 A.BeCl2溶液的pH<7,将其蒸干灼烧后,得到的残留物可能为BeO
B.NaBeO2溶液的pH>7,将其蒸干灼烧后,得到的残留物可能为BeO
C.Be(OH)2既能与盐酸反应又能与NaOH溶液反应
D.BeCl2水溶液的导电性强,因此BeCl2一定是离子化合物
第II部分(非选择题 共78分)
三、(本题包括2小题,共21分)
19.(6分)有两瓶失去标签的白色固体,一瓶是KCl,一瓶是(NH4)2SO4。请你设计两种实验方案加以鉴别,简要写出操作过程、实验现象和结论。
| 方案 | 操作过程(简要叙述) | 现象和结论 |
| (1) | ||
| (2) |
20.(15分)为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。
乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体,由此他提出必须先除去之,再与溴水反应。
请你回答下列问题:(1)写出甲同学实验中两个主要的化学方程式 ;
。
(2)甲同学设计的实验 (填能或不能)验证乙炔与溴发生加成反应,其理由是 (多选扣分)。
(a)使溴水褪色的反应,未必是加成反应
(b)使溴水褪色的反应,就是加成反应
(c)使溴水褪色的物质,未必是乙炔
(d)使溴水褪色的物质,就是乙炔
(3)乙同学推测此乙炔中必定含有的一种杂质气体是 ,它与溴水反应的化学方程式是 ;该杂质气体在验证过程中必须全部除去。
(4)请你选用下列四个装置(可重复使用)来实现乙同学的实验方案,将它们的编号填入方框,并写出装置内所放的化学药品。
(a) (b) (c) (d)
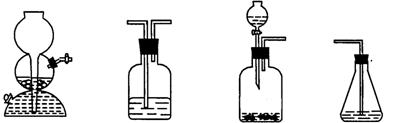
→ b → → d
(电石、水)( ) ( ) (溴水)
(5)为验证这一反应是加成而不是取代,丙同学提出可用pH试纸来测试反应后溶液的酸性,理由是
四、(本题包括2小题,共20分)
21. (10分)已知某溶液中只存在OH—、H+、NH4+、Cl—四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(Cl-)>c(NH4+)>c(OH-)> c(H+)
③c(NH4+)>c(Cl-)>c(OH-)> c(H+) ④c(Cl-) >c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只溶解了一种溶质,则该溶液是 ,上述四种离子的浓度的大小顺序为 (填序号)
(2)若上述关系中③是正确的,则溶液中的溶质为 ;若上述关系中④是正确的,则溶液中的溶质为 。
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好成中性,则混合前c(HCl)
c(NH3·H2O)(填“大于、小于或等于”)。
22. (10分)A为甲、乙两种短周期元素组成的化合物,其摩尔质量为100g·mol-1,甲元素的原子最外层电子数与K层相等,乙元素的氢化物水溶液显碱性。C为单质,其原子在周期表中半径最小。D为气体,其密度为相同条件下空气密度的1.103倍。K为乙元素的单质。在适当的条件下,它们相互之间有如下图所示的转化关系:
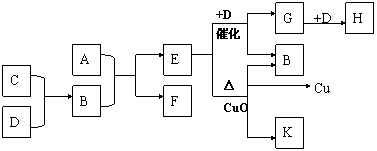 |
试填写下列空白:
(1)甲元素的单质在空气中燃烧可得到 (填化学式)。
K分子的结构式为 。
(2)完成下列有关反应的化学方程式。
E+D→G+B:
E+CuO:
(3)E与G在一定条件下能否反应,若能反应,写出化学方程式;若不能,则说明理由。
。
五、(本题包括2小题,共18分)
23.(6分)人体从食物中摄取碘后,碘便在甲状腺中积存,甲状腺素化学式为:
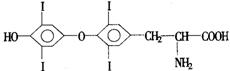
请填写下列空白:
⑴甲状腺素的分子式为: 。
⑵甲状腺素在物质分类上从不同角度考虑可以属于 。(填标号)
A.酚类 B.氨基酸类 C.卤代烃类 D.芳香族化合物
24.(12分))有一种广泛用于汽车、家电产品上的高分子涂料,按下列流程图生产。流程图中M(C3H4O)和A都可以发生银镜反应,N和M的分子中碳原子数相等,A的烃基上一氯取代位置有三种。填写下列空白:
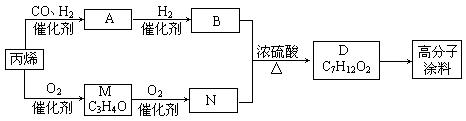
①物质的结构简式:A___________________,高分子涂料______________________。
②写出下列转化的反应类型:A→B________________,B+N→D_______________。
③写出B与N反应生成D的化学方程式:
______________________________ ____________。
④写出主链有3个碳原子且属于B的同分异构体的结构简式
。
六、(本题包括2小题,共19分)
25.(6分)350体积(标准状况)的氨气溶解在1体积的水(密度为1g/mL)里,求所得氨水(密度为0.924g/mL)中氨气的质量分数和物质的量浓度。
26.(13分)某天然碱(纯净物)可看作由CO2和NaOH反应后的产物所组成。称取天然碱样品四份,溶于水后,分别逐滴加入相同浓度的盐酸溶液30mL,产生CO2的体积(标准状况)如下表:
| Ⅰ | Ⅱ | Ⅲ | Ⅳ | |
| 盐酸液的体积(mL) | 30 | 30 | 30 | 30 |
| 样品(g) | 3.32 | 4.15 | 5.81 | 7.47 |
| 二氧化碳的体积(mL) | 672 | 840 | 896 | 672 |
(1)由第Ⅰ组数据中的CO2体积与样品质量之比,可以推测用2.49g样品进行同样的实验时,产生CO2_________mL(标准状况)。
(2)另取3.32g天然碱样品于300℃加热分解至完全(300℃时Na2CO3不分解),产生CO2112mL(标准状况)和水0.45g,计算并确定该天然碱的化学式。
(3)已知Na2CO3和HCl(aq)的反应分下列两步进行:
Na2CO3+HCl = NaCl+NaHCO3
NaHCO3+HCl = NaCl+CO2↑+H2O
由上表中第Ⅳ组数据可以确定所用的HCl(aq)的浓度为 mol·L-1
(4)依据上表所列数据以及天然碱的化学式,讨论并确定上述实验中CO2(标准状况)体积V(mL)与样品质量W(g)之间的关系式。
珠海市高三年级统一测试
化学试卷参考答案和评分标准
第Ⅰ部分(选择题 共72分)
一、二选择题(每小题4分,共72分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | A | D | A | B | C | B | C | D | A | A | BD | B | A | C | BD | A | AC | AC |
第II部分(非选择题 共78分)
三、(本题包括2小题,共21分)
19、(6分) 方案很多,按要求答题即给满分,参考方案如下:
| 方案 | 操作过程(2分) | 现象和结论(1分) |
| ① | 用洁净的铂丝分别蘸取固体样品在火焰上灼烧,透过蓝色的钴玻璃 | 焰色呈紫色,原样品为KCl |
| ② | 分别取少量固体放入试管加适量蒸馏水溶解,用pH试纸测试 | 溶液pH小于7,原样品为(NH4)2SO4 |
| ③ | 分别取少量固体放入试管,加适量水溶解再滴加入BaCl2溶液 | 产生白色沉淀,原样品为(NH4)2SO4 |
20、(15分)(1)CaC2+2H2O→C2H2↑+Ca(OH)2
HC≡CH+Br2→![]() (各2分)
(各2分)
(或HC≡CH+2Br2→![]() )
)
(2)不能(1分) a、c (2分)
(3)H2S(1分) Br2+H2S==S↓+2HBr(1分)
(4)(各1分共4分)) c b
(CuSO4溶液)(CuSO4溶液)(C中用氢氧化钠亦可)
(5)(2分)如若发生取代反应,必定生成HBr,溶液酸性将会明显增强,故可用pH试纸验证。
四、(本题包括2小题,共20分)
21、(10分)每空2分(1)NH4Cl ① (2)NH4Cl和NH3·H2O NH4Cl和HCl (3)小于
22、(10分)(1)MgO、Mg3N2、C, (3分) ![]() ; (1分)
; (1分)
(2)4NH3+5O2 ![]() 4NO+ 6H2O (2分);
4NO+ 6H2O (2分);
2NH3 +
3CuO ![]() N2↑ + 3Cu + 3H2O (2分)
N2↑ + 3Cu + 3H2O (2分)
(3)![]() (2分)
(2分)
五、(本题包括2小题,共18分)
23、(6分)C15H11I4NO4 (3分) ABD (3分)
24、(12分)①CH3CH2CH2CHO
(2分) ![]() (2分)
(2分)
②加成反应(还原反应) 酯化反应(取代反应) (各1分)
③CH2=CHCOOH + CH3CH2CH2CH2OH![]() CH2=CHCOOCH2CH2CH2 CH3+H2O(2分)
CH2=CHCOOCH2CH2CH2 CH3+H2O(2分)
④(CH3)2CHCH2OH,(CH3)3COH(各2分)
六、(本题包括2小题,共19分)
25、(6分)n(NH3) = 350L/22.4 L·mol-1 = 15.6mol(1分)
m(NH3) = 15.6mol×17g·mol-1=265.2g(1分)
ω(NH3) =265.2g/1265.2g = 0.209(1分)
V(aq) = 1265.2g/0.924g·mL-1 = 1370mL = 1.37L(1分)
C(NH3) = 15.6mol/1.37L = 11.4mol·L-1 (2分)
26、(13分)(1) 504 (1分)
(2)由题意可知,天然碱含NaHCO3、Na2CO3
n(NaHCO3)=2n(CO2)=2×0.112L/22.4 L·mol-1 =0.01mol (1分)
n(Na2CO3)= 0.672L/22.4 L·mol-1 – 0.1mol = 0.02mol (1分)
n(H2O)=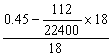 =0.02mol
(1分)
=0.02mol
(1分)
∴天然碱组成:2Na2CO3·NaHCO3·2H2O (1分)
(3)2.5 (2分)
(4)0<W≤4.98 V(CO2)=202.4W(mL) (2分)
注 V(CO2)=![]()
4.98≤W≤12.45 V(CO2)=1680-134.9W(mL) (2分)
注:V(CO2)=[0.075-![]() ]×22400(mL)也给分
]×22400(mL)也给分
12.45≤W V(CO2)=0 (2分)
注:30mL HCl(aq)中所含HCl物质的量:n(HCl)=![]()
![]()
和30mL HCl(aq)完全反应的样品的质量:
0.075mol÷5×332 g·mol-1 = 4.98g
样品中Na2CO3和盐酸反应完全生成NaHCO3时(没有CO2放出时),样品质量:
0.075mol÷2×332 g·mol-1 = 12.45g