高2006级化学总复习单元检测试题
(化学反应速率 化学平衡)满分110分,考试时间90分钟
可能用到的相对原子质量: H-1 C-12 N-14 O-16 S-32 Cu-64 Ag-108
第Ⅰ卷 (选择题,共48分)
一、选择题(共16小题,每题3分,共48分。每小题只有一个选项符合题意)
1.一定条件下反应N2(g)+3H2(g) ![]() 2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内N2的反应速率为
2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内N2的反应速率为
A.1.2mol/(L·min) B.1mol/(L·min)
C.0.6mol/(L·min) D.0.4mol/(L·min)
2.一定量的盐酸跟过量的铁粉反应时,为了减缓反应的速率,且不影响生成H2的总量,可向反应中加入适量的
A、NaOH(s) B、CH3COONa(s) C、NH4Cl(s) D、Na2CO3(s)
3、短周期元素M和N的离子M2+和N2-具有相同电子层结构,则下列说法正确的是
A、M2+的离子半径比N2-小 B、M的原子序数比N小
C、M和N原子的电子层数相等 D、M和N原子最外层电子数相等
4.在已处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明平衡移动的是
A. 反应混和物的浓度 B. 反应物的转化率
C. 正、逆反应速率 D. 反应混和物的压强
5.下列说法中正确的是(NA表示阿伏加德罗常数的值)( )。
A、SiO2晶体中,1mol硅原子与氧原子形成的共价键数是2NA
B、标准状况下,1L己烷所含碳原子个数约为6NA/22.4
C、3.2g铜在硫蒸气中完全燃烧,转移的电子数为0.1NA
D、常温常压下,0.1mol氖气含有的电子数为1NA
6、在一定温度下,向a L密闭容器中加入1mol X气体和2 mol Y气体,发生如下反应:X(g)+2Y(g)![]() 2Z(g) 此反应达到平衡的标志是
2Z(g) 此反应达到平衡的标志是
A.容器内压强不随时间而变化 B. 容器内X、Y、Z的浓度之比为1︰2︰2
C. 容器内各物质的浓度相等 D. 单位时间消耗0.1mol X同时生成0.2mol Z
7、对可逆反应4NH3(g)+ 5O2(g)![]() 4NO(g)+ 6H2O(g),下列叙述正确的是
4NO(g)+ 6H2O(g),下列叙述正确的是
A、达到化学平衡时,4υ正(O2)= 5υ逆(NO )
B、若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
C、达到化学平稳时,若增加容器体积,则正反应速率减少,逆反应速率增大
D、化学反应速率关系是:2υ正(NH3)= 3υ正(H2O)
8、在pH=1的溶液中,可以大量共存的离子组是
A Na+、K+、S2-、Cl- B Al3+、Mg2+、SO42-、Cl-
C K+、Na+、AlO2-、NO3- D K+、Na+、SO42-、S2O32-
![]() 9、在一密闭容器中,反应 aA(气) bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
9、在一密闭容器中,反应 aA(气) bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
A.平衡向逆反应方向移动了 B.物质A的转化率减少了
C.物质B的质量分数增加了 D.a>b
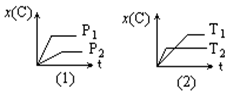 10、右图表示可逆反应mA(g)
+ nB(g)
10、右图表示可逆反应mA(g)
+ nB(g) ![]() pC(g)在不同温度(T)、压强(P)下,生成物C的物质的量分数x(C)的变化情况。下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是
pC(g)在不同温度(T)、压强(P)下,生成物C的物质的量分数x(C)的变化情况。下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是
A.吸热反应,m+n<p B.吸热反应,m+n>p
C.放热反应,m+n<p D.放热反应,m+n>p
![]() 11、在一定条件下,可逆反应X(g)+2Y(g)
2Z(g)达到平衡时,有50%的Y转化为Z,且X的转化率为25%,则起始时充入容器中的X和Y的物质的量之比为
11、在一定条件下,可逆反应X(g)+2Y(g)
2Z(g)达到平衡时,有50%的Y转化为Z,且X的转化率为25%,则起始时充入容器中的X和Y的物质的量之比为
A.2:1 B.1:1 C.2:3 D.3:2
12.在密闭容器中发生反应2SO2+O2
![]() 2SO2(气),起始时SO2和O2分别为20mol和10mol,达到平衡时,SO2的转化率为80%,若从SO3开始进行反应,在相同的条件下,欲使平衡时各成分的体积分数与前者相同,则起始时SO3的物质的量及SO3的转化率分别为
2SO2(气),起始时SO2和O2分别为20mol和10mol,达到平衡时,SO2的转化率为80%,若从SO3开始进行反应,在相同的条件下,欲使平衡时各成分的体积分数与前者相同,则起始时SO3的物质的量及SO3的转化率分别为
A.10mol和10% B.20mol和20% C.20mol和40% D.30mol和80%
13、一定条件下,可逆反应X(g)
+ 3Y(g)![]() 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是
A.c1:c2 = 1:3 B.平衡时,Y和Z的生成速率之比为3:2
C.X、Y的转化率不相等 D.c1的取值范围为0 < c1 < 0.14mol/L
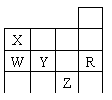 14、右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
14、右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
A 常压下五种元素的单质中Z单质的沸点最高
B Y、Z的阴离子电子层结构都与R原子的相同
C W的氢化物沸点比X的氢化物的沸点高
D Y元素的非金属性比W元素的非金属性强
15.一定温度下,在恒容密闭容器中发生如下反应:2A(g) + B(g)![]() 3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a %。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数等于a %的是
3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a %。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数等于a %的是
A.2 mol C
B.2 mol A、1 mol B和1 mol He(不参加反应)
C.1 mol B和1 mol C D.2 mol A、3 mol B和3 mol C
16.将一定量的固体![]() 置于容积不变的密闭容器中(装有少量
置于容积不变的密闭容器中(装有少量![]() ),某温度下发生反应:
),某温度下发生反应:![]()
![]()
![]() ,
,![]()
![]()
![]() ,反应经过10 min达到平衡,测得
,反应经过10 min达到平衡,测得![]() ,
,![]() ,则下列叙述中不正确的是( )
,则下列叙述中不正确的是( )
A.容器里气体的密度为![]() B.
B.![]() 的分解率为20%
的分解率为20%
C.在这10 min内的平均反应速率![]()
D.化学反应速率![]()
第Ⅰ卷答题表格:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | ||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
第Ⅱ卷(非选择题 共62分)
一、(本题包括2小题,满分24分)
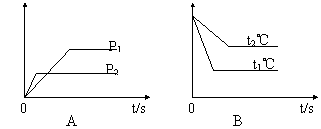 |
17.(8分)可逆反应;aA(g)+bB(g)
试根据下图回答:
(1)压强P1比P2 (填大、小)。
(2)体积(a+b)比(c+d) (填大、小)。
(3)温度t1℃比t2℃ (填高、低)
(4)ΔH值 (填正、负)
18、(16分)
恒温下,将2molSO2和1mo O2的混合气体通入一个容积固定的5L密闭容器中,发生如下反应:2SO2(g)+O2 (g) ![]() 2SO3 (g)
2SO3 (g)
(1)若2分钟后,测得O2的浓度为0.1mol/L,则2分钟内O2的平均反应速率为 。
(2)5分钟后反应达平衡,混合气体的物质的量为2.4mol,则平衡时SO3的物质的量为 。
(3)达平衡时,SO2的转化率为 ,平衡时容器内的压强与起始时的压强之比为 。
(4)若开始时只充入2mol SO3 (g),达平衡时SO3转化率为 。
(5)若平衡后,向该容器中充入一定量的氩气,化学平衡将 。
(正向移动、逆向移动、不移动);若平衡后,向该容器中再充入2molSO2和1molO2,当反应再次达平衡时,SO2的转化率将 (增大、减小、不变)。
二、(本题满分14分)
19、(14分)已知X、Y、Z、W四种元素是元素周期表中连续三个不同短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。试推断:
(1) Y、Z两元素相比较,非金属性较强的是 (填名称),可以验证该结论的实验是 (填编号)。
(a) 比较这两种元素的气态氢化物的还原性
(b) 比较这两种元素的液态氢化物的沸点
(c) 比较这两种元素的气态氢化物的稳定性
(d) 比较这两种元素的单质与H2反应的难易
(2)由以上元素中的两种元素组成的能溶于水且水溶液显碱性的化合物的电子式分别为(至少写出两种): ;
(3)由X、Y、Z所形成的常见离子化合物是 ,它与W的最高氧化物的水化物的溶液加热时反应的离子方程式 。
(4)在由X、Y、Z、W四种元素形成的常见单质或化合物中,不能形成的晶体类型是 。
三、(本题满分12分)
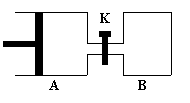 20.(12分)如图所示,容器A左侧是可平行移动的活塞。向A中充入1molX和1molY,向B中充入2molX和2molY,起始时V(A)=V(B)=aL。在相同温度和有催化剂存在的条件下,两容器各自发生:X(g)+Y(g)
20.(12分)如图所示,容器A左侧是可平行移动的活塞。向A中充入1molX和1molY,向B中充入2molX和2molY,起始时V(A)=V(B)=aL。在相同温度和有催化剂存在的条件下,两容器各自发生:X(g)+Y(g) ![]() Z(g)+2W(g),△H<0
Z(g)+2W(g),△H<0
达到平衡时V(A)=1.2aL。试回答:
⑴A中X的转化率为 。
⑵A、B中X转化率大小关系为A B(填“>”、 “<”、“=” )
⑶打开K,一段时间后又达到新的平衡时,
A的体积为 L(连通管中气体体积不计)
⑷在⑶达到平衡后,同时等幅升高A、B的温度,达到平衡后,A的体积 (填变大、不变、或变小),其理由是 。
四、(本题满分12分)
21.(12分)有机物A-H能发生下图所示一系列变化
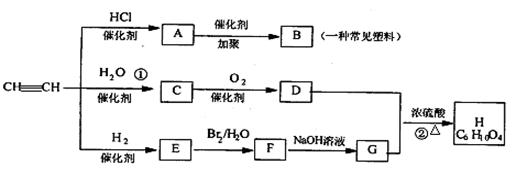
试回答下列:(1)写出B、G的结构简式:
B ; G
(2)C 分子中含有的官能团名称是 ,检验该官能团的方法是
。
(3)写出化学方程式:
①
②
参考答案
 第Ⅰ卷答案:
第Ⅰ卷答案:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | C | B | A | B | D | A | A | B |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | C | D | B | B | C | D | D | D |
一、(本题包括2小题,满分24分)
17、(1)小、 (2)小、 (3)大 (4)负 (各2分,共8分)
18、(1) 0.05mol/L.min (2分) (2)1.2mol(2分)
(3)60%(3分) 4:5(2分) (4)40%(3分)
(5)不移动(2分) 增大(2分)
二、(本题满分14分)
![]() (1) 氧元素 (2分) a、c、d(全对给2 分)
(1) 氧元素 (2分) a、c、d(全对给2 分)
(2) ![]() 或氮化钠、氢化钠的电子式也对
(各2分)
或氮化钠、氢化钠的电子式也对
(各2分)
(3) NH4NO3(2分) NH![]() +OH―
+OH―![]() NH3↑+H2O (2分) (4)原子晶体 (2分)
NH3↑+H2O (2分) (4)原子晶体 (2分)
三、(本题满分12分)
(1) 40% (3分) (2)A>B (2分) (3)2.6aL (3分)
提示: X(g) + Y(g) ![]() Z(g)+2W(g) 平衡时气体体
Z(g)+2W(g) 平衡时气体体
A容器 1mol 1mol 0 0 1.2aL
A+B容器 (1+2)mol
(1+2)mol
![]() (1+2)×1.2a=3.6aL
(1+2)×1.2a=3.6aL
故平衡时A的体积为3.6aL-aL=2.6aL
⑷变大(2分);虽然温度升高平衡逆向移动,但升温使气体的体积增大,气体浓度减小,平衡向正向移动,且压强不变时,气体体积与温度成正比,为线性关系,是体积变化的主要原因。(2分)
四、(本题满分12分)
![]()
![]()
![]()
![]() (1)B: [ CH2-CH] n (2分)
G: CH2OH-CH2OH (2分)
(1)B: [ CH2-CH] n (2分)
G: CH2OH-CH2OH (2分)
Cl
|
(3)
|
②
![]() CH2OHCH2OH+2CH3COOH
CH2OHCH2OH+2CH3COOH
![]() CH3COOCH2-CH2OOCCH3
+ 2H2O (2分)
CH3COOCH2-CH2OOCCH3
+ 2H2O (2分)![]()