高考化学第一轮总复习试卷(五)
物质结构 元素周期律
第Ⅰ卷(选择题 共60分)
一、选择题(本题包括5小题,每小题4分,共20分。每小题只有一个选项符合题意)
1.据报道,某些不合格大理石装潢材料中含有的放射性同位素氡![]() 严重超过规定标准,对人体造成伤害。该同位素原子中的中子数与核外电子数之差为( )
严重超过规定标准,对人体造成伤害。该同位素原子中的中子数与核外电子数之差为( )
A.136 B.50 C.88 D.222
2.人类探测月球发现,在月球的土壤中含有较丰富的质量数为3的氦,它可以作为未来核聚变的重要原料之一。氦的该种同位素应表示为:( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
3.化学成为一门自然科学,开始于( )
A.对空气成分的研究 B.对质量守恒定律的研究
C.元素周期表的发现 D.用原子——分子论来研究化学反应
4.下列表达方式错误的是( )
A.甲基的电子式![]() B.氟化钠的电子式
B.氟化钠的电子式![]()
C.硫离子的结构示意图![]() D.碳-12原子
D.碳-12原子![]()
5.在短周期元素中,原子最外电子层只有1个或2个电子的元素是( )
A.金属元素 B.稀有气体元素
C.非金属元素 D.无法确定为哪一类元素
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个都正确的给4分,但只选错一个,该小题就为0分)
6.由两种原子组成的纯净物( )
A.一定是化合物 B.可能是单质,可能是化合物
C.一定是单质 D.一定是同素异形体
7.1999年1月,俄美科学家联合小组宣布合成出114号元素的一种同位素,该同位素原子质量数为298。以下叙述不正确的是( )
A.该元素属于第七周期
B.该元素位于ⅢA族
C.该元素为金属元素,性质与![]() 相似
相似
D.该同位素原子含有114个电子和184个中子
8.由短周期两种元素形成化合物![]() ,
,![]() 比
比![]() 少一个电子层,且
少一个电子层,且![]() 具有与Ne原子相同的核外电子层结构,下列说法正确的是( )
具有与Ne原子相同的核外电子层结构,下列说法正确的是( )
A.![]() 是三氧化二铝
B.
是三氧化二铝
B.![]() 比
比![]() 最外层上的电子数相同
最外层上的电子数相同
C.A是第2周期第ⅢA族的元素 D.B是第3周期第ⅣA族的元素
9.甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是( )
A.x+2 B.x+4 C.x+8 D.x+18
10.已知自然界氧的同位素有![]() 、
、![]() 、
、![]() ,氢的同位素有H、D,从水分子的原子组成来看,自然界的水一共有( )
,氢的同位素有H、D,从水分子的原子组成来看,自然界的水一共有( )
A.3种 B.6种 C.9种 D.12种
11.下列叙述中正确的是( )
A.离子化合物中可能含有共价键
B.共价化合物中可能含有离子键
C.金属离子都一定满足最外电子层2或8电子结构
D.共价化合物中各原子都一定满足最外层8电子结构
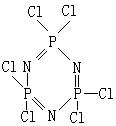
12.同主族元素的性质相似,往往可以形成结构和性质相似的化合物,试根据你学过的知识判断。下列有关![]() (碘化磷)的结构和性质推测结果不正确的是( )
(碘化磷)的结构和性质推测结果不正确的是( )
A.![]() 可由
可由![]() 和
和![]() 化合而得
化合而得
B.![]() 在物质分类中属于正盐
在物质分类中属于正盐
C.![]() 对热不稳定,受热时产生有色气体。
对热不稳定,受热时产生有色气体。
D.![]() 属于共价化合物
属于共价化合物
13.已知一个![]() 分子质量为a(kg),一个
分子质量为a(kg),一个![]() 分子的质量为
分子的质量为![]() ,若以氧原子质量的
,若以氧原子质量的![]() 作为相对原子质量的标准,则
作为相对原子质量的标准,则![]() 的相对分子质量是( )
的相对分子质量是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
14.根据中学化学教材所附元素周期表判断,下列叙述不正确的是( )
A.K层电子为奇数的所有元素所在族的序数与该元素原子的K层电子数相等
B.L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等
C.L层电子为偶数的所有主族元素所在族的序数与该元素原子的L层电子数相等
D.M层电子为奇数的所有主族元素所在族的序数与该元素原子的M层电子数相等
15.甲、乙、丙、丁四位学生对发现![]() 分子的认识,正确的是( )
分子的认识,正确的是( )
A.甲认为发现![]() 分子是不可能的,因为违背了共价键理论
分子是不可能的,因为违背了共价键理论
B.乙认为宇宙中还存在另一种氢单质,理由是氢有三种同位素,必然有三种同素异形体
C.丙认为上述发现的存在,证明传统的价键理论有一定的局限性,理论有待于进一步发展
D.丁认为![]() 分子实质上是
分子实质上是![]() 分子与
分子与![]() 以配位键形式结合的产物,应该写成
以配位键形式结合的产物,应该写成![]()
第Ⅱ卷 (非选择题 共90分)
三、(本题包括2小题,共24分)
16.(10分)X、Y、Z是短周期元素的三种常见氧化物。X跟水反应后可生成一种具有还原性的不称定的二元酸,该酸的化学式是①________;Y与X的组成元素相同,Y的化学式是②___________;1mol Z在加热时跟水反应的产物需要用6mol的氢氧化钠才能完全中和,Z的化学式是③_____________,其中和产物的化学式是④_____________。在一定条件下,Y可以跟非金属单质A反应生成X和Z,其反应的化学方程式是⑤__________。
17.(12分)用图5-1所示装置进行实验,将A逐滴加入B中;
(1)若A为浓硫酸,B为第三周期金属元素的片状单质,其在常温下难与水反应;C为品红溶液,实验中观察到溶液褪色,则B是___________(写化学式),B与浓![]() 反应的化学方程式为______________;反应后往烧杯中加入沸水,又可观察到试管C中的现象为___________________________________。
反应的化学方程式为______________;反应后往烧杯中加入沸水,又可观察到试管C中的现象为___________________________________。
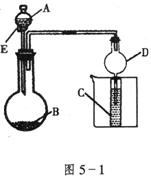
(2)若B为![]() ,C为
,C为![]() 溶液,实验中观察到小试管内溶液变浑浊,则酸A应具有的性质是_____________。然后往烧杯中加入沸水,可观察到试管C中的现象是_____________________。
溶液,实验中观察到小试管内溶液变浑浊,则酸A应具有的性质是_____________。然后往烧杯中加入沸水,可观察到试管C中的现象是_____________________。
(3)若B是生石灰,实验中观察到C溶液先形成沉淀,然后沉淀溶解,当溶液恰好澄清时,关闭E,然后往烧杯中加入热水,静置片刻,观察到试管壁出现光亮的银镜,则A是__________(写名称),C是__________(写化学式)与葡萄糖的混合液。该反应的离子方程式为___________,仪器D在此实验中的作用是____________。
四、(本题包括3小题,共28分)
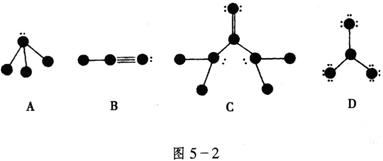
18.(8分)如图5-2所示,代表原子序数从1到10的元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表价键(示例:![]()
![]() ),根据各图表示的结构特点,写出相应分子的化学式。
),根据各图表示的结构特点,写出相应分子的化学式。
A____________;B____________;C____________;D____________。
19.(8分)在一定条件下,某元素的氢化物X可完全分解为两种单质Y和Z,若已知:
①反应前的X与反应后生成的Z的物质的量之比
![]() ;
;
②单质Y的分子为正四面体构型。
请填写下列空白:
(1)单质Y是_________,单质Z是__________________。(填写名称或分子式)
(2)Y分子中共含_____________个共价键。
(3)X分解为Y和Z的化学方程式为______________。
20.(12分)致冷剂是一种易被压缩、液化的气体,液化后在管内循环,蒸发时吸收热量,使环境温度降低,达到致冷目的。人们曾采用过乙醚、![]() 、
、![]() 等作致冷剂,但它们不是有毒,就是易燃。于是科学家根据元素性质的递变规律来开发新的致冷剂。
等作致冷剂,但它们不是有毒,就是易燃。于是科学家根据元素性质的递变规律来开发新的致冷剂。
据现有知识,某些元素化合物的易燃性、毒性变化趋势如下:
(1)氢化物的易燃性:第二周期_________>___________![]() 、
、![]() ;
;
第三周期![]() >______>__________。
>______>__________。
(2)化合物的毒性:![]() ;
;![]() ________
________![]() ;
;
![]() ;
;![]() (选填>或<)。
(选填>或<)。
于是科学家们开始把注意力集中在含F、Cl的化合物上。
(3)已知![]() 的沸点为
的沸点为![]() ,
,![]() 的沸点为
的沸点为![]() ,新致冷剂沸点范围应介于其间。经过较长的时间反复试验,一种新的致冷剂氟里昂
,新致冷剂沸点范围应介于其间。经过较长的时间反复试验,一种新的致冷剂氟里昂![]() 终于诞生,其它类似的还可以是_____________。
终于诞生,其它类似的还可以是_____________。
(4)然而,这种致冷剂造成了当今的某一环境的问题是_____________。但求助于周期表中元素及其化合物的_____________(填写字母,多选扣分)变化趋势来开发致冷剂的科学思维方法是值得借鉴的。
①毒性 ②沸点 ③易燃性 ④水溶性 ⑤颜色
a.①②③ b.②④⑤ c.②③④
五、(本题包括2小题,共21分)
21.(10分)![]() 、
、![]() 、
、![]() 、D、E5种粒子(分子或离子),它们分别含10个电子,已知它们有如下转化关系:①
、D、E5种粒子(分子或离子),它们分别含10个电子,已知它们有如下转化关系:①![]() ;②
;②![]() 。
。
据此,回答下列问题:
(1)含有10个电子的阳离子有_______________,含有10个电子的阴离子有________________。
(2)![]() 和
和![]() 的电子式
的电子式![]() ____________、
____________、![]() ____________。
____________。
(3)![]() 、D、E3种粒子结合质子
、D、E3种粒子结合质子![]() 的能力由强到弱的顺序是(用粒子的化学式表示)____________;这一顺序可用以下离子方程式加以说明:
的能力由强到弱的顺序是(用粒子的化学式表示)____________;这一顺序可用以下离子方程式加以说明:
①_____________________________________________;
②_____________________________________________。
22.(11分)X、Y、Z为短周期元素的单质,U、V为它们的化合物,这些物质之间的关系如图5-3所示,其中反应条件和某些产物已经略去:
(1)如果X、Y的组成元素是同主族的,写出反应Ⅰ的化学反应方程式:
①若已知V是水:_______________________;
②若已知U、V均为氧化物_______________________。
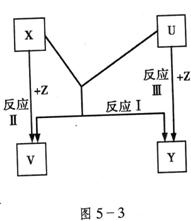
(2)如果X、Y的组成元素不同主族时,按下列要求回答问题。
①X组成元素是地壳中含量最多的金属元素时,则X、Y、Z的化学式是:X为____________;Y为_____________;Z为___________。
②若Y组成元素在自然界中形成的化合物种类最多时,则V、U的化学式是:V为______________;U为_____________。
③若Z是通常情况下密度最小的物质,则反应Ⅰ的化学反应方程式:_______________________________________________。
六、(本题包括2小题,共18分)
23.(8分)第ⅥA族元素R,在它的化合物![]() 中,其质量分数为
中,其质量分数为![]() ,在它的另一种化合物
,在它的另一种化合物![]() 中,其质量分数为
中,其质量分数为![]() 。
。
(1)试求:n=____________,m=_______________。
(2)试求R的相对原子质量:a=_______________。
24.(10分)在有机溶剂里若m![]() 跟m
跟m![]()
![]() 定量地发生完全反应,生成
定量地发生完全反应,生成![]() ,同时得到一种白色固体R。R的熔点为113℃,在减压下50℃即可升华,测得R的蒸气密度为折算成标准状况下
,同时得到一种白色固体R。R的熔点为113℃,在减压下50℃即可升华,测得R的蒸气密度为折算成标准状况下![]() 。试回答:
。试回答:
(1)通过计算推导R的化学式。
(2)分子结构测定表明,R分子为环状,且同种元素的原子在R分子中化合价相同,用单键“—”和双键“=”把分子里的原子连起来,写出R分子的结构式。
参考答案
1.B
![]() 电子数为86,中子数是222-86,二者之差为222-86-86=50。
电子数为86,中子数是222-86,二者之差为222-86-86=50。
2.B
氢的质子数为2,则该同位素的符号为![]() 。
。
3.D 科学的建立需理论作指导,而原子——分子论是最早提出的化学理论。
4.A
甲基是缺电子的,C原子未达稳定结构,应为![]() 。
。
5.D
短周期中满足条件的元素有H(非金属),He(稀有气体)、![]() 、
、![]() 、
、![]() (金属)。
(金属)。
6.B 由同种元素的不同原子组成的纯净物为单质(如HD),由不同元素的原子组成的纯净物为化合物(如![]() )。
)。
7.B
先推断位置:![]() 第七周期ⅣA族再判断。
第七周期ⅣA族再判断。
8.BD ![]() 为
为![]() ,则
,则![]() 为
为![]() ,
,![]() 为
为![]() 。
。
9.B 若甲为H,则乙可能是Li,Li原子序数符合x+2,若甲为第二周期的元素,或第三周期的![]() 、
、![]() ,则对应的乙元素的原子序数为
,则对应的乙元素的原子序数为![]() ,若甲为第三周期
,若甲为第三周期![]() 族元素,或第四周期的元素或第五周期的
族元素,或第四周期的元素或第五周期的![]() 、
、![]() ,则对应的乙元素的原子序数为
,则对应的乙元素的原子序数为![]() 。但不可能出现同族元素之间原子序数之差为4的情况。
。但不可能出现同族元素之间原子序数之差为4的情况。
10.C ![]() 与H、O可形成
与H、O可形成![]() ,
,![]() ,
,![]() 共三种,
共三种,![]() ,
,![]() 亦相同。
亦相同。
11.A ![]() 为离子化合物,但含有
为离子化合物,但含有![]() 键;金属离子如
键;金属离子如![]() 不满足2或8电子结构;
不满足2或8电子结构;![]() 等不满足8电子结构。
等不满足8电子结构。
12.D
![]() 类似于
类似于![]() ,不同的是
,不同的是![]() 受热分解成的HI不稳定并且分解成
受热分解成的HI不稳定并且分解成![]() 和
和![]() 。
。
13.A
一个氧原子的质量为![]() ,标准为
,标准为![]() ,
,![]() 的质量是
的质量是![]() ,则
,则![]() 的相对分子质量是
的相对分子质量是![]() 。
。
14.C 当各层电子为奇数时,该层为最外层,其族序数与该层电子数相等,但各层电子数为偶数时,该层可能不是最外层。
15.C
![]() 是由3个H原子通过共用电子对形成的。
是由3个H原子通过共用电子对形成的。
16.①![]() ②
②![]() ③
③![]() ④
④![]() 、
、![]()
⑤![]()
17.(1)![]() ;C中溶液变红
;C中溶液变红
(2)酸性比碳酸的酸性强;溶液由浑浊变澄清
(3)浓氨水(或铵盐的浓溶液);
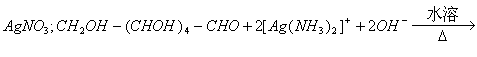
![]() ;防止倒吸
;防止倒吸
18.A:![]() ;
B:
;
B:![]() ; C:
; C:![]() ;
D:
;
D:![]()
19.(1)![]() ;
;![]() (2)6 (3)
(2)6 (3)![]()
20.(1)![]() (2)>;>
(2)>;>
(3)![]()
(4)使大气臭氧层出现空洞;a
21.(1)![]() 、
、![]() ;
;![]()
(2)![]() ;
;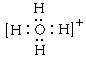
(3)![]() ;①
;①![]() ;
;
②![]()
22.(1)①![]() ;
;
②![]()
(2)①![]() ;
②
;
②![]() ;
;
③![]()
23.(1)![]() ①
①
![]() ②
②
由①和②式解得![]() ,讨论得
,讨论得![]() 。
。
(2)119
24.(1)根据题意和质量守恒定律,![]() 和
和![]() 的反应可表示为:
的反应可表示为:
![]()
![]()
![]() ,故R的化学式为
,故R的化学式为 ![]() 。
。
(2)