高考化学考前选择题(易错题)专项练习(共80道)
1、下列各组离子能在指定溶液中,大量共存的是 ( C )
①无色溶液中:K+,Cl—,Na+,H2PO4—,PO43—,SO42—
②使pH=11的溶液中:CO32—,Na+,AlO2—,NO3—,S2—,SO32—
③水电离的H+浓度c (H+)=10—12mol·L—1的溶液中:Cl—,HCO3—,NO3—,NH4+,S2O32—
④加入Mg能放出H2的溶液中:Mg2+,NH4+,Cl—,K+,SO42—
⑤使甲基橙变红的溶液中:Fe3+,MnO4—,NO3—,Na+,SO42—
⑥酸性溶液中:Fe2+,Al3+,NO3—,I—,Cl—,S2—
A ①②⑤ B ①③⑥ C ②④⑤ D ①②④
2、把3.6g铜粉放入100mL 4mol·L—1硝酸溶液中,反应完全后被还原的硝酸的质量是 ( D )
A、7.2g B、10.8g C、6.3g D、2.4g
3、最近发现了一种新的氧微粒O4,对于这种微粒,下列说法正确的是 ( C )
A、它是氧的一种新的同位素 B、它的摩尔质量为64
C、它是氧的一种新的同素异形体 D、它的氧化性比O3差
4、下列变化属于物理变化的是 ( C )
A.熔融态的氯化钠导电
B.用加热的方法分离氯化钠固体和氯化铵固体
C.在氢氧化铁胶体中加入硫酸镁溶液,析出红褐色沉淀
D.将过氧化钠固体溶于水中
5、下列说法或表示法正确的是 ( C )
A、等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B、由C(石墨)→C(金刚石):ΔH = +119 kJ· mol—1可知,金刚石比石墨稳定
C、在稀溶液中:H++OH-===H2O;ΔH=-57.3 kJ· mol—1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ
D、在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)===2H2O(l);ΔH=+285.8 kJ· mol—1
6、镓是1871年俄国化学家门捷列夫在编制元素周期表时曾预言的“类铝”元素。镓的原子序数为31,属IIIA族。镓的熔点为29.78℃,沸点高达2403℃。镓有过冷现象(即冷至熔点下不凝固),它可过冷到-120℃。由此判断下列有关镓的性质及其用途的叙述不正确的是 ( C )
A、镓是制造高温温度计的上佳材料 B、 镓能溶于强酸和强碱中
C、镓与锌、锡、铟等金属制成的合金,可用在自动救火的水龙头中
D、 近年来镓成为电子工业的新宠,其主要用途是制造半导体材料,被誉为“半导体材料的新粮食”,这是利用了镓的导电性介于导体和绝缘体之间的性质
7、下列离子方程式正确的是 ( B )
A、将0.1mol·L—1HCl溶液数滴缓缓滴入1 mol·L—1 50mLNa3PO4溶液中,且不断搅拌:3H+ + PO43— = H3PO4
B、将1 mol·L—1 NaAlO2溶液和1.5 mol·L—1的HCl溶液等体积互相均匀混合
6AlO2— + 9H+ + 3H2O = 5Al(OH)3↓+ Al3+
C、向1 mol·L—1明矾溶液50mL中滴入数滴0.1mol·L—1Ba(OH)2溶液
Al3++2SO42—+2Ba2++3OH—=Al(OH)3↓+2BaSO4↓
D、将少量SO2气体通入NaClO溶液中:SO2+H2O+ ClO—=SO42—+Cl—+2H+
8、物质的量浓度相同的NaCl溶液和NaClO溶液中,下列关系正确的是 ( B )
A、NaCl溶液中离子的总浓度和NaClO溶液中离子的总浓度相等
B、NaCl溶液中离子的总浓度大于NaClO溶液中离子的总浓度
C、NaCl溶液中离子的总浓度小于NaClO溶液中离子的总浓度 D、NaCl溶液的pH大于NaClO溶液的pH
9、两个硫酸分子可以脱去一分子水生成焦硫酸(H2S2O7)。已知硫酸的分子中有4个硫氧键,则焦硫酸分子中硫氧键的数目是 ( D )
A、 4 B、 6 C 、 7 D、 8
10、NO的血管舒张作用是由于它和一种含血红素的酶中的铁离子配位而推动一系列变化造成的。已知配位的NO是CO的等电子体,下列物种中可与铁配位的是 ( B )
A、NO B、NO+ C、NO— D、N2O2
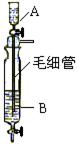 11.Inorganic
Syntheses一书中,有一如右图所示的装置,用以制备某种干燥的纯净气体。该装置中所装的药品正确的是
(
B )
11.Inorganic
Syntheses一书中,有一如右图所示的装置,用以制备某种干燥的纯净气体。该装置中所装的药品正确的是
(
B )
(A)A中装浓硫酸,B中装浓盐酸
(B)A中装浓盐酸,B中装浓硫酸
(C)A中装氢氧化钠浓溶液,B中装浓氨水
(D)A中装浓氨水,B中装氢氧化钠浓溶液
12.某温度下,某容积恒定的密闭容器中发生如下可逆反应:CO(g)+H2O(g)![]()
H2(g)+CO2(g) ![]() H>0当反应达平衡时,测得容器中各物质均为n mol,欲使H2的平衡浓度增大一倍,在其它条件不变时,下列措施可以采用的是
(
D )
H>0当反应达平衡时,测得容器中各物质均为n mol,欲使H2的平衡浓度增大一倍,在其它条件不变时,下列措施可以采用的是
(
D )
(A)升高温度 (B)加入催化剂
(C)再加入n molCO和n molH2O (D)再加入2n molCO2和2n molH2
13.若某装置中发生如下反应:Cu+2H+=Cu2++H2↑,关于该装置的有关说法不正确的是 ( A )
(A)该装置一定为原电池 (B)该装置一定为电解池
(C)金属铜为电解池的阳极 (D)电解质溶液可能是硝酸溶液
14.在托盘天平的两盘中各放入同浓度同体积的足量稀硫酸,分别加入0.1mol两种金属,反应后需在游码中拔动0.2个大格后,天平才能恢复平衡。两金属是 ( A )
(A)镁和铝 (B)铁和铝 (C)镁和钠 (D)铁和铜
15、纳米材料的表面微粒数占微粒总数的比例极大,这是它有许多特殊性质的原因,假设某纳米颗粒中粒子分布类似于硼镁化合物,其结构如图所示,则这种纳米颗粒的表面微粒数占总微粒数的百分数为 ( B )
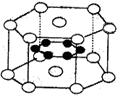 A、22% B、70%
A、22% B、70%
C、66.7% D、33.3%
( 如右图○镁原子,位于定点和上下两个面心 ●硼原子,位于六棱柱的内部 )
16、类推的思维方法在化学学习和研究中常会产生错误的结论,因此类推出的结论最终要经过实践的检验才能决定其正确与否。下列几种类推结论中不正确的是 ( BC )
A、Mg失火不能用CO2灭火;Na失火也不能用CO2灭火
B、Fe3O4可写成FeO·Fe2O3;Pb3O4也可写成PbO·pb2O3
C、不能用电解熔融AlCl3来制取金属铝;也不用电解熔融MgCl2来制取金属镁
D、Fe与S直接化合生成FeS;Al与S直接化合也可以得到Al2S3
17、应用纳米新材料能给人民币进行杀菌、消毒。我国纳米专家王雪平发明的“WXP复合纳米材料”的主要化学成份是氨基二氯代戊二醛的含硅衍生物,它能保持长期杀菌作用。有鉴于此,35位人大代表联名提交了一份议案,要求加快将此新技术应用到人民币制造中去。若戊二醛是直链的,请你根据所学的知识推断沸点不同的氨基二氯代戊二醛的同分异构体可能有 ( D)
A、4种 B、5 种 C、6种 D、8种
18、下列离子方程式或化学方程式中正确的是 (BC )
A、氯气通入水中 Cl2 + H2O = 2H+ + Cl— + ClO—
B、向Fe(OH)3中加入氢溴酸:Fe(OH)3+3H+ = Fe3++3H2O
C、向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3- = 3Fe3++NO↑+2H2O
D、向NaHCO3溶液中加入过量的Ba(OH)2溶液:
Ba2++2HCO3-+2OH-= BaCO3↓+CO32-+2H2O
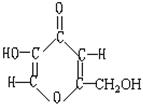 19、曲酸是一种非常有潜力的食品添加剂。经测定曲酸的分子式为C6H6O4,结构式如右图所示,试根据曲酸分子结构特点,推测曲酸不可能具有的性质为( D
)
19、曲酸是一种非常有潜力的食品添加剂。经测定曲酸的分子式为C6H6O4,结构式如右图所示,试根据曲酸分子结构特点,推测曲酸不可能具有的性质为( D
)
A、能发生酯化反应 B、易溶于水、醇
C、具有抗氧化性 D、具有强酸性
20. 恒温恒压下,在容积可变的器皿中,反应2NO2(g)![]() N2O4(g)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
( A )
N2O4(g)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
( A )
A. 不变 B. 增大 C. 减少 D. 无法判断
21. 某芳香族有机物的分子式为C8H6O2,它的分子(除苯环外不含其它环)中不可能有 (D )
A.两个羟基 B. 一个醛基 C. 两个醛基 D. 一个羧基
22. 某温度下,在密闭容器中发生如下反应: 2A(g)+ B(g) ![]() 2C(g),若开始时只充入2mol C气体,达到平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2mol A和1mol B的混合气体,达到平衡时A的转化率为
(C )
2C(g),若开始时只充入2mol C气体,达到平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2mol A和1mol B的混合气体,达到平衡时A的转化率为
(C )
A.20% B. 40% C. 60% D. 80%
23. 下列说法中,不正确的是 ( C )
A. 室温下,CH3COOH分子可能存在于pH=8的碱性溶液中
B. 在0.1mol·L-1的氢溴酸中加入适量的蒸馏水,溶液的c(H+)减少
C. 由水电离出的c(OH-)=1×10-12mol·L-1的溶液中,Al3+不可能大量存在
D. 在c(H+)=c(OH-)的溶液中,AlO2-不可能大量存在
24. 用物质的量都是0.1mol的HCN和NaCN混合后配成1L溶液,已知溶液中的c(H+)<c(OH-),下列关系式正确的是( D )
A. c(CN-)>c(Na+) B. c(HCN)<c(CN-)
C. c(CN-)+ c(OH-)=0.1mol·L-1 D. c(HCN)+ c(CN-)=0.2mol·L-1
25.对于Al与重氢氧化钠(NaOD)的水溶液反应,下列说法正确的是 ( B )
A.生成的氢气中只含有D2 B.生成的氢气中含有H2、HD、D2
C.以上判断都不正确 D.生成的氢气中只含有H2,
26.主链为4个碳原子的某烷烃有2种同分异构体,则相同碳原子数、主链也为4个碳原子的烯烃,其同分异构体有( B )
A.3种 B.4种 C.5种 D.2种
27.某无色溶液能与镁粉作用产生氢气,此溶液中可能大量存在的离子组是 ( D )
A.K+、Ba2+、AlO2-、CO32- B.A13+、Fe3+、HCO3-、SO32-
C.Ca2+、H+、C1-、NO3- D.H+、Na+、CI-、SO42-
28.设NA为阿伏加德罗常数,则下列说法正确的是 ( C )
A.22.4 L乙烯中含有的分子数为NA
B.0.1 L 0.1 mol/L的CH3COOH溶液中含有的分子数为0.01 Na
C.含0.1 mol H2O2的水溶液跟Mn02充分作用,反应过程中转移的电子总数0.1Na
D.1 mol Si02晶体中含有2Na个Si一O键
29.2004年诺贝尔化学奖授予美国和以色列的三位科学家,以表彰他们在蛋白质降解的研究中取得的成果。下列关于蛋白质的说法中不正确的是 ( B )
A.蛋白质属于天然有机高分子化合物,没有蛋白质就没有生命
B.HCHO溶液或(NH4)2SO4溶液均能使蛋白质变性
C.某些蛋白质跟浓硝酸作用会变黄
D.可以采用多次盐析或多次渗析的方法分离、提纯蛋白质
30.硝酸铵在不同条件下分解可以得到不同的产物,下列各组物质中肯定不可能是硝酸铵分解产物的是 ( D )
A.N2O、H2O B.N2、O2、H2O
C.N2、HNO3、H2O D.NH3、NO、H2
31.在高压下氮气会聚合生成高聚氮,这种高聚氮的晶体中每个氮原子都通过三个单键与其它氮原子结合并向空间发展构成立体网状结构。已知晶体中N-N键的键能为160 kJ·mol-1,而N≡N的键能为942 kJ·mol-1(键能表示形成化学键释放的能量或者破坏化学键消耗的能量)。则下列有关说法不正确的是 ( C )
A.键能越大说明化学键越牢固,所构成物质越稳定
B.高聚氮晶体属于原子晶体
C.高聚氮晶体中n(N)∶n(N-N)=1∶3
D.用作炸药或高能材料可能是高聚氮潜在的应用
32.下列反应必须用稀硫酸,而不能用浓硫酸的是 ( AD )
A.跟锌反应制氢气 B.跟苯、浓硝酸作用制硝基苯
C.溶解金属铜 D.作乙酸乙酯水解的催化剂
33.臭氧分子的结构与SO2(极性分子)相似,可读做二氧化氧,在臭氧层中含量达0.2 ppm(ppm表示百万分之一)。臭氧是氧气吸收了太阳的波长小于242 nm的紫外线形成的,不过当波长在220 nm~320 nm的紫外线照射臭氧时,又会使其分解。下列说法中正确的是 ( CD )
A.打雷时也能产生臭氧,臭氧分子是直线型分子
B.臭氧转化为氧气和氧气转化为臭氧均须吸收能量
C.臭氧和氧气的相互转化能保持大气中臭氧的含量基本稳定
D.向大气中排放氮的氧化物和氟氯代烃均能加快臭氧的分解
34.用NA表示阿伏加德罗常数的值,下列说法中正确的是 ( C )
A.4 g重水(D2O)中所含质子数为0.2 NA
B.4.48 L N2与CO的混合物所含分子数为0.2 NA
C.6.2 g白磷与红磷的混合物中所含磷原子数为0.2 NA
D.12.5 mL 16 mol·L-1浓硫酸与足量铜反应,转移电子数为0.2 NA
35.A、B、C为三种短周期元素,A、B在同周期, A、C的最低价离子分别为A2-和C-,B2+和C-具有相同的电子层结构。下列说法中正确的是 ( AC )
A.原子序数:A>B>C B.原子半径:A>B>C
C.离子半径:A2->C->B2+ D.原子核外最外层电子数:A>C>B
36.关于某无色溶液中所含离子的鉴别,下列判断正确的是 ( C )
A.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有Cl-存在
B.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有SO42-存在
C.通入Cl2后,溶液变为黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在
D.加入盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有大量CO32-
37.t℃时,将100 g某物质A的溶液蒸发掉10 g水,恢复至t℃,析出2.5 g晶体;再蒸发掉10 g水,恢复至t℃,析出7.5 g晶体。下列说法中正确的是 (AB )
A.t℃时原溶液是不饱和溶液 B.若A是CuSO4,则7.5 g晶体中含水2.7 g
C.t℃时A的溶解度为75 g D.原溶液中A的质量分数为40%
38.一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如右图所示,下列说法正确的是( BC )
![]()
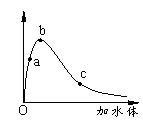 A.a、b、c三点溶液的pH:c<a<b
A.a、b、c三点溶液的pH:c<a<b
B.a、b、c三点醋酸的电离程度:a<b<c
C.用湿润的pH试纸测量a处溶液的pH,测量结果偏小
D.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:c<a<b
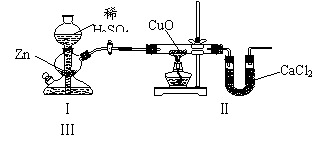 39.用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U型管的质量差,实验测得m(H)∶m(O)>1:8。下列对导致这一结果的原因的分析中,一定错误的是
( D )
39.用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U型管的质量差,实验测得m(H)∶m(O)>1:8。下列对导致这一结果的原因的分析中,一定错误的是
( D )
A.Ⅰ、Ⅱ装置之间缺少干燥装置
B.Ⅲ装置后缺少干燥装置
C.Ⅱ装置中玻璃管内有水冷凝
D.CuO没有全部被还原
40.某单质能和浓硝酸反应,若参加反应的单质与硝酸的物质的量之比为1∶4,则组成该单质的元素在产物中的化合价可能是 ( BD )
A.+1 B.+2 C.+3 D.+4
41.用NA表示阿伏加德罗常数,下列说法正确的是( AC )
A.32g硫与足量铜完全反应转移的电子数为2NA
B.1 mol甲基(-CH3)所含电子数10 NA
C.在标准状况下,2.24L一氧化氮与氮气混合气所含分子数为0.1NA
D.2L 1mol/L 的盐酸溶液中,所含氯化氢分子个数是2NA
42.下列离子方程式书写正确的是 ( C )
A.硫酸铝溶液中滴加过量浓氨水:Al3++4OH-=AlO2-+2H2O
B.NaHCO3溶液水解:HCO3-+H2O=H2CO3+OH-
C.浓氢氧化钠溶液吸收少量SO2气体:SO2+2OH-=SO32-+H2O
D.氯气与水反应:Cl2+H2O=2H++Cl-+ClO-
43.强酸和强碱稀溶液的中和热可表示为:H+(aq)+OH-(aq)=H2O(l),△H=–57.3kJ·mol-1已知:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l);△H1 , 1/2H2SO4(aq)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l);△H2
HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(l);△H3 上述反应均为在溶液中的反应,则△H1、△H2、△H3的关系正确的是 ( D )
A.△H1=△H2=△H3 B.△H2<△H1<△H3
C.△H2<△H3<△H1 D.△H2=△H3<△H1
44.氢氧燃料电池以铂作电极,KOH溶液作电解质溶液。对该电池的说法正确的是 ( BD )
A.负极反应为O2+2H2O+4e-===4OH-
B.电池工作时,正极区pH升高
C.电池工作时溶液中的阴离子移向正极
D.电池的总反应为:2H2+O2===2H2O
45、下列说法正确的是 B
A.把100mL3mol·L-1的H2SO4跟100mLH2O混合,硫酸的物质的量浓度改变为1.5mol·L-1
B.把100g20%的NaCl溶液跟100gH2O混合后,NaCl溶液的质量分数是10%
C.把200mL3mol·L-1的BaCl2溶液跟100mL3mol·L-1的KCl溶液混合后,溶液中的C(Cl-)仍然是3mol·L-1
D.把100mL20%的NaOH溶液跟100mLH2O混合后,NaOH溶液的质量分数是10%
46、下列各组物质各自形成的晶体,均属于分子晶体的化合物的是 B
A.NH3、HD、C10H8 B.PCl3、CO2、H2SO4
C.SO2、SiO2、P2O5 D.CCl4、Na2S、H2O2
47、25℃时,pH为9的Na2CO3溶液和pH为5的FeCl3溶液中,水的电离程度的大小关系是B
A.前者大 B.两者相等 C.后者大 D.无法确定
48、用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1molCu(OH)2后恰好恢复到电解前的浓度和pH。则电解过程中转移的电子数为 D
A.0.1mol B.0.2mol C.0.3mol D.0.4mol
49、将相等物质的量的CO和H2O(g)混合,在一定条件下反应:CO(g)+ H2O(g)![]() CO2(g)+
H2(g),达到平衡后CO的转化率为25%,平衡混合气体的密度是相同条件下氢气的倍数是
CO2(g)+
H2(g),达到平衡后CO的转化率为25%,平衡混合气体的密度是相同条件下氢气的倍数是
A.46 B.23 C.11.5 D.5.75 C
50、某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或两种,现将13.8g样品加入足量水中,样品全部溶解,再加入过量的CaCl2溶液,得到9g沉淀。对样品所含杂质的正确判断是 B
A、肯定没有KNO3 B、肯定有KNO3,可能还有Na2CO3
C、肯定没有Ba(NO3)2,可能有KNO3 D、肯定没有Na2CO3和Ba(NO3)2
51、室温下,等体积0.5mol/L的①KCl ②FeCl3 ③HF ④Na2CO3四种物质的水溶液中,所含阳离子数目由少到多的顺序是 B
A.④①②③ B.③①②④ C.①④③② D.④②①③
52、物质的量浓度均为0.01mol·L-1的HA和MOH溶液,pH分别为3和12,将两溶液等体积混合后,所得溶液的pH为 B
A.≥7 B.一定>7 C.≤7 D.可能=7
53、常温下,将pH=5的硫酸溶液稀释到原来的500倍,则稀释后溶液中C(SO42—)与C(H+)之比约为 C
A、1:1 B、1:2 C、1:10 D、10:1
54、在蒸发皿中加热蒸干并灼热(低于400℃)下列物质的溶液,可以得到该物质固体的是
A、氯化铝 B、碳酸钠 C、碳酸镁 D、高锰酸钾 B
55、某种一元酸(HA)溶液中加入一定量的一种强碱(MOH)溶液后,恰好完全反应,则有关反应后的溶液的判断中一定正确的是 DC
A.若反应生成的MA水解,则 C(A— ) < C(OH— ) B. C(A— )≥ C(M+)
C.若反应生成的MA不水解,则C(A— ) > C(OH— ) D.C(A— )≤ C(M+)
56、经硫酸酸化的高锰酸钾溶液和过氧化氢溶液混合后,发生反应的化学方程式如下:2KMnO4 + 5H2O2 + 3H2SO4 = 2MnSO4 + K2SO4 + 5O2↑+ 8H2O 下列对此反应的分析正确的是 CD
A.过氧化氢作还原剂,硫酸作氧化剂 B.过氧化氢既作还原剂又作氧化剂
C.过氧化氢作还原剂,硫酸起酸化作用 D.高锰酸钾作氧化剂,氧气为氧化产物
57、将两个铂电极插入氢氧化钾溶液中,向两极分别通入甲烷和氧气,即构成甲烷燃料电池,已知通入甲烷的一极,其电极反应为:CH4 + 10OH— — 8e— = CO32— + 7H2O;通入氧气的另一极,其电极反应式是2O2 + 4H2O +8e— = 8OH—,下列叙述正确的是 AD
A、通入甲烷的电极为负极 B、燃料电池工作时,溶液中的阴离子向正极移动
C、正极发生氧化反应 D、该电池使用一段时间后应补充氢氧化钾
58、下面的判断中正确的是 A
A.不用其它试剂只利用液体间的相互混合就能鉴别酒精、四氯化碳、甲苯、溴水和Na2CO3溶液
B.最外层电子数为偶数的短周期元素不会与卤素或氢形成最简式为AB3型的化合物
C.在由水电离提供的C(H+)为10—4mol·L-1的溶液中,Fe3+、SO42-、NO3-、ClO-离子可以大量共存
![]()
![]()
![]()
![]() D.在CH C
CH2—CH = CH2 分子中所有原子一定处于同一平面
D.在CH C
CH2—CH = CH2 分子中所有原子一定处于同一平面
59、喹啉是一种重要的杂环化合物,它存在于多种药物之中,将萘(相对分子质量为128)分子中的一个碳原子(α位)换成一个氮原子,即得喹啉,其相对分子质量是 B
A、127 B、129 C、130 D、131
60、第ⅡA的铍在一定条件下可形成化合物Na2BeO2。下列有关铍及其化合物的叙述正确的是 CD
A、氧化铍不能溶于盐酸 B、氢氧化铍易溶于水
C、单质铍可溶于氢氧化钠溶液生成氢气 D、Na2BeO2溶液呈碱性
61、下列各组中,两种气体的分子数一定相等的是 AD
A.质量相等,密度不等的C2H4和N2 B.温度相同,体积相同的O2和N2
C.压强相同,体积相同的O2和N2 D.体积相等,密度相等的CO和C2H4
62、下表是几种物质在不同温度下的溶解度,工业上将等物质的量的NaCl、CO2、NH3溶于水中,在30℃时配成溶液,此时溶液无晶体,当降致某温度时,开始析出晶体。此晶体是 B
| 温度 物质 | 0℃ | 10℃ | 20℃ | 30℃ |
| NH4Cl | 29.4g | 33.3g | 37.2g | 41.1g |
| NH4HCO3 | 11.9g | 15.9g | 21.0g | 27g |
| NaHCO3 | 6.9g | 8.15g | 9.6g | 11.1g |
| NaCl | 35.7g | 35.8g | 36g | 36.4g |
A、NaCl B、NaHCO3 C、NH4Cl D、NH4HCO3
63、下列溶液,一定呈中性的是 CD
A.C(H+)=1×10— 7mol·L-1的溶液 B.pH=14—pOH的溶液
C.C(H+)=C(OH—)=1×10—6mol·L-1的溶液 D.pH= pOH的溶液
64、用铁酸钠(Na2FeO4)对来自河湖的淡水消毒净化是城市饮用水处理新技术,下列对用于饮用水净化处理的分析正确的是 C
A、 Na2FeO4的溶液显强碱性,能消毒杀菌
B、 在Na2FeO4中Fe为+6价,具有强氧化性,能消毒杀菌
C、 Na2FeO4的还原产物Fe3+易水解为Fe(OH)3 胶体,可使水中悬浮物凝聚沉降
D、Na2FeO4的还原产物Fe2+易水解为Fe(OH)2 胶体,可使水中悬浮物凝聚沉降
65、下列各组物质,可用一种试剂加以区别的是 D
①四种黑色固体:FeO、Fe、CuO、C ②四种白色粉末:(NH4)2SO4、NH4Cl、Na2SO4 NaCl ③四种无色溶液:乙醛、乙酸、甲酸、甲酸甲酯 ④四种有机物:苯、四氯化碳、乙烯、无水乙醇
A、只有①② B、只有③④ C、只有①②④ D、全部
66、用H2 还原mgCuO,当大部分固体变红时停止加热,冷却后称量,知残留固体质量为 ng,共用去WgH2 ,则被还原的CuO的质量为 C
A、40Wg B、g C、5(m-n)g D、mg
67、下列物质中,均直接由原子构成的是 C
①二氧化碳 ②二氧化硅 ③铁蒸气 ④金刚石 ⑤单晶硅 ⑥白磷 ⑦硫磺 ⑧氨 ⑨钠 ⑩氖晶体
A、②③④⑤ B、②③④⑤⑨⑩ C、②③④⑤⑩ D、②④⑤⑥⑦⑨⑩
68、一定条件下,可逆反应C(s)
+ CO2(g)![]() 2CO(g);△H>0,达到平衡状态,现进行如下操作:①升高反应体系的温度; ②增加反应物C的用量; ③缩小反应体系的体积; ④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是 B
2CO(g);△H>0,达到平衡状态,现进行如下操作:①升高反应体系的温度; ②增加反应物C的用量; ③缩小反应体系的体积; ④减少体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是 B
A、①②③④ B、①③ C、①② D、①③④
69、必须加入氧化剂才能实现的是 B
A、Cl2 → NaClO B、Fe2+ → Fe3+ C、H2S → S D、Na2SO3 → Na2SO4
70、某一元弱酸稀溶液和某一元强碱稀溶液等体积混合后,其pH等于7.0。则下列叙述正确的是 A
A、 酸溶液的物质的量浓度大于碱溶液的物质的量浓度
B、 酸溶液中H+的浓度大于碱溶液中的OH-的浓度
C、 酸溶液的物质的量浓度小于碱溶液的物质的量浓度
D、酸溶液中H+浓度小于碱溶液中H+的浓度
71、下列变化属于物理变化的是 A
A、浓硫酸镁溶液与蛋白质溶液混合 B、石墨转变为金刚石
C、稀硫酸溶液导电 D、块状纯碱在干燥空气中变成粉末
72、在相同条件下,学生甲取100gKNO3饱和溶液,学生乙取50gKNO3饱和溶液,加热,分别蒸发掉10g水,分别冷却到原来温度,则析出KNO3晶体的质量是 C
A、甲比乙少 B、乙比甲少 C、一样多 D、无法比较
73、下列各组中,两种气体的分子数一定相等的是 D
A、温度相同,体积相同的O2 和N2 B、压强相同,体积相同的O2和N2
C、体积相等,密度相等的CO和NO D、质量相等,密度不等的C2H4和N2
74、根据热化学方程式:S(s)+O2(g) = SO2(g);△H=-297.23kJ/mol,分析下列说法中正确的是 C
A、S(g)+O2(g) = SO2(g);△H= Q kJ/mol 。Q的值大于297.23
B、S(g)+O2(g) = SO2(g);△H= Q kJ/mol 。Q的值等于297.23
C、1molSO2 的键能总和大于1molS和1mol O2的键能总和
D、1molSO2的能量总和大于1molS和1molO2的能量总和
75、已知HF酸性比HCN的酸性强,现有物质的量浓度和体积均相同的NaF和NaCN两种溶液,已知前者溶液中所有离子数目为n1,后者的所有离子数目为n2,下列关系式正确的是BD(错选A)
A.n1 = n2 B.n1 > n2 C.n1 < n2 D.[F-] > [CN -]
76、下列物质与水的混合物用分液漏斗分离时,该物质应从分液漏斗下端流出的是 AB
A、硝基苯 B、溴苯 C、苯 D、己烷
77、下列事实可以证明氨水是弱碱的是 BC
A、0.1mol/L的氨水可以使酚酞试液变红 B、0.1mol/L的氯化铵溶液的pH约为5
C、在相同条件下,氨水溶液的导电性比强碱溶液弱 D、铵盐受热易分解
78、已知K2HPO4溶液中HPO42— 的水解程度大于其电离程度,对于平衡
HPO42— + H2O ![]() PO43— + H3O+ ,欲使溶液中C(HPO42—)、C(H3O+)、C(PO43—)均减小,可以采取的方法是 C
PO43— + H3O+ ,欲使溶液中C(HPO42—)、C(H3O+)、C(PO43—)均减小,可以采取的方法是 C
A、加水 B、加热 C、加消石灰 D、加硝酸银
79、能正确表示下列化学反应的离子方程式的是 BD较多同学漏选B
A、稀硝酸与锌的反应:2H+ + Zn = H2↑ + Zn2+
B、二氧化氮通入水中:3NO2 + H2O = 2H+ + 2NO3— + NO
C、过氧化钠和水反应:Na2O2 + H2O = 2Na+ + 2OH—+O2↑
D、过量二氧化碳通入少量澄清石灰水中:CO2 + OH— = HCO3—
80、膦(PH3)又称为磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含有。它的分子是三角锥形,以下关于PH3的叙述正确的是 BD很多漏选B
A.PH3是非极性分子 B.PH3分子中有未成键的电子对
C.PH3是一种强氧化剂 D.PH3分子中的P—H键是极性键