高考化学模拟试题(五)
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Cl-35.5 Cu-64 As-75
第I卷(选择题,共60分)
一、选择题(本题包括6小题,每小题4分,共24分。每小题只有一个选项符合题意。)
1.10月25日国家禽流感参考实验室确诊,湘潭县射埠镇湾塘村出现了H5N1亚型高致病性禽流感疫情,在疫区村民家里到处都洒满了石灰,甚至是低矮树木的叶子上都洒上了石灰,很是醒目。根据有关化学知识,判断下列说法不正确的是
A.石灰之所以可以杀灭H5N1亚型高致病性禽流感病毒,是由于石灰与水产生的氢氧化钙显碱性,病毒为蛋白质,可以使蛋白质变性,而使病毒失去活性
B.饱和石灰水中加入生石灰,在温度不变的情况下,pH不变
C.饱和石灰水中加入生石灰,在温度不变的情况下,Ca2+的物质的量不变
D.给饱和石灰水溶液升高温度,c(OH—)的浓度将发生改变
2.3月22日是世界水日,今年我国的宣传主题为“转变用水观念,创新发展模式”,水乡江苏积极倡导节约用水。下列有关水的说法中不正确的是
A.用太阳能蒸馏海水是海水淡化的方法之一
B.推广使用无磷洗衣粉主要是为了防止水体富营养化
C.水厂常同时用硫酸亚铁和氯气处理水,可起到消毒杀菌和除去水中悬浮杂质作用
D.水在3.98℃时,主要以(H2O)2存在,这两个水分子间是以共价键相结合的
3.某一元弱酸HA的相对分子质量为M。在t℃时,将a gHA完全溶解于水,得VmL饱和溶液,测得该溶液的密度为ρg·cm-3,其中n(A-)为bmol。下列叙述,错误的是
A.溶液中c(H+)
=![]() B.物质的量浓度c(HA) =
B.物质的量浓度c(HA) =![]() mol·L-1
mol·L-1
![]()
![]()
C.t℃时,HA的溶解度S = D.HA的质量分数w(HA) =
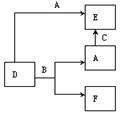 4.A、B、C分别是元素甲、乙、丙的单质,它们都是常见的金属或非金属。D、E、F是常见的三种氧化物,且有如图所示转化关系:则下列说法不正确的是
4.A、B、C分别是元素甲、乙、丙的单质,它们都是常见的金属或非金属。D、E、F是常见的三种氧化物,且有如图所示转化关系:则下列说法不正确的是
A.D、E中一定都含有A的元素
B.单质B肯定是氧化剂
C.A、B、C中一定有一种是氧元素的单质
D.若A是非金属,则B一定为金属
5.下列离子在溶液中能大量共存,加入(NH4)2Fe(SO4)2·6H2O晶体后,仍能大量共存的是
A.Na+ H+ Cl- NO3- B.K+ Ba+ OH- I-
C.Cu2+ Fe3+ Br- HCO3- D.Na+ Mg2+ Cl- SO42-
6.下列反应的离子方程式书写正确的是
A.98.3%的硫酸加入到稀氢氧化钡溶液中:
H+(aq)+OH-(aq)=H2O(aq) ΔH=-57.3KJ/mol
B.用两个铜电极电解稀盐酸:2Cl—+2H+![]() H2↑+C12↑
H2↑+C12↑
C.金溶于王水产生大量的AuCl4-离子和NO:
Au+4H++4Cl-+NO3-=AuCl4-+NO↑+2H2O
D.NaHCO3溶液与NaAlO2溶液混合产生白色沉淀:
AlO2-+HCO3-+H2O=Al(OH)3↓+CO2↑
二、选择题(本题包括9小题,共36分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
7.绿色化学己成为当前化学研究的热点和前沿,旨在从源头上消除污染,实现经济和社会可持续发展。而常温离子液体(ionic liquid)(也有称常温熔融盐)以其优异的理化特性最有可能使上述理想变为现实。1914年报道的第一种离子液体硝酸乙基铵〔(C2H5NH3)NO3〕离子液体其熔点为12℃。已知C2H5NH2结合质子的能力比NH3略强,下列有关硝酸乙基铵的说法正确的是
A.离子液体可以作为电池的电解质
B.硝酸乙基铵水溶液呈碱性
C.硝酸乙基铵水解的离子方程式或表示为:C2H5NH3++H2O=C2H5NH2+H3O+
D.相同温度下,相同物质的量浓度的硝酸乙基铵溶液和硝酸铵溶液前者的pH值小
8.用NA表示阿伏加德罗常数的值,下列说法正确的是
A.将9.2g N2O4晶体放入容器中,恢复到常温常压时,所含气体分子数为0.1 NA
B.标准状况下,22.4L苯中含有的碳碳双键数为3NA
C.标准状况下,2.24LNH3和CH4的混合气体,所含电子总数为NA
D.160gCuO加热到1273K时完全分解,若转移2 NA个电子,则反应方程式为:
2CuO![]() 2Cu+O2↑
2Cu+O2↑
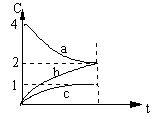 |
9.800℃时,a、b、c三种气态物质的浓度随时间变化
情况如图,由图分析不能得出的结论是
A.a是反应物
B.正反应是一个体积扩大的反应
C.若升高温度,a的转化率增大
D.若增大压强,a的转化率减小
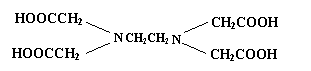 10.据世界卫生组织调查,缺铁性贫血是世界上最流行的营养性问题,一个简单的办法即是在普通酱油中加入无铁腥味、极易被人体吸收的添加剂——EDTAFeNa,其中EDTA结构(如下左图),酱油生产以后的废水可用物质绿色消毒剂(消毒后无公害)X(如下右图)来杀菌。
10.据世界卫生组织调查,缺铁性贫血是世界上最流行的营养性问题,一个简单的办法即是在普通酱油中加入无铁腥味、极易被人体吸收的添加剂——EDTAFeNa,其中EDTA结构(如下左图),酱油生产以后的废水可用物质绿色消毒剂(消毒后无公害)X(如下右图)来杀菌。
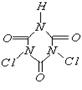
下列说法正确的是
A.1mol EDTA能与4mol NaOH发生反应
B.可用分液漏斗从铁强化酱油中分离出EDTAFeNa
C.EDTA和X在一定条件下均能发生水解反应
D.X起氧化杀菌作用的可能是其水解产物次氯酸
11.汞(熔点-39℃,沸点356℃)是制造电池、电极及温度计等的重要原料,工业上制粗汞的流程见下图,下列分析正确的是
 |
A.采用辰砂、生石灰混合焙烧生成,而不用在空气直接灼烧,因为辰砂在空气中加热不反应
B.辰砂与氧化钙加热,反应的方程式可能为:4HgS+4CaO=4Hg+3CaS+CaSO4
C.洗涤粗汞可用5%的盐酸代替5%的硝酸
D.在北极考察可使用水银温度计
12. 一些烷烃的燃烧热(KJ/mol)如下表:
| 化合物 | 燃烧热 | 化合物 | 燃烧热 |
| 甲烷 | 891.0 | 正丁烷 | 2878.0 |
| 乙烷 | 1560.8 | 异丁烷 | 2869.6 |
| 丙烷 | 2221.5 | 2-甲基丁烷 | 3531.3 |
下列表达正确的是
A.热稳定性:正丁烷<异丁烷
B.乙烷燃烧的热化学方程式为:
2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g) ΔH=-1560.8KJ/mol
C.正戊烷的燃烧热大约在3540 KJ/mol左右
D.相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多
13.下列有关实验的叙述中,不正确的有:
①蒸干AlCl3溶液可得纯净的无水氯化铝;②试管里加入少量淀粉,再加入一定量稀硫酸,加热3~4分钟,然后加入银氨溶液,片刻后管壁上有“银镜”出现;③无法用分液漏斗将甘油和水的混合液体分离;④用酸式滴定管量取20.00mL高锰酸钾酸性溶液;⑤为了测定某溶液的pH,将未经湿润的pH试纸浸入到待测溶液,过一会取出,与标准比色卡进行对比;⑥苯与溴水在铁粉的催化作用下制备溴苯;⑦配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止;⑧在苯酚溶液中滴入少量稀溴水溶液中立即出现白色沉淀。
A.4句 B.5句 C.6句 D.7句
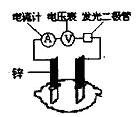
14.有甲、乙两位同学,他们一起做了水果电池的实验,测得数据如下:
| 实验次数 | 电极材料 | 水果品种 | 电极间 距/cm |
/mV | |
| 1 | 锌 | 铜 | 菠萝 | 3 | 900 |
| 2 | 锌 | 铜 | 苹果 | 3 | 650 |
| 3 | 锌 | 铜 | 柑 | 3 | 850 |
| 4 | 锌 | 铜 | 西红柿 | 3 | 750 |
| 5 | 锌 | 铝 | 菠萝 | 3 | 650 |
| 6 | 锌 | 铝 | 苹果 | 3 | 450 |
甲同学提出的问题,乙同学解释不正确的是
| 甲同学 | 乙同学 | |
| A | 实验6中的负极电极反应如何写? | 铝为负极:Al-3e-=Al3+ |
| B | 实验1,5电流方向为什么相反? | 1中锌为负极,电流由铜经导线到锌,5中铝为负极,铝失去电子,电流由锌经导线流向铝 |
| C | 水果电池的电压与哪些因素有关? | 只跟水果的类型有关 |
| D | 实验中发光二极管不太亮,如何使它更明亮起来? | 可用铜锌作电极,用菠萝作介质,并将多个此电池串联起来 |
15.煤气中毒的悲惨事件时有报道,市场上出现过一种CO检测器(主要成分PdCl2•2H2O 、CuCl2•2H2O、H8[Si(Mo2O7)6] •28H2O),其外观像一张塑料信用卡,正中有一个直径不到2cm的小窗口,露出橙红色固态物质(橙红色为复合色,不必细究)。若发现橙红色转为黑色且在短时间内不复原,表明室内CO浓度超标,有中毒的危险。CO不超标时,橙红色也会变黑却能很快复原。已知涉及的化学反应有:
CO + PdCl2•2H2O = CO2 +Pd(黑色) + 2HCl + H2O
Pd + 2CuCl2•2H2O = PdCl2•2H2O + 2 CuCl+2H2O
4 CuCl + 4HCl + 6H2O + O2 = 4CuCl2•2H2O
下列说法错误的是
A、该检测器为一次性使用仪器,当显示CO浓度超标后应再装一只新检测器
B、CO不超标时,橙红色变黑能很快复原是因为氧气浓度较大
C、CO超标时,橙红色变黑短时间不复原是因为CuCl2•2H2O的消耗速率小于生成速率
D、当浓度超标后,应立即打开窗户,再关闭阀门,过一段时间检测器小窗口又恢复橙红色
第Ⅱ卷(非选择题 共90分)
三、(本题包括两小题,共24分)
16.(10分)(一)“磨砂”是增加玻璃仪器密封性的一种处理工艺 ,可使仪器不漏液或不漏气。在下列仪器中:①试管②分液漏斗③细口试剂瓶④广口试剂瓶 ⑤集气瓶⑥滴瓶⑦酸式滴定管⑧碱式滴定管,肯定用不到“磨砂” 处理的有 (填序号)。
(二)某农资商店出售一种化肥,其有效成分为氯化铵,现欲测定该种化肥中氮元素的质量分数,设计实验步骤如下(杂质中不含氮元素,且杂质均不与盐酸或氢氧化钠溶液反应):
①配制1.00mol/L的HCl溶液和1.00mol/L的NaOH溶液;
②每次取1.00g此化肥样品,溶于20mL蒸馏水中;
③加入30.00mL1.00mol/L的NaOH溶液,将反应后的溶液加热煮沸约1分钟,冷却至常温;
④……………………;
⑤重复②③④步操作1-2次;
⑥记录整理实验所得数据,计算该化肥中氮元素的质量分数。
请回答下列问题:
(1)写出步骤④中的实验内容 ,写出实验步骤④中的离子方程式: 。
(2)步骤⑤的实验目的是 。
(3)若以Vx(mL)表示实验所测定消耗盐酸数据的平均值,该化肥样品中氮元素的质量分数计算表达式为 。(不需要化简)
17.(14分)在足量的稀氯化亚铁溶液中,加入1~2滴液溴,振荡后溶液变为黄色。
(1)甲同学认为这不是发生化学反应所致,使溶液变黄色的物质是: (填粒子的化学式,下同);
乙同学认为这是发生化学反应所致,使溶液变黄色的物是
(2)现提供以下试剂:
A.酸性高锰酸钾溶液 B.氢氧化钠溶液 C.四氯化碳 D.硫氰化钾溶液
请判断哪位同学的推断是正确的,并用两种方法加以验证,写出选用的试剂编号及实验中观察到的现象:
| 同学正确 | 选用试剂 | 实验现象 |
| 第一种方法 | ||
| 第二种方法 |
(3)若选用淀粉碘化钾溶液来判断哪位同学的推断是正确的,你认为是否可行? 理由是:
根据上述实验推测,若在稀溴化亚铁溶液中通入氯气,首先被氧化的离子是 写出在稀溴化亚铁溶液中通入足量氯气时的离子方程式:
四、(本题包括3小题,共32分)
18.(12分)(一)氢化铝锂(LiAlH4)是一种易燃易爆还原性极强的络合氢化物还原剂,广泛应用于化工、制药、精细有机化工等行业。在125oC时分解为氢气、金属铝及氢化锂(LiH)。
(1)写出氢化铝锂分解的化学方程式: ;每生成1molH2转移电子的物质的量为: 。
(2)氢化铝锂易水解得三种产物,写出其与水反应的化学方程式: 。
(二)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气),在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收原料气中的CO,其反应是:
[Cu(NH3)2Ac]+CO+NH3![]() [Cu(NH3)3]Ac·CO+Q
[Cu(NH3)3]Ac·CO+Q
(1)必须除去原料气中CO的原因是_____________________________
(2)醋酸二氨合铜(I)溶液吸收原料气中的CO的适宜条件是__________________
(3)吸收CO后的醋酸铜氨液经过适当处理又可再生,恢复其吸收CO的能力,以供循环使用,醋酸铜氨液再生的生产适宜条件应是___________________________。
![]() 19.(12分)有一化合物A ,其水溶液为浅绿色,可发生如下的转化关系。其中B、D、E为无色气体,W、K为常见的金属单质, C为难溶于水的红褐色固体。在混合液中加入BaCl2可生成不溶于稀HNO3的白色沉淀,H和W反应可放出大量的热。
19.(12分)有一化合物A ,其水溶液为浅绿色,可发生如下的转化关系。其中B、D、E为无色气体,W、K为常见的金属单质, C为难溶于水的红褐色固体。在混合液中加入BaCl2可生成不溶于稀HNO3的白色沉淀,H和W反应可放出大量的热。
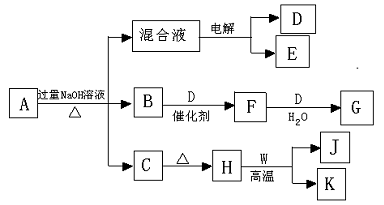 |
(1)写出下列物质的化学式:A F
(2)写出下列反应的化学方程式
J与NaOH
F→G
K与过量G溶液反应的离子方程式
(3)原混合液的体积为VmL,pH为a,密度为ρ1 g/mL,电解一段时间后,收集到D 的体积为bL(S.T.P),若此时溶液的密度为ρ2 g/mL,则此溶液的C(OH-)为 (用字母表示)。
20.(8分)(1)A、B、C、D、E、F均为短周期元素,原子序数依次递增。A元素原子核内无中子。B元素原子最外层电子数是次外层电子数的2倍。D元素是地壳里含量最多的元素。D与E的质子数之和为24。F的最高价氧化物的水化物为最强酸。
①推断E在元素周期表中的位置:第 周期, 族。
②A2D的沸点比A2E高的原因是 。
③A、C、F三元素形成的化合物CA4F,溶于水,所得溶液中各种离子物质的量浓度的大小顺序为(按从大到小的顺序排列) 。
④在101kPa时,1.4gBD气体在1.6gD2气体中完全燃烧,生成BD2气体时放出14.15kJ
热量,表示BD燃烧热的热化学方程式为: 。
五、(本题包括2小题,共16分)
21.(4分)已知反应CH3C≡CCH3+2H2→CH3(CH2)2CH3的△H=-278kJ/mol
反应CH2=CH-CH=CH2+2H2→CH3(CH2)2CH3的△H=-239kJ/mol
提示:化学反应总是向能量降低的方向进行
(1)如果1mol CH3CH2C≡CCH2CH2CH=CH-CH=CH2与2mol H2作用,其主要产物是_ __。
(2)如果CH3CHBrCHBrCH3与NaOH醇溶液共热后的主要产物是A,A的结构简式为:___ _。
22.(12分)2005年全世界石油价格居高不下,其主要原因是随着社会生产的发展,人口增多,对能源的需求量逐年增加,全球石油储量下降。化学工作者正在研究以天然气和醇类合成优质汽油的方法。
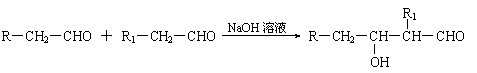 已知:⑴凡与醛基直接相连的碳原子上的氢称为α一H原子,在稀碱溶液的催化作用下,一个醛分子上的α一H原子连接到另一个醛分子的氧原子上,其余部分连接到羰基碳原子上生成羟基醛,如:
已知:⑴凡与醛基直接相连的碳原子上的氢称为α一H原子,在稀碱溶液的催化作用下,一个醛分子上的α一H原子连接到另一个醛分子的氧原子上,其余部分连接到羰基碳原子上生成羟基醛,如:
⑵
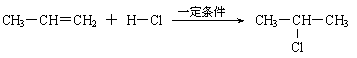 |
⑶
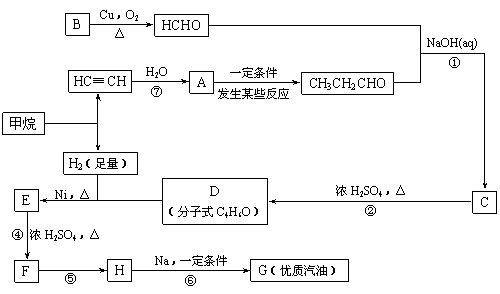 合成路线如下:
合成路线如下:
|
(1)写出D的结构简式
(2)在反应②~⑦中,属于加成反应的是 ,属于消去反应的是 。
(3)写出下列反应方程式
E → F: ;
H → G: 。
(4)H也能与NaOH溶液反应,其反应方程式为 。
六.(本题包括2小题,共18分)
23. (8分)若不慎发生砒霜泄露,应急的措施是采用石灰中和,使被污染的河水含砷量降低到国家允许的标准范围内,以消除可能会造成的危害。
测定砷是利用下述反应:AsO33- + I2 + H2O ⇌ AsO43- + 2I- +2H+ 这反应是可逆的,控制溶液的酸碱性,可以测定不同价态(+3或+5)的砷。
今有一试样,含As2O3的As2O5及其它对测定没有影响的杂质。将此试样用NaOH溶液溶解后,在中性溶液中用0.02000mol·L-1的I2-KI溶液滴定,用去25.00mL。滴定完毕后,使溶液呈酸性,加入过量的KI。由此析出的碘又用0.1250mol·L-1的Na2S2O3溶液滴定,用去24.00 mL。试计算试样中As2O3和As2O5的质量。
(已知2Na2S2O3 + I2 = Na2S4O6 + 2NaI)
24.(10分)氢气还原氧化铜的反应不完全时,便得到Cu、Cu2O、CuO的固体混合物。化学兴趣小组同学为探究上述固体的成分进行了如下操作和实验:
(1)取一定质量的均匀固体混合物A,将其分成两等份。
(2)取其中—份用足量的氢气还原,测得反应后固体质量减少3.20g。
(3)另一份加入500mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体 2.24L。
请回答以下问题:
(1)A中,n(Cu)+n(Cu2O)= 。
(2)A中,n(CuO)的取值范围是 。
|
 电压
电压