高考化学模拟题(七)
一、选择题(每题仅有一个选项符合题意):
1.Na2O2、HCl、Al2O3三种物质溶于水中,完全反应后,测得所得溶液中只含有AlO2-、Na+、Cl-(不考虑AlO2-的水解),则Na2O2、HCl、Al2O3的物质的之比
A.4:6:1 B.8:6:1 C.3:3:1 D.2:2:1
2.下列说法中正确的是
A.晶体中阳离子和阴离子个数不一定相等
B.晶体中一定只有离子键没有共价键
C.所含元素一定不在同一周期也不在第一周期
D.晶体中阳离子半径一定大于阴离子半径
3.下列物质的用途错误的是:①食盐可用于制纯碱;②活性炭作吸附剂;③硫酸铜可配制农药;④H2O2作医用消毒剂;⑤金属钠可用于制备NaOH;⑥NH3可用于致冷剂;⑦NaHCO3可用于灭火;⑧MgO、A12O3都可用于耐火材料;⑨硬铝可用于飞机制造业;⑩红磷可用于生产安全火柴
A.③⑤⑦ B.③⑦⑩ C.③⑤⑩ D.⑤
4.某溶液中只含有K+、SO32-、S2O32-、SO42-、Cl-五种离子:进行如下实验:①先向原溶液中加入过量盐酸,并将产生的气体全部收集;②向①中所得溶液中加入过量烧碱溶液;③将①中收集到的气体全部通入②所得的溶液中并完全被过量的烧碱吸收。最终溶液中的离子数目增加的是
A.只有SO32- B.只有C1- C.只有SO42- D.C1-和SO32-
|
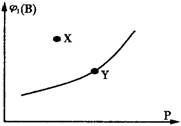
在一定温度下达到平衡时B的体积分数φ1(B)和压强P
的关系曲线如下图所示,则对该反应的下列叙述不正
确的是
A.(m+n)一定小于P
B.升高温度,B的体积分数增大
C.X点时该可逆反应:υ(正)>υ(逆)
D.Y点时可逆反应:υ(正)<υ(逆)
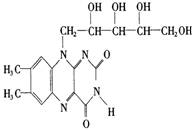 6.维生素B2也称“核黄素”,其结构如下图。维生素B2的磷酸盐衍生物是某些氧化还原酶的辅基,为生长必需物质,缺少维生素B2会引起口角炎、皮肤和眼部疾病。下列有关维生素B2的说法中正确的是
6.维生素B2也称“核黄素”,其结构如下图。维生素B2的磷酸盐衍生物是某些氧化还原酶的辅基,为生长必需物质,缺少维生素B2会引起口角炎、皮肤和眼部疾病。下列有关维生素B2的说法中正确的是
A.核黄素晶体属于离子晶体
B.核黄素能发生银镜反应
C.核黄素能被酸性高锰酸钾溶液氧化
D.核黄素能与氯化铁溶液作用呈紫色
7.陶瓷表面有一层绚丽多彩的彩釉,加工方法是在普通釉料中加入一些金属元素,控制烧制时空气的用量(即氧用量),使其得到不同的颜色。若空气不足,铁、铜、锰元素形成的化合物呈现的颜色分别是
A.蓝或绿、红、黑褐 B.红或黄、蓝、紫褐
C.蓝或绿、蓝、黑褐 D.红或黄、红、紫褐
8.电视剧《西游记》中仙境美仑美奂,这些神话仙境中所需的烟雾是用NH4NO3和Zn粉按质量比8:6.5混合放于温热的石棉网上,使用时滴水数滴即产生大量的白烟。又知发生反应后有N2和水生成。有关的说法中正确的是
①水起着溶解NH4NO3,发生吸热现象以启动反应的发生的作用;②每还原1molNO3-需氧化1molNH4+和1molZn;③成烟物质是两性氧化物小颗粒;④成烟物质是小锌粒,它由
 NH4NO3反应放热而蒸出。
NH4NO3反应放热而蒸出。
A.①② B.②③ C.③④ D.①④
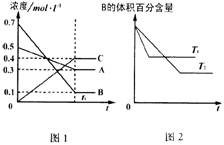
9.T℃时在1L密闭容器中A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,B的体积百分含量与时间的关系如图2所示。则下列结论正确的是
A.在达平衡后,保持其他条件不变,增大压强,平衡向逆反应方向移动
B.保持其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
C.T℃若由0.4mol·L –1A、0.4mol·L –1B、0.2mol·L –1C反应,达到平衡后,C的浓度仍为0.4mol·L –1
D.在达平衡后,保持压强不变,通入稀有气体,平衡向正反应方向移动
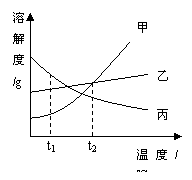 10.甲、乙、丙三种固体物质的溶解度曲线如右图所示,
10.甲、乙、丙三种固体物质的溶解度曲线如右图所示,
下列有关说法中正确的是
A.t1℃时甲物质的溶解度最大
B.乙物质的溶解度不随温度升降而变化
C.丙物质的溶解度随温度升高而降低
D.t2℃时甲、乙、丙三种物质的溶解度相等
11.某氢氧化钠溶液跟醋酸溶液混合后溶液呈酸性,
则混合溶液中离子的物质的量浓度之间关系一定正确的是CD
A.c(Na+)+c(H+)=c(CH3COO-) B.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.c(CH3COO-)>c(Na+)>c(H+)>c(OH-) D.c(H+)=c(CH3COO-)-c(Na+)+c(OH-)
12.臭氧分子的结构与SO2(极性分子)相似,可读做二氧化氧,在臭氧层中含量达0.2 ppm(ppm表示百万分之一)。臭氧是氧气吸收了太阳的波长小于242 nm的紫外线形成的,不过当波长在220 nm~320 nm的紫外线照射臭氧时,又会使其分解。下列说法中正确的是
A.打雷时也能产生臭氧,臭氧分子是直线型分子
B.臭氧转化为氧气和氧气转化为臭氧均须吸收能量
C.臭氧和氧气的相互转化能保持大气中臭氧的含量基本稳定
D.向大气中排放的氮的氧化物和氟氯代烃均能还原臭氧,使臭氧的量减少
13.常温下某溶液中由水电离产生的[H+]=1×10-5mol/L,则下列叙述正确的是
A.pH值为5 B.一定是酸溶液 C.可能是强酸的酸式盐溶液 D.PH值可能为9
14.下列说法正确的是
A.1molH2SO4与1mol Ba(OH)2完全中和所放出的热量为中和热
B.中和反应都是放热反应,盐类水解反应都是吸热反应
C.在101kPa1mol碳燃烧所放出的热量一定是碳的燃烧热
D.碳与二氧化碳的反应既是放热反应,也是化合反应
15.向含下列微粒的溶液中,①HS-、②Fe2+、③![]() 、④
、④![]() 分别加入少量氢氧化钠固体,或少量浓盐酸或几滴酸性KMnO4溶液。(溶液体积变化忽略不计),都使溶液中对应的离子或分子浓度减少的是
分别加入少量氢氧化钠固体,或少量浓盐酸或几滴酸性KMnO4溶液。(溶液体积变化忽略不计),都使溶液中对应的离子或分子浓度减少的是
A.①② B.②③ C.①④ D.③④
二、填空题:
16.⑴在定量实验中,采用下列操作会导致实验结果偏低的是 ABD (填代号)。
A.中和热测定实验中以环形铁丝搅拌棒代替环形玻璃搅拌棒
B.配制100mL 2 mol/L的NaCl溶液,以胶头滴管加水定容时,液面稍超出容量瓶刻度线,反复摇匀后,凹液面最低点恰好与刻度线平齐
C.测定硫酸铜晶体结晶水含量,加热并搅拌时,有少量固体溅出。
 D.称取一定质量无水碳酸钠粉末,用稀盐酸滴定(用甲基橙作指示剂),测定盐酸浓度。酸式滴定管用蒸馏水润洗后未用待装液润洗,立即装液、滴定。
D.称取一定质量无水碳酸钠粉末,用稀盐酸滴定(用甲基橙作指示剂),测定盐酸浓度。酸式滴定管用蒸馏水润洗后未用待装液润洗,立即装液、滴定。
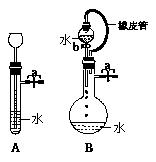
⑵根据右图描述回答下列问题:
①关闭图A装置中的止水夹a后,从长颈漏斗向试管
中注入一定量的水,静置后如图所示。试判断:A装置是
否漏气?(填“漏气”、“不漏气”或“不能确定”) 不漏气 ;
②关闭图B装置中的止水夹a后,开启活塞b,水不断
往下滴,直至全部流入烧瓶。试判断:B装置是否漏气?
(填“漏气”、“不漏气”或“不能确定”) 不能确定 ,判理由 不管装置是否漏气,烧瓶内气压与漏斗上方的气压相等,水在重力作用下可完全流入 。
三、推断题:
17.两种非金属元素X、Y在元素周期表中彼此相隔一个周期,它们的单质Xm、Yn和水在一定条件下能发生反应:Xm+Yn+H2O→HY+H3XO4+XH4Y(未配平)。(m、n均为大于1的正整数)
⑴若Xm、Yn在常温下均为常见固体,则Xm是 P4 ,Yn是 I2 ;
⑵试根据推断后,完成(配平)上述化学方程式:
P4+2I2+8H2O 2HI+2H3PO4+2PH4I
;
⑶试解释下列两反应能进行的原因:
①HY(aq)+NaH2XO4(aq)=H3XO4(aq)+NaY(aq),理由是 因为酸性(或电离程度)HI>H3PO4 ;
②H3XO4(浓)+NaY(固)=HY+NaH2XO4,理由是: 该反应在一定条件下是可逆反应,由于HI挥发,促进平衡朝生成正反应方向移动 。
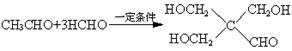
18.己知:①乙醛甲基上的氢原子都是α氢原子,活性较大,都可以与甲醛中的醛基发生加成反应。如:HCHO+CH3CHO![]() HO—CH2CH2—CHO
HO—CH2CH2—CHO
②
![]()
![]()
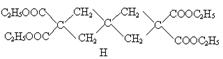
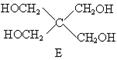
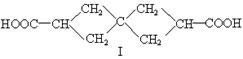
现由乙烯和丙二酸等物质合成Ⅰ,合成路线如下:
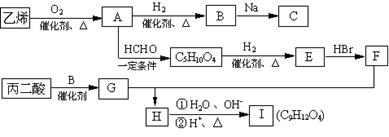
请回答下列问题:
⑴写出下列物质的结构简式:
E ,H ,I ;
⑵写出A→C5H10O4的化学方程式。
19.下面是关于硫化氢的部分文献资料
![]()
 某研究性学习小组对资料中“氢硫酸长期存放会变浑浊”这一记载十分感兴趣,为了探究其原因,他们分别做了如下实验:
某研究性学习小组对资料中“氢硫酸长期存放会变浑浊”这一记载十分感兴趣,为了探究其原因,他们分别做了如下实验:
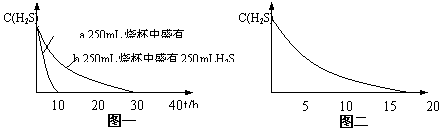 实验一:将H2S气体溶于蒸馏水制成氢硫酸饱和溶液,在空气中放置1~2天未见浑浊现象。用相同浓度的碘水去滴定氢硫酸溶液测其浓度。图一所示为两只烧杯中氢硫酸浓度随时间变化而减小的情况。
实验一:将H2S气体溶于蒸馏水制成氢硫酸饱和溶液,在空气中放置1~2天未见浑浊现象。用相同浓度的碘水去滴定氢硫酸溶液测其浓度。图一所示为两只烧杯中氢硫酸浓度随时间变化而减小的情况。
 |
实验二:密闭存放的氢硫酸,每天定时取1mL氢硫酸,
用相同浓度的碘水滴定,图二所示为氢硫酸浓度随放置天
数变化的情况。
实验三:在饱和氢硫酸溶液中以极慢的速度通入空气
(1~2个气泡/min),数小时未见变浑浊的现象。
实验四:盛满试剂瓶,密闭存放的饱和氢硫酸溶
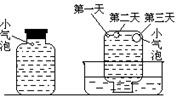 液隔2~3天观察,直到略显浑浊;当把满瓶的氢硫酸
液隔2~3天观察,直到略显浑浊;当把满瓶的氢硫酸
倒扣在培养皿中观察2~3天,在溶液略显浑浊的同时,
瓶底仅聚集有少量的气泡,随着时间的增加,这种气泡
也略有增多(大),浑浊现更明显些。请回答下列问题:
(1) 实验一(见图一)中,氢硫酸的浓度随时间变化而减小
的主要因素是 硫化氢的挥发 。
(2)实验一和实验二中,碘水与氢硫酸反应的化学方程式
为 H2S+I2==2HI+S↓ 。两个实验中准确判断碘水与氢硫酸
恰好完全反应是实验成功的关键。请设计实验方案,使实验者准确掌握所加碘水恰好与氢硫酸完全反应。 向氢硫酸中加入淀粉液,滴加碘水到溶液刚好呈蓝色 。
(3) “氢硫酸长期存放会变浑浊”中,出现浑浊现象是由于生成了S或硫的缘故。
(4)该研究性学习小组设计实验三说明他们认为“氢硫酸长期存放会变浑浊”的假设原因之一是(用文字说明) 氢硫酸被空气中氧气氧化 。此实验中通入空气的速度很慢的主要原因是什么? 防止因通入空气过快而使硫化氢大量挥发 。
(5)实验四的实验现象说明“氢硫酸长期存放会变浑浊”的主要原因可能是 硫化氢自身分解 。为进一步证实上述原因的准确性,你认为还应做哪些实验(只需用文字说明实验设想,不需要回答实际步骤和设计实验方案)? 确证生成的气体是氢气 。
[高考化学模拟题(七)答案]
一、选择题:
1.A 2.A 3.D 4.D 5.C 6.C 7.A 8.B 9.C 10.C 11.D 12.C 13.A 14.B 15.C
二、填空题:
16.⑴ABD
⑵①不漏气;
② 不能确定 ,判理由: 不管装置是否漏气,烧瓶内气压与漏斗上方的气压相等,水在重力作用下可完全流入 。
三、推断题:
17.⑴ P4 ;I2。 ⑵ P4+2I2+8H2O 2HI+2H3PO4+2PH4I;
⑶①因为酸性(或电离程度)HI>H3PO4;
② 该反应在一定条件下是可逆反应,由于HI挥发,促进平衡朝生成正反应方向移动 。
18. (1)
(1)
(2)(2分)
四、实验题:
19.⑴硫化氢的挥发;
⑵ H2S+I2==2HI+S↓; 向氢硫酸中加入淀粉液,滴加碘水到溶液刚好呈蓝色。
⑶S(或硫)。
⑷ 氢硫酸被空气中氧气氧化;
防止因通入空气过快而使硫化氢大量挥发 。
⑸硫化氢自身分解 ; 确证生成的气体是氢气。