高考化学试题 化学反应及其能量变化
硫代硫酸钠可作为脱氯剂,已知25.0mL 0.100 mol·L-1 Na2S2O3溶液恰好把224mL(标准状况下)Cl2完全转化为Cl-离子,则S2O32-将转化成
A.S2- B.S C.SO32- D.SO42-
在一定条件下,NO跟NH3可以发生反应生成N2和H2O。现有NO和NH3的混合物1 mol,充分反应后所得产物中,若经还原得到的N2比经氧化得到的N2多1.4g。
(1)写出反应的化学方程式并标出电子转移的方向和数目。
(2)若以上反应进行完全,试计算原反应混合物中NO与NH3的物质的量可能各是多少。
 得2e-×6
得2e-×6
答案:(1)6NO + 4NH3= 5N2 + 6H2O
失3e-×4
(2)0.3 mol NO和0.7 mol NH3,0.2 mol NH3和 0.8 mol NO
(1)分别写出由氧在一定条件下生成下列物质的化学方程式(必须注明反应条件)
① O3:_____________________. Na2O2____________________________。
② 指出氧在下列各物质中的化合价:O3___________;Na2O2___________;Na2O_________。
(2)KO2能吸收CO2生成K2CO3和O2,故可用作特殊情况下的氧气源,试写出该反应的化学方程式__________________。
(3)KO2能吸收CO2生成K2CO3和O2,故可用作特殊情况下的气氧气源,试写出该反应的化学方程式_______________。
![]()
![]()
![]()
![]()
![]()
![]() (4)人体内O2-离子对健康有害,使人过早衰老,但在催化剂SOD存在下可发生如下反应,请完成该反应的离子方
(4)人体内O2-离子对健康有害,使人过早衰老,但在催化剂SOD存在下可发生如下反应,请完成该反应的离子方
程式:
![]()
![]()
![]() O2-+ H2O= H2O2 + O2+
O2-+ H2O= H2O2 + O2+
答案:(1)①3O2 2O3 ②2Na +O2 Na2O2 ③4Na+O2 2Na2O
(2)0; -1; -2, (3)4KO2+2CO2=2K2CO3+3O2 ④ 2 O2- +2 H2O=1H2O2+ 1O2+2 OH-
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯。其变化可个表述为:
KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯。其变化可个表述为:
KClO3+ HCl(浓)= KCl + ClO2↑+ Cl2↑+
(1)请完成该化学方程式并配平(未知物化学式和系数填入框内)
(2)浓盐酸在反应中显示出来的性质是_______(填写编号,多选倒扣)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)产生0.1molCl2,则转移的电子的物质的量为_________mol.
(4)ClO2具有很强的氧化性。因此,常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是Cl2的
_______倍。
(1)2 4 2 2 1 2 H2O (2) ②(3)0.2 (4)2.63
化合物BrFx与水按物质的量之比3︰5 发生反应,其产物为溴酸、氢氟酸、单质溴和氧气。
(1)BrFx中,x= 。
(2)该反应的化学方程式是: 。
(3)此反应中的氧化剂和还原剂各是什么?氧化剂是 ;还原剂是
(1)3 (2)3BrF3+5H2O===HBrO3+9HF+Br2+O2↑(3)氧化剂BrF3;还原剂H2O、BrF3
化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如:
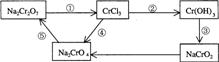
(l)在上述有编号的步骤中,需用还原剂的是 ,需用氧化剂的是 (填编号)。
(2)在上述循环中,既能与强酸反应又能与强碱反应的两性物质是 (填化学式)
(3)完成并配平步骤①的化学方程式,标出电子转移的方向和数目:
□Na2Cr2O7+□KI+□HCl→□CrCl3+□NaCl+□KCl+□I2+□
![]() 6e-
6e-
(1)①、④(2)Cr(OH)3(3)1 6 14 2 2 6 3 7H2O Na2Cr2O7 KI
下列化工生产过程所发生的反应不属于氧化还原反应的是
A.用油脂制肥皂 B.用铝土矿制金属铝
C.用氯气和消石灰制漂白粉 D.用氢气和氮气合成氨
三聚氰酸C3N3(OH)3可用于消除汽车尾气中的氮氧化物(如NO2)。当加热至一定温度时,它发生如下分解:C3N3(OH)3=3HNCO (异氰酸,其结构是H–N=C=O)能和NO2反应生成N2 、CO2和H2O。
(1)写出HNCO和NO2反应的化学方程式。分别指明化合物中哪种元素被氧化?哪种元素被还原?标出电子转移的方向和数目。
(2)如按上述反应式进行反应,试计算吸收![]() 气体所消耗的三聚氰酸的质量。
气体所消耗的三聚氰酸的质量。
 失8×3e-
失8×3e-
(1) 8HNCO+ 6NO2 = 7N2+8CO2+4H2O
得6×4e-
HNCO中的氮元素被氧化,NO2中的氮元素被还原。
(2)1.2 kg
已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:
Fe3+→Fe2+;MnO4-→Mn2+;Cl2→2Cl-;HNO3→NO。
如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是
A.Fe3+ B.MnO4- C.Cl2 D.HNO3
将NO3-+Zn+OH-+H2O→NH3+Zn(OH)42- 配平后,离子方程式中H2O的系数是
A.2 B.4 C.6 D.8
R、X、Y和Z是四种元素,其常见化合价均为+2价,且X2+与单质R不反应;X2++Z=X+Z2+;Y+Z2+=Y2++Z。这四种离子被还原成0价时表现的氧化性大小符合
A.R2+>X2+>Z2+>Y2+ B.X2+>R2+>Y2+>Z2+ C.Y2+>Z2+>R2+>X2+ D.Z2+>X2+>R2+>Y2+
在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢为原料制取氧气,当制得同温、同压下相同体积的氧气时,三个反应中转移的电子数之比为
A.1︰1︰1 B.2︰2︰1 C.2︰3︰1 D.4︰3︰2
13.(2002广东18)已知硫酸锰(MnSO4)和过硫酸钾(K2S2O7)两种盐溶液在银离子催化下可发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸。
(1)请写出并配平上述反应的化学方程式。
(2)此反应的还原剂是 ,它的氧化产物是 。
(3)此反应的离子反应方程式可表示为: 。
![]() (4)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有 。
(4)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有 。
![]() (1)2MnSO4+5K2S2O8+8H2O 2KMnO4+4K2SO4+8H2SO4
(1)2MnSO4+5K2S2O8+8H2O 2KMnO4+4K2SO4+8H2SO4
(2)MnSO4 KMnO4(3)2Mn2++5S2O82-+8H2O 2MnO4-+10SO42-+16H+
(4)盐酸、氯化钾
在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)某厂废水中含KCN,其浓度为650mg / L。现用氯氧化法处理,发生如下反应(其中N均为-3价):KCN+2KOH+Cl2 → KOCN+2KCl+H2O
被氧化的元素是 。
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气。请配平下列化学方程式,并标出电子转移方向和数目: KOCN+ KOH+ Cl2 → CO2 + N2 + KCl + H2O
(3)若处理上述废水20L,使KCN完全转化为无毒物质,至少需液氯 g。
(1)碳(或C)(2)![]() (3)35.5
(3)35.5
(1)2级反应池中,发生“生物硝化过程”,如果不考虑过程中硝化细菌的增殖,其净反应如下式所示:□NH4++□O2→□NO3-+□H++□H2O
①配平上面化学方程式,将系数填入方框中。
②将铵态氮中的1mg氮转化成硝酸根中的氮,需氧气多少毫克?
③为什么在反应中需要不断添加碱?
(2)3级反应池中发生的“生物反硝化过程”,通常需要外加甲醇,净反应如下所示:
□NH3-+5CH3OH→□N2+□CO2+□H2O+□OH-
配平上面化学方程式,将系数填入方框中。
(1)①1,2,1,2,1 ②4.57mg
③反应时产生H+,而本反应要求溶液保持碱性 (2)6,3,5,7,6
下列粒子在化学反应中既能显示氧化性又能显示还原性的是
A.Fe3+ B.Br- C.Al D.H2O2
在一定条件下,RO3n-和氟气可发生如下反应:RO3n-+F2+2OH - =RO4-+2F-+H2O。从而可知在RO3n-中,元素R的化合价是
A.+4 B. +5 C.+6 D.+7
ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的物质的量之比为
A.1︰1 B.2︰1 C.1︰2 D.2︰3
NaH是—种离子化合物,它跟水反应的方程式为:NaH+H2O→NaOH+H2↑,它也能跟液氨、乙醇等发生类似的反应,并都产生氢气。下列有关NaH的叙述错误的是
A.跟水反应时,水作氧化剂 B.NaH中H-半径比Li+半径小
C.跟液氨反应时,有NaNH2生成 D..跟乙醇反应时,NaH被氧化
实验室为监测空气中汞蒸气的含量;往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:4CuI+Hg→Cu2HgI4+2Cu
(1)上述反应产物Cu2HgI4中,Cu元素显 价。
(2)以上反应中的氧化剂为 ,当有1molCuI参与反应时,转移电子 mol。
(3)CuI可由Cu2+与I-直接反应制得,请配平下列反应的离子方程式。
Cu2++ I-→ CuI+ I3-
(1)+1 (2)CuI 0.5 (3)2 5 2 1
从矿物学资料查得,一定条件下自然界存在如下反应: 14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4 ,下列说法正确的是
A.Cu2S既是氧化产物又是还原产物 B. 5mol FeS2发生反应,有10mol电子转移
C. 产物中的SO42-离子有一部分是氧化产物 D. FeS2只作还原剂
某化学反应的反应物和产物如下:
KMnO4 + KI+ H2SO4→ MnSO4 + I2 + KIO3 + K2SO4 + H2O
(1)该反应的氧化剂是_____________________
(2)如果该反应方程式中I2和KIO3的系数都是5
①KMnO4的系数是______________②在下面的化学式上标出电子转移的方向和数目
KMnO4 + KI + H2SO4 →
(3)如果没有对该方程式中的某些系数作限定,可能的配平系数有许多组。原因是---------------------------。
![]() 40e-
40e-
(1)KMnO4 (2)① 8 ② KMnO4 KI (3)该反应式含两种氧化产物。二者的比例和氧化剂的用量都可发生变化。
实现下列变化既不需要另加入还原剂,也不需要另加入氧化剂的是
A.F2→F- B.HNO3→NO C.Mg→Mg2+ D.Na2O2→O2
将KCl和CrCl3两种固体混合物共熔制得化合物X,X由K、Cl、Cr元素组成。将1.892gX中Cr元素全部氧化成Cr2O72-, Cr2O72-可过量的KI中氧化出2.667g I2,反应的离子方程式是:Cr2O72-+6I-+14H+=2Cr3++3 I2+7H2O,如果取溶有1.892g X的溶液,加入过量的AgNO3,可得4.52gAgCl沉淀,则表示X组成的化学式为
A.K3Cr2Cl7 B.K3Cr2Cl5 C.K3Cr2Cl9 D.K2CrCl4
16、下列各组离子一定能大量共存的是
A、含有大量Fe3+的溶液中:NH4+、Na+、CI-、SCN-
B、在强碱溶液中:Na+、K+、AlO2-、CO32-
C、在c(H+)=10-13mol·L-1的溶液中:NH4+、Al3+、SO42-、NO3-
D、在pH=1的溶液中:K+、Fe2+、Cl-、NO3-
6、下列反应离子方程式正确的是
A、向氯化铝溶液中加入过量氢氧化钠溶液:Al3+ + 4OH- = AlO2- + 2H2O
B、向苯酚钠溶液中通入二氧化碳:CO2 + H2O + 2C6H5O- → 2C6H5OH + CO32-
C、向小苏打溶液中加入醋酸溶液:HCO3- + H+ = CO2↑+ H2O
D、向溴化亚铁溶液中通入过量氯气:Fe2+ + 2Br - + 2Cl2= Fe3+ +Br2 + 4Cl -
13.能正确表示下列反应的离子方程式是
A.甲酸钠溶液和盐酸反应:HCOO-+H+=HCOOH
B.硫化钠的第一步水解:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
C.醋酸钡溶液和硫酸反应:Ba2++SO![]() =BaSO4↓
=BaSO4↓
D.氢氧化钙溶液和碳酸氢镁反应: Ca2++OH-+HCO![]() =CaCO3↓+H2O
=CaCO3↓+H2O
11.已知KH和H2O反应生成H2和KOH,反应中1 mol KH
A.失去1 mol电子 B.得到1 mol电子 C.失去2 mol电子 D.没有电子得失
(05全国卷I)10.在pH=1的溶液中,可以大量共存的离子是
A.K+、Na+、SO42—、S2O32— B.NH4+、Mg2+、SO42—、Cl—
C.Na+、K+、HCO3—、Cl— D.K+、Na+、AlO2—、NO3—
11.能用离子方程式H++OH-=H2O表示的反应是
A 稀醋酸和稀氨水反应 B 稀硫酸和烧碱溶液反应
C 稀盐酸和氢氧化铜反应 D 稀硫酸和氢氧化钡溶液反应
(05江苏)8.在下列生成二氧化硫的反应中,反应物中的含硫物质被氧化的是
A 硫在空气中燃烧 B 铜片与浓硫酸共热
C 红热的木炭与浓硫酸反应 D 亚硫酸钠与稀硫酸反应
21.从海水中可以提取溴,主要反应为:2Br—+Cl2=2Cl—+Br2,下列说法正确的是
A.溴离子具有氧化性 B.氯气是还原剂
C.该反应属于复分解反应 D.氯气的氧化性比溴单质强
22.下列反应的现象描述与离子方程式都正确的是
A.金属镁与稀盐酸反应,有氢气产生:Mg + 2H++ 2Cl— == MgCl2 + H2↑
B.氯化钡溶液与硫酸反应,有白色沉淀产生;Ba2+ + SO42— == BaSO4↓
C.碳酸钠溶液与盐酸反应,有气泡逸出;Na2CO3 +2H+ == 2Na+ + H2O + CO2↑
D.过量铁粉与氯化铁溶液反应,溶液变浅绿色;Fe + Fe3+ == 2Fe2+
16.某溶液既能溶解Al(OH)3,又能溶解H2SiO3,在该溶液中可以大量共存的离子组是
A.K+、Na+、HCO![]() 、NO
、NO![]() B.Na+、SO
B.Na+、SO![]() 、Cl—、ClO—
、Cl—、ClO—
C.H+、Mg2+、SO![]() 、NO
、NO![]() D.Ag+、K+、NO
D.Ag+、K+、NO![]() 、Na+
、Na+
9.下列离子方程式正确的是
A.碳酸氢钠溶液与少量石灰水反应 HCO![]() + Ca2+ + OH— = CaCO3↓ + H2O
+ Ca2+ + OH— = CaCO3↓ + H2O
B.氯化铵与氢氧化钠两种浓溶液混合加热OH—
+ NH![]() △
H2O
+ NH3↑
△
H2O
+ NH3↑
C.氢氧化镁与稀硫酸反应 H+ + OH— = H2O
D.单质铜与稀硝酸反应 Cu + 2 H++ 2NO![]() = Cu2+ + 2NO↑+H2O
= Cu2+ + 2NO↑+H2O
7.已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2氧化性依次减弱。下列反应在水溶液中不可能发生的是
A.3 Cl2 + 6 FeI2 = 2FeCl3 + 4 FeI3 B.Cl2 + FeI2 = FeCl2 + I2
C.Co2O3 + 6 HCl = 2CoCl2 + Cl2↑+ 3H2O D.2Fe3+ + 2I— = 2Fe2+ + I2
3.氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3 + N2 + 3 C 高温 2 AlN + 3 CO 下列叙述正确的是
A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂 B.上述反应中每生成2 mol AlN,N2得到3 mol电子
C.氮化铝中氮元素的化合价为—3 D.氮化铝晶体属于分子晶体
8.下列各组离子在溶液中能大量共存的是
A.酸性溶液Na+、K+、MnO4—、Br— B.酸性溶液Fe3+、NH4+、SCN—、NO3—
C.碱性溶液Na+、K+、AlO2—、SO42— D.碱性溶液Ba2+、Na+、CO32—、Cl—
5、以下命题,违背化学变化规律的是( )
A、石墨制成金刚石 B、煤加氢变成人造石油
C、水变成汽油 D、干冰转化成原子晶体
13、下列离子方程式正确的是( )
A、碳酸氢钠溶液中加入盐酸 CO32- + 2H+ → CO2↑ + H2O
B、硫化亚铁与盐酸反应 S2- + 2H+ → H2S↑
C、苯酚钠溶于醋酸溶液 C6H5O- + CH3COOH → C6H5OH + CH3COO-
D、氯化亚铁溶液中通入少量氯气 Fe2+ + Cl2 → Fe3+ + 2Cl-
24、某一反应体系有反应物和生成物共五种物质:
O2、H2CrO4、Cr(OH)2、H2O、H2O2
已知该反应中H2O2只发生如下过程:H2O2→ O2
(1)该反应中的还原剂是 。
(2)该反应中,发生还原反应的过程是 → 。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目 。
(4)如反应转移了0.3mol电子,则产生的气体在标准状况下体积为 。
24、(本题共8分)
(1)H2O2 (2)H2CrO4 Cr(OH)3
(3)
(4)3.36L
(全国卷Ⅱ)12.某酒精厂由于管理不善,酒精滴漏到某种化学品上而酿成火灾。该化学品可能是
A.KMnO4 B.NaCl C.(NH4)2SO4 D.CH3COOH
13.已知充分燃烧a g 乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则
乙炔燃烧的热化学方程式正确的是
A.2C2H2(g) + 5O2(g) == 4CO2(g) + 2H2O(l);△H = -4b KJ/mol
B.C2H2(g) + 5/2O2(g) == 2CO2(g) + H2O(l);△H = 2b KJ/mol
C.2C2H2(g) + 5O2(g) == 4CO2(g) + 2H2O(l);△H = -2b KJ/mol
D.2C2H2(g) + 5O2(g) == 4CO2(g) + 2H2O(l);△H = b KJ/mol
(05江苏)4.氢气(H2)、一氧化碳(CO)、辛烷(C8H18)、甲烷(CH4)的热化学方程式分别为:
H2(g) + 1/2O2(g) = H2O(l);△H= —285.8 kJ/mol
CO(g) + 1/2O2(g) = CO2(g);△H= —283.0 kJ/mol
C8H18(l) + 25/2O2(g) = 8CO2(g) + 9 H2O(l);△H= —5518 kJ/mol
CH4(g) + 2 O2(g) = CO2(g) + 2 H2O(l);△H= —890.3 kJ/mol
相同质量的H2、CO、C8H18、CH4完全燃烧时,放出热量最少的是
A.H2(g) B.CO(g) C.C8H18(l) D.CH4(g)
(05北京)29.CO、CH4均为常见的可燃性气体。
(1)等体积的CO和CH4在相同条件下分别完全燃烧,转移的电子数之比是 。
(2)已知在101 kPa时,CO的燃烧热为283 kJ/mol。相同条件下,若2 molCH4完全燃烧生成液态水,所放出的热量为1 mol CO完全燃烧放出热量的6.30 倍,CH4完全燃烧反应的热化学方程式是:
。
(3)120℃、101 kPa下,a mL由CO、CH4组成的混合气体在bmL O2中完全燃烧后,恢复到原温度和压强。
① 若混合气体与O2恰好完全反应,产生b mL CO2,则混合气体中CH4的体积分数为 (保留2位小数)。
② 若燃烧后气体体积缩小了a/4 mL ,则a与b关系的数学表示式是 。
29.⑴ 1:4 ⑵ CH4(g) + 2O2(g) == CO2(g) + 2H2O(l);△H = -891KJ/mol
⑶ ① 0.33 ② b≥5a/4
27、(14分)
化合物KxFe(C2O4)y· zH2O是一种重要的光化学试剂,其中铁为+3价。分别称取该样品0.49lg两份,其中一份在110℃干燥脱水,至质量恒定为0.437g。另一份置于锥形瓶中,加入足量的3 mol·L-1 H2SO4和适量的蒸馏水,加热至75℃,趁热加入0.0500mol·L-1KMnO4溶液24.0mL,恰好完全反应;再向溶液中加入适量的某种还原剂,将Fe3-完全转化为Fe2+,该溶液中Fe2+刚好与4.0 mL0.0500mol·L-1KMnO4溶液完全反应。
通过计算,分别求:
(1)0.49lg样品中结晶水的物质的量。
(2)化合物中草酸根的质量分数。
(3)化合物的化学式。
己知:2 KMnO4 + 5 H2C2O4 + 3H2SO4 = 2MnSO4 + K2SO4 + 10CO2↑+ 8H2O
MnO4- +5Fe2++8H+=Mn2+ + 5Fe3+ + 4H2O
27. (1) n(H2O) = ![]()
(2) n(C2O42-) = 0.0500 mol·L-1×0.024 L×![]()
m(C2O42-) = 0.003 mol ×88 g·mol-1 = 0.264g
ω(C2O42-) =![]() ×100% = 53.8 %
×100% = 53.8 %
(3) 因为n(Fe3+) = n(Fe2+) = 0.0500 mol·L-1×0.004 L×5 = 0.00100 mol
1 :y :z = 0.00100 mol :0.00300 mol :0.00300 mol = 1 :3 :3
则 y = 3 , z = 3
根据电荷平衡有:x + 3 = 2y,得x = 3
所以,化合物的化学式为:K3Fe(C2O4)3·3H2O