氮族元素专题训练(非选择题)
1.将23.9g表面已锈蚀成铜绿![]() 的铜片投入120mL一定浓度的硝酸中,充分反应后,硝酸被还原成
的铜片投入120mL一定浓度的硝酸中,充分反应后,硝酸被还原成![]() 和NO,反应后溶液中
和NO,反应后溶液中![]() 为0.160mol。往反应后的溶液中加入过量的NaOH溶液,滤出沉淀,洗涤、干燥后得到29.4g蓝色固体。求:
为0.160mol。往反应后的溶液中加入过量的NaOH溶液,滤出沉淀,洗涤、干燥后得到29.4g蓝色固体。求:
(1)铜片中单质铜的质量分数;
(2)铜片与硝酸充分反应后,溶液中![]() 的物质的量浓度(假设反应前溶液的体积不变)。
的物质的量浓度(假设反应前溶液的体积不变)。
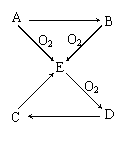 2.已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素。
2.已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素。
(1)若A为固体单质,则①D的分子式为 ,
② C→E的化学方程式为
③ 将E通入某些单质的溶液中,可发生反应生成两种强酸,试举一例写出化学方程式 。
(2)若A为气体单质,则
① D→C的化学方程式
② C→E的离子方程式为 。
3. A、B两种气体组成的混合气体(相对分子质量A大于B),只含氮氢两种元素。不论A、B以何种比例混合,混合气体中氮氢两种元素的质量比始终大于14∶3,则A为 ,B为 (填化学式)。若混合气体中氮氢两元素的质量之比为14∶1,则混合气体中A、B的物质的量之比为 。
4. 把3体积NO2气体依次通过装有足量NaHCO3饱和溶液、浓H2SO4和Na2O2的三个装置,最后用排水法收集,假设氮的氧化物不与Na2O2反应,最后收集到 体积的气体,该气体的组成为 。
5. 在盛稀硫酸的试管中,加入一小块铜片后,观察不到明显的现象。然后再加入适量硝酸钾晶体并微热,可观察到的现象是① ,② ,③ 。写出反应的离子方程式 。
6. 某学生课外活动小组利用右图所示装置分别做如下实验:
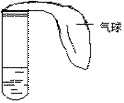 ⑴在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢
复红色,则原溶液可能是________________溶液;加热时溶液由红色逐渐变浅的原因是:________ _______
_______________。
⑴在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢
复红色,则原溶液可能是________________溶液;加热时溶液由红色逐渐变浅的原因是:________ _______
_______________。
⑵在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复
无色,则此溶液可能是________________溶液;加热时溶液由无色变
为红色的原因是: ____________________________________。
7. 分别将等质量的铜片与等体积均过量的浓硝酸、稀硝酸反应,所得到的溶液前者成绿色,后者呈蓝色,某同学提出这可能是![]() 浓度差异引起的,你同意这种看法吗?__________(填“同意”或“不同意”),原因是________________________;另一同学提出溶液呈“绿色”是
浓度差异引起的,你同意这种看法吗?__________(填“同意”或“不同意”),原因是________________________;另一同学提出溶液呈“绿色”是![]() 与
与![]() 混合的结果,请你设计一个实验证明之(简述实验方案和实现现象)_____________________________________________________________。
混合的结果,请你设计一个实验证明之(简述实验方案和实现现象)_____________________________________________________________。
8. 室温时,在容积为90mL的大试管里充满NO2气体,然后倒置在水里,至试管内液面不在上升时,再通入一定量O2,则试管内液面继续上升,最后试管内留有10mL气体。问:(1)这10mL可能是什么气体?(2)通入O2的体积为多少?
9. 为了配制一种需含NaH2PO4和Na2HPO4(它们的物质的量之比为3:1)的培养液,已知每升混合液中含磷元素0.10摩尔。现在用4.0摩尔/升的磷酸溶液和固体NaOH反应来配制2.0升混合液,求需该磷酸溶液多少毫升和NaOH多少克?
10. 某试剂厂用银(含杂质铜)和硝酸(含杂质Fe3+反应制取硝酸银.步骤如下:
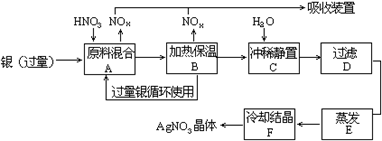
依据上述步骤,完成下列填空:
(1)(1)溶解银的硝酸应该用 硝酸(填浓或稀),原因是 。
(a)减少过程中产生NOx 的量 (b) 减少原料银的消耗量 (c)节省硝酸物质的量
(2)(2)步骤B加热保温的作用是 .
(a)有利于加快反应速度 (b)有利于未反应的硝酸挥发 (c)有利于硝酸充分反应,降低溶液中c(H+)
(3)(3)步骤C是为了除去Fe3+、Cu2+ 等杂质.冲稀静置时发生的化学反应是 (选类型),产生的沉淀物化学式 。
(a)置换反应 (b)水解反应 (c)氧化—还原反应
11. 铵盐受热分解,如图实验装置是验证氯化铵受热产生的气体是氨气和氯化氢,并将产生的气体重新化合生成氯化铵。
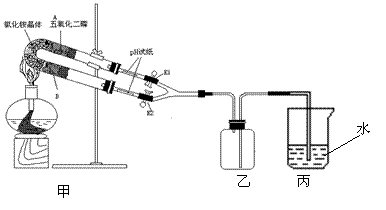 |
(1)U形管B处所盛放的固体物质是 。
(2)证明氯化铵受热产生的气体是氨气和氯化氢的操作和现象是:①
,当 说明有HCl生成;②
,当 说明有NH3生成。
③若要在乙瓶中观察HCl和NH3重新化合生成NH4Cl的实验现象,请依据以上的实验装置写出有关的实验步骤和实验现象。
12. 为验证氨气的还原性,某同学用一瓶NH3和一瓶Cl2如
右图所示进行实验,请判断该同学的实验能否成功? 。若能
成功,请回答下列问题:
(1)该反应的方程式为
(2)实验的现象为
(3)为使实验的效果更加明显,上面的集气瓶盛哪种气体好一些?
13.实验室里用空气和下列药品,仪器装置制取少量氮化镁
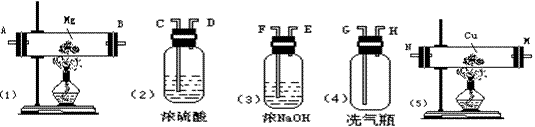 |
⑴当装置按顺序连接好后,首先应检查气密性,然后进行实验
a.如果所制气体的流向从左向右时,上述各仪器的正确连接顺序是(填接口代号) 。
b.实验开始,应先在(写序号) 处接通空气自来水管,然后依次点燃装有(写元素符号) 粉装置的酒精灯和装有 粉装置的酒精灯。
⑵浓硫酸的作用是 ,饱和NaOH溶液的作用 ,装置⑤的作用 。
⑶装置①中发生反应的化学方程式是 。
⑷制成Mg3N2后剩余的气体是 。
14.有一无色干燥的混合气体,可能是由HCl、NO、NO2、CO2、NH3、H2、O2、Cl2中的几种混合而成,根据①把混和气体通过浓H2SO4时,气体体积明显减小。②再通入过量碱石灰时,体积又明显减小;③剩余气体接触空气时,立即变为红棕色,可得:混和气体中一定存在 ,一定不存在 ,可能存在 。
15. 某无色透明溶液,可能含有NO3![]() 、CO3
、CO3![]() 、I
、I![]() 、PO4
、PO4![]() 、OH
、OH![]() 等阴离子中的几种,有关实验如下:(1)取样,滴加酚酞,溶液显红色;(2)再取样,滴加稀HNO3,调节PH值至7,再滴加AgNO3溶液有黄色沉淀,继续滴加稀HNO3,沉淀全部溶解,在加酸过程中未见有气泡产生。
等阴离子中的几种,有关实验如下:(1)取样,滴加酚酞,溶液显红色;(2)再取样,滴加稀HNO3,调节PH值至7,再滴加AgNO3溶液有黄色沉淀,继续滴加稀HNO3,沉淀全部溶解,在加酸过程中未见有气泡产生。
则上述溶液中肯定存在离子 ,不存在离子 。可能存在的离子是 。
16.实验室用N2、H2合成氨气,并用酚酞试液检验生成的氨气,用锌与盐酸反应制取氢气;用NaNO2饱和溶液和NH4Cl饱和溶液共热制取氮气:
![]() NaNO2+NH4Cl=NaCl
+ NH4NO2
NaNO2+NH4Cl=NaCl
+ NH4NO2
NH4NO2 N2↑+2H2O。
制取装置如图所示:
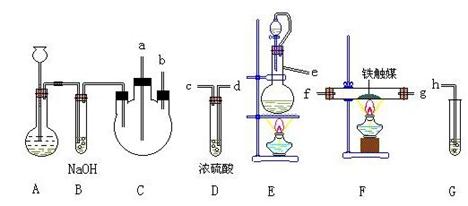
(1)装置A用于制取
(2)装置E中分液漏斗上方常用导管与园底烧瓶相通,作用是 。装置E与装置C直接相连,连接时导管口连接方法为e接 。
(3)装置C的另一接口与其他仪器装置相连接时,导管口的连接顺序为:
另一接口 接 , 接 , 接 。
(4)装置D的作用为 。装置F导出的气体的成分为
(5)装置G内滴有酚酞的试液,用于检验氨气的生成,该装置中导管口能否插入液面以下 (填“能”或“不能”),理由是 。
(6)从充分利用原料的角度看,装置G应装双孔塞,此时另一接口应与 为佳。
氮族元素专题训练答案(非选择题)
1.分析: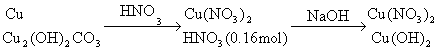
![]()
设铜片中含铜为xmol,含![]() 为ymol,有
为ymol,有
![]()
(1)
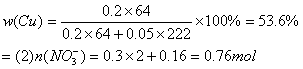
(2)![]()
2.(1)①SO3 ②Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O ③SO2+Cl2+2H2O=2HCl+H2SO4
(2)①3NO2+H2O=2HNO3+NO ②3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3.N2;NH3;1∶1。
4.1/4;O2。
5.① 铜片逐渐溶解,② 溶液变为蓝色,③ 产生无色气体且该气体在试管上部变为红棕色。3Cu+2NO3-+8H![]() =3Cu
=3Cu![]() +2NO↑+4H2O,2NO+O2=2NO2
+2NO↑+4H2O,2NO+O2=2NO2
6.(1)稀氨水和酚酞
稀氨水中的NH3气逸出,所以溶液的颜色变浅
(2)溶有SO2的品红
SO2气体逸出,品红溶液恢复红色
7.不同意;铜片质量相同,溶液体积相同,生成的![]() 浓度相同;加热绿色溶液,有红棕色气体产生,溶液变成蓝色
浓度相同;加热绿色溶液,有红棕色气体产生,溶液变成蓝色
8.液面不在上升时剩余气体为NO,设为x mL
3NO2+H2O=NO+2HNO3 3mL:1mL=90mL:x x =30mL(2分)
因4NO+3O2+2H2O==4HNO3 4NO+3O2→4HNO3
故10mL气体有两种可能,即可能为NO或O2(2分)
若为NO,设氧为ymL 则4:3=(30mL-10mL):y y =15mL(3分)
若为O2,则先消耗O2
z mL 4:3=30mL:z z
=22.5mL(3分)
所以共有O2:22.5mL+10mL=32.5mL(1分)
答:(1)这10mL气体可能为NO或O2
(2) 若10mL气体为NO, 则通入的O2为15mL;若10mL气体为O2,
则通入的O2为32.5mL(1分)
9.50mL,10g。
解析:反应方程式分别为:
NaOH+H3PO4=NaH2PO4+H2O NaOH+NaH2PO4=Na2HPO4+H2O
4mol 4mol 4mol 1mol 1mol
按上述量反应可实现两盐之比为3:1,同时知
NaOH──H3PO4,设需NaOH的物质的量为x。
5mol 4mol
x
(2´0.1)mol(2升含P0.1摩尔/升的P的物质的量也等于H3PO4的物质的量)
解得:x=0.25mol,即W(NaOH)=40´0.25=10(克),需要磷酸得体积为:
4V=2´0.1,V=0.05(升)
10.(1)稀;a、c (2)a、c (3) b Fe(OH)3 Cu(OH)2
11.解析:结合实验目的,从给出的装置分析,U形管中A处P2O5作用在于吸收NH3,此管中导出HCl气体,可以用湿润的pH试纸检验,因此U形管B处应用碱石灰吸收HCl,此管中导出NH3,可以用湿润的pH试纸检验,为了观察到在乙瓶中有白烟生成,应先向乙瓶中通入HCl气体,当充满时再充入NH3,这样不会在导管中生成大量NH4Cl堵塞导管。
答案:(1)碱石灰 (2)①打开K1关闭K2;湿润的pH试纸变红;②打开K2,关闭K1;湿润的pH试纸变蓝 (3)先关K2,打开K1,当丙中导管上方有的雾时,关闭K1,打开K2,观察到乙中有的烟生成。
12.能(1)8NH3+3Cl2=6NH4Cl+N2
(2)黄绿色消失,瓶内有白烟生成
(3)Cl2
13.(1) G→H→F→E→C→D→N→M→A G;Cu;Mg
(2)
|
(3) 3Mg+N2=Mg3N2
(4) N2
14. NH3、CO2、NO,HCl、Cl2、NO2、O2, H2 。
15. PO43—、OH—,I—、CO32— ,NO3—。
16.(1) H2
(2)便于液体顺序流下。 b 。
(3) a 接 d , c 接 f , g 接 h 。
(4) 干燥N2、H2 。 NH3、H2、N2
(5) 不能 , 氨气极易溶于水而发生倒吸 。
(6) d相连 。