高三年级月考(11月)试题
电解质溶液检测题
(时间:90分钟 总分:100分) 命题:汤立波
一、 选择题.(每题只有一个正确答案,每小题2分.共50分)
1、下列有关叙述中正确的是: ( )
A.难溶于水的电解质一定是弱电解质
B.强电解质的水溶液导电能力一定比弱电解质水溶液的导电能力强
C.易溶于水的电解质一定是强电解质
D.强电解质在水溶液中的电离过程是不可逆的
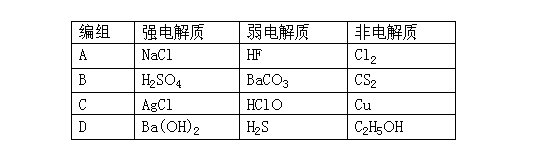
2.下列物质的分类组合全部正确的是
( ) 
3.下列物质的水溶液中,除水分子外,不存在其它分子的是 ( )
A.KF B.NaHS C.H3PO4 D.HNO3
4、下列电离方程式书写正确的是 ( )
![]() A. Na2HPO4溶于水:Na2HPO4 2Na++H++PO43-
A. Na2HPO4溶于水:Na2HPO4 2Na++H++PO43-
![]() B .NaHSO4溶于水: NaHSO4
Na++H++SO42-
B .NaHSO4溶于水: NaHSO4
Na++H++SO42-
![]() C. HF溶于少量水:2HF H++HF2-
C. HF溶于少量水:2HF H++HF2-
![]() D .(NH4)2SO4溶于水:(NH4)2SO4 NH4++SO42-
D .(NH4)2SO4溶于水:(NH4)2SO4 NH4++SO42-
5、等物质的量浓度的下列溶液中,NH4+的物质的量浓度最大的是 ( )
A.NH4HCO3 B.NH4Cl C.NH3H2O D.NH4HSO4
6、MgCl2酸性溶液中含有FeCl3杂质,为了得到纯净的MgCl2溶液,可加入下列物质的是 ( )
A.CaO B. Fe2O3 C. Mg(OH)2 D . NaOH
7、下列性质中不能证明一元酸HA是弱电解质的是 ( )
A .HA能与水任意比例互溶 B. 0.1mol/LHA溶液的pH =2
C.1.0L 1mol/LHA与1.0L 1mol/LNaOH的溶液完全反应, 所得溶液pH>7.
D.在相同的条件下,HA的导电性比一元强酸的导电性弱
8、在某温度时,测得纯水中的c(H+)=2.4×10-7 mol/L,则纯水中的c(OH-)为 ( )
A.2.4×10-7 mol/L B.0.1×10-7 mol/L C.![]() mol/L D.c(OH-)无法确定
mol/L D.c(OH-)无法确定
9、在同体积pH=3的H2SO4、HCl、HNO3、CH3COOH溶液中,加入足量锌粉,下列说法正确的是: ( )
A. H2SO4中放出H2最多 B. 醋酸中放出H2最多
C. HCl和HNO3放出H2一样多 D .HCl比H2SO4放出H2多
10.把pH=3的盐酸和pH=10的Ba(OH)2溶液混合,若混合溶液的pH为7,则盐酸和Ba(OH)2溶液的体积比是 ( )
A.1:10 B.1:5 C.1:2 D.2:1
11、用物质的量各为0.1 mol的CH3COOH和CH3COONa配成1L混合溶液,已知其中c(CH3COO-)大于c(Na+),对该混合溶液的下列判断正确的是 ( )
A.c(H+)<c(OH-) B.c(CH3COO-)+C(CH3COOH)=0.2 mol/L
C.c(CH3COOH)>c(CH3COO-) D.c(CH3COO-)+ c(OH-)= 0.1 mol/L
12、在Na2S溶液中c(Na+)与c(S2-)的比值是: ( )
A .2 B. 小于2 C.大于2 D.1/2
13、100mL0.1mol/L醋酸与50mL0.2mol/LNaOH溶液混合,在所得溶液中: ( )
A. c(Na+) >c(CH3COO-)>c(OH-)> c(H+)
B. c(Na+) >c(CH3COO-)>c(H+)> c(OH-)
C .c(Na+) >c(CH3COO-)>c(OH-)= c(H+)
D .c(Na+) =c(CH3COO-)>c(OH-)> c(H+)
14.FeCl3溶液与Fe(OH)3胶体共同具备的性质是 ( )
A.分散质的微粒都可通过半透膜
B.都比较稳定,密封一段时间也不会产生沉淀
C.有丁达尔现象
D.加入盐酸先产生沉淀,后沉淀溶解
15.用阳极甲、阴极乙、电解质溶液丙,在电解过程中补充加入丁物质(纯),可以使电解液的组成保持恒定.下列答案正确的是 ( )
甲 乙
丙 丁
A.Pt Pt KOH KOH
B.Cu Fe CuSO4 CuSO4
C.Pt C H2SO4
H2O
D.C Fe NaCl NaCl
16.在下列情况下,溶液的pH减小的是 ( )
A.NaOH浓溶液加水稀释
B.Zn、Cu和稀H2SO4组成的原电池放电
C.用Pt电极电解KCl的水溶液
D.FeCl3溶液中加入水
17.某地的酸雨中,含c(Ca2+)=3.6×10-6 mol/L,c(Cl-) = 3.5×10-6 mol/L,c(NH4+)=0.8×10-6 mol/L,c(NO3-)=4.5×10-6 mol/L,c(SO42-)=5×10-6 mol/L,则该地酸雨的pH为 ( )
A.3 B.4 C.5 D.6
18.用铅蓄电池作电源时,正极材料是PbO2,负极材料是Pb,其放电过程可以表示为:Pb+PbO2+2H2SO4===2PbSO4+2H2O充电时发生还原反应的电极方程式为 ( )
A.Pb-2e-===Pb2+
![]()
C.PbO2+4H++2e-
===Pb2++2H2O
D.PbSO4+2e-
===Pb+SO42-
19.钢铁表面吸附了中性水膜发生电化腐蚀.这时①铁作正极被氧化,②铁作负极被氧化,③水膜中有气体析出.④空气中某成分气体被还原.其中正确的是 ( )
A.①③ B.②④ C.②③ D.①④
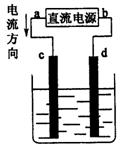
|
A.a为负极、b为正极
B.c为阳极、d为阴极
C.电解过程中,c电极质量增加
D.电解过程中,氯离子浓度不变
21.下列关于铜电极的叙述,正确的是 ( )
A.铜锌原电池中铜为负极,发生氧化反应
B.用电解法精炼粗铜时,粗铜作阴极
C.在镀件上电镀铜时,可用精铜作阳极
D.电解稀H2SO4制H2、O2时,可用铜作阳极
22、用pH试纸测定某无色溶液的pH值时,规范的操作是: ( )
A.将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较
B.将溶液倒在pH试纸上,跟标准比色卡比较
C.用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上跟标准比色卡比较
D.在试管内放入少量溶液,煮沸,把pH试纸放在管口,观察颜色,跟标准比色卡比较
23、下列实验操作中所用的仪器合理的是 ( )
A.用25 mL的碱式滴定管量取14.80 mL的NaOH溶液 B.用100 mL的量筒量取5.2 mL盐酸
C.用托盘天平称取25.20 g氯化钠 D.用100 mL容量瓶配制50 mL 0.1 mol/L
24、用标准NaOH溶液滴定未知浓度的盐酸溶液,以测定盐酸的浓度,下列操作使测定结果偏高的是: ( )
A. 未知浓度盐酸用滴定管量取,该滴定管用蒸馏水洗涤后未用待测液润洗
B .装待测液的锥形瓶,洗涤后未干就盛入待测液
C .滴定结束时,用俯视法观察碱式滴定管刻度,其余操作正确
D. 滴定结束后,发现碱式滴定管尖嘴处悬挂一滴碱液
25.下列操作会引起实验误差的是 ( )
A.进行中和滴定时,直接向刚洗净的锥形瓶中加待测液
B.滴定未知浓度盐酸所用的0.05mol/LNaOH溶液, 在配制标准液时因与空气 接触吸收了少量的CO2
C.用标准NaOH溶液滴定未知浓度的稀H2SO4时,用酚酞作指示剂
D.往洗净的滴定管中,直接加入标准液.
二.填空题.(共40分)
26.(4分)下列各物质的溶液物质的量浓度均为0.1mol/L.
①HCOOH ②NaOH ③Na2CO3 ④CH3COONa
⑤NH4Cl ⑥Ba(OH)2 ⑦KCl ⑧CH3COOH
按它们pH由小到大的排列顺序为 (填序号).
27.(6分)某同学在实验室测定某溶液的pH,在实验时先用水润湿pH试纸,然后再用洁净的玻璃棒蘸取溶液进行测定。
①该同学的操作 (填“正确”或“错误”)若不正确请说明理由,正确则不答此题
②若按此法测定c(H+)相等的盐酸和醋酸溶液的pH,误差较大的是 原因
28.(5分)电子表和电子计算器常用微型银-锌原电池,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,电极反应分别为:
Zn+2OH--2e-
=ZnO+H2O Ag2O+H2O+2e-
=2Ag+2OH-
总的化学方程式为: .
根据上述变化判断电极材料:正极为 ,负极为 ,工作时 极附近溶液的pH减小.
29.(6分)用铂电极电解KI溶液时,其电极反应表示为:阴极 ;阳极 ;
电解总的化学方程式为 ___.
30.(8分) 用铜电极电解K2SO4溶液; 通电开始时, 其电极反应表示为: 阴极 ___________ ;阳极 .向阴极溶液中滴入酚酞,则显 色,原因是 ;阳极附近的溶液出现 色,原因是 .
31.(11分) 工业制备氯化铜时,将浓盐酸用蒸气加热至80℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO)充分搅拌,使之溶解,得一强酸性的混合溶液,现欲从该该混合溶液中制备纯净的CuCl2溶液,采用以下步骤[参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3+完全水解成Fe(OH)3。]请回答以下问题
(1)第一步除去Fe2+,能否直接调整pH=9.6将Fe2+沉淀除去? ,理由是 ,有人用强氧化剂NaClO将Fe2+氧化为Fe3+:
①加入NaClO后,溶液的pH变化是 (填代号)
A.一定增大 B.一定减小 C.可能增大 D.可能减小
②你认为用NaClO作氧化剂是否妥当? ,理由是 _____________________________________________ 现有下列几种常用的氧化剂,可用于除去混合溶液中Fe2+的有 (有几个选几个填代号)
A.浓HNO3 B.KMnO4 C.Cl2 D.O2 E.H2O2
(2)除去溶液中的Fe3+的方法是调整溶液的pH=3.7,现有下列试剂均可以使强酸性溶液的pH的调整到3.7,可选用的有 (多选不限,填代号)
A. NaOH B.氨气 C.Cu(OH)2CO3 D.Na2CO3 E.CuO F.Cu(OH)2
三. 实验题. (共10分)
32.(10分)某学生用0.1mol/L的KOH标准溶液滴定未知浓度盐酸,其操作可分解为如下几步:
A. 移取20mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞
B 用标准溶液润洗滴定管2~3次
C 把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液
D 取标准KOH溶液注入碱式滴定管至刻度0以上2~3cm
E 调节液面至0或0以下刻度,记下读数
F 把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。就此实验完成填空:
⑴正确操作步骤的顺序是(用序号字母填写)_____________。
⑵上述B步骤操作的目的是_____________________________。
⑶上述A步骤操作之前,先用待测溶液润洗锥形瓶,则对滴定结果的影响是__________________________ 。
⑷判断到达滴定终点的实验现象是:_______________________________。
⑸若称量一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸则对滴定结果的影响是______________________________________。
参考答案
选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| D | D | D | B | D | C | A | A | B | A |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| B | C | A | B | C | A | C | D | B | B |
| 21 | 22 | 23 | 24 | 25 | |||||
| C | C | A | D | D | |||||
26. 1 < 8 < 5 < 7 <4 <3 < 2 < 6
27. 错误 因为先用水润湿pH试纸,相当于稀释了溶液,使其酸碱性减弱.
盐酸 因为醋酸是弱酸,未完全电离, 稀释时,电离程度增大.所以C(H+)比盐酸变化小.所以盐酸的pH误差较大
28. Zn+Ag2O===ZnO+2Ag; Ag2O, Zn, 负极
29. 阴极: 2H+ + 2e- ==== H2 阳极: 2I- _ 2e- ==== I2
总反应: 2KI + 2H2O======= 2KOH + I2 + H2
30. 阴极: 2H+ + 2e- ==== H2 阳极: Cu—2e-===Cu2+
阴极显红色 因为H+ 消耗, 溶液呈碱性
阳极显蓝色 因为有Cu2+生成, Cu2+呈蓝色
31. 不能 因为此时Cu2+也完全水解 A 不妥当 因为引入了杂质Na+ C D E
C E F
32. B D C E A F
防止标准溶液被稀释
偏高
溶液由无色变成粉红色,且30秒内不褪色
偏低