电离平衡测试题 明德力
1、要求设计实验证明,某种盐的水解是吸热的,下列回答正确的是
A. 将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的
B. 在盐酸中加入相同浓度的氨水,若混合液温度下降,说明盐类水解是吸热的
C. 在醋酸钠溶液中加入醋酸钠晶体,若溶液温度下降,说明盐类水解是吸热的
D.在醋酸钠溶液中滴入酚酞试液,加热后若红色加深,说明盐类水解是吸热的
2、用pH均为2的盐酸和醋酸溶液,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗盐酸和醋酸溶液的体积分别为Vl和V2,则Vl和V2的关系正确的是
A.V1>V2
B.V1<V2
C.V1=V2
D.V1≤ V2
3、甲、乙两杯醋酸稀溶液,甲的pH=a,乙的pH=a+l,对下列叙述的判断正确的是①甲由水电离出来的H+的物质的量浓度是乙的1/10倍,②物质的量浓度c(甲) =10c(乙),③中和等物质的量的NaOH溶液需甲、乙两杯酸的体积,10V(甲)>V (乙),④甲中的c(OH-)为乙中的c(OH-)的l0倍
A.①③正确
B.②④正确 C.只有①正确
D.①②④正确
4、在由水电离产生的c(H+)=1×10-14mol·L-1的溶液中,一定可以大量共存离子组是
A.NH4+、Al3+、Br-、SO42- B.Na+、Mg2+、C1-、NO3-
C.K+、Ba2+、C1-、NO3-
D.K+、Na+、SO42-、SO32-
5、为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG=![]() ,则下列叙述正确的是
,则下列叙述正确的是
A.中性溶液的AG=0
B.酸性溶液的AG<0
C.常温下0.lmol/L氢氧化钠溶液的AG=12 D.常温下0.lmol/L盐酸溶液的AG>12
6、物质的量浓度相同的下列溶液中,含微粒种类最多的是
A.CaCl2
B.CH3COONa C.NH3 D.K2S
7、下列实验过程中产生的现象与对应的图形相符合的是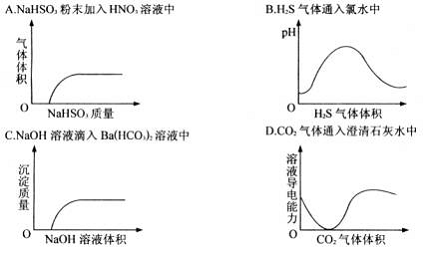
8、相同条件下,等体积、等pH的醋酸和盐酸分别加水稀释后,溶液的pH仍相同,则所得溶液的体积
A.仍相同 B.醋酸大 C.盐酸大 D.无法判断
9、将0.l mol/L CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起
A.溶液的pH增加
B.CH3COOH电离的百分率变大
C.溶液的导电能力减弱
D.溶液中[OH-]减小
10、如图为10mL一定物质的量浓度的盐酸X,用一定浓度的NaOH溶液Y滴定的图示。依据图示,推出X和Y的物质的量浓度是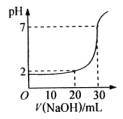
|
| A | B | C | D |
|
| 0.12 | 0.04 | 0.03 | 0.09 |
|
| 0.04 | 0.12 | 0.09 | 0.03 |
11、下列有关pH变化的判断中,正确的是
A.随着温度的升高,碳酸钠溶液的pH减小 B.随着温度的升高,纯水的pH增大
C.新氯水制经光照一段时间后,pH减小 D.氢氧化钠溶液久置于空气中,pH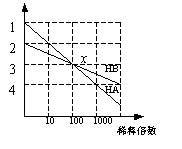 增大
增大
12、现有pH=a和pH=b的两种NaOH溶液,已知b=a+2,将两种溶液等体积混和
后,所得溶液的pH接近于
A a-lg2 B b-lg2 C a+lg2 D b+lg2
13、 0.1mol/L的NaOH溶液0.2L,通入448mL(S.T.P.)H2S气体,所得溶液离子浓度大小关系正确的是
A [Na+]>[HS-]>[OH-]>[H2S]>[S2-]>[H+]
B [Na+]+[H+]=[HS-]+[S2-]+[OH-]
C [Na+]=[H2S]+[HS-]+[S2-]+[OH-]
D [S2-]+[OH-]=[H+]+[H2S]
14、在一定条件下发生下列反应,其中属于盐类水解反应的是
A.NH4++2H2O
![]() NH3·H2O+H3O+
B.HCO3-+ H2O
NH3·H2O+H3O+
B.HCO3-+ H2O ![]() H3O+
+ CO32-
H3O+
+ CO32-
C.HS-+H+=== H2S D.Cl2+H2O
![]() H++Cl-+HClO
H++Cl-+HClO
15、若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是
A.生成了一种强酸弱碱盐 B.弱酸溶液和强碱溶液反应
C.强酸溶液和弱碱溶液反应 D.一元强酸溶液和一元强碱溶液反应
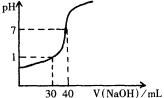
16、(4分) 右图为20mL未知浓度的盐酸用一标准浓度NaOH溶液滴定时的滴定曲线。则两种溶液的物质的量浓度分别是:
[HCl]=
,[NaOH]=
。
17、(8分)在250C时,有pH为a的盐酸和pH为b的NaOH溶液,取VaL该盐酸,同该NaOH溶液中和,需VbLNaOH溶液。填空:
(1)若a + b = 14,则Va∶Vb= _____________(填数字)。
(2)若a + b = 13,则Va∶Vb= _____________(填数字)。
(3)若a + b >15,则Va∶Vb= _____(填表达式),且Va___Vb(填“>”“<”或“=”)
18、(5分)化学实验员给某学生提供下列药品和必要的实验仪器,要求学生设计实验,证明醛酸是弱酸。药品为冰醋酸、醋酸钠.蒸馏水和PH试纸。此同学思考后认为:
(1)设计的理论依据是_________________________;
(2)实验的简要步骤是__________________________;
(3)需记录的现象和数据是_____________________________;
(4)推断与分析:由于__________________,说明_____________,所以醋酸是弱酸。
19、(5分)实验室为测定一新配制的稀盐酸的准确浓度,通常是用纯净的Na2CO3(无水)配成标准溶液滴定。具体操作是:称取wg纯净的无水Na2CO3装入锥形瓶中,加适量蒸馏水溶解,在酸式滴定管中加入待测盐酸滴定。
(1)锥形瓶中应加入几滴指示剂,由于CO2溶解在溶液中会影响pH,从准确性考虑,滴定终点宜选在pH为4~5之间,那么指示剂宜选
,当滴定至溶液由 色变成 色时,即表示到达终点;
(2)若滴定到终点时,消耗盐酸的体积为VmL,则盐酸的物质的量浓度为____ mol/L。
20、(6分)有两份质量相同的氢氧化钠。第一份用煮沸后的蒸馏水配制后立即用盐酸滴定,所耗盐酸体积为V1;第二份用同样的蒸馏水配制放置一段时间后用上述盐酸滴定,盐酸耗去体积为V2。请问:
(1)若用甲基橙作指示剂,则V1和V2的关系为______________;
(2)若用酚酞作指示剂,则V1和V2的关系为_______________;
(3)若上述两种情况下配制的溶液体积相同,则氢氧化钠溶液浓度C1和C2的关系为____
_____________。
(注:用盐酸中和Na2CO3溶液时,分两个阶段进行反应:Na2CO3+HCl=NaCl+NaHCO3,此时溶液 pH=8.4,NaHCO3+HCl=NaCl+H2O+CO2↑,若CO2未赶掉,则溶液的pH约为3.9)
pH=8.4,NaHCO3+HCl=NaCl+H2O+CO2↑,若CO2未赶掉,则溶液的pH约为3.9)
21、(4分)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11,则该温度下水的Kw=
。在此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合。
(1)若所得混合液为中性,且a=12,b=2,则Va︰Vb=
。
(2)若所得混合液为中性,且a+b=12,则Va︰Vb=
。
(3)若所得混合液的pH=10,且a=12,b=2,则Va︰Vb=
。
22、(5分)中和滴定过程中,下列操作能否使测定结果(待测液的浓度数值)发生偏差,请将差别情况的编号写出。
| (1)滴定管用蒸馏水润洗后立即用于中和滴定 | ( ) |
| (2)锥形瓶用蒸馏水润洗后立即盛装待测液 | ( ) |
| (3)滴定完毕,尖嘴外留有液滴 | ( ) |
| (4)滴定管在滴定开始时尖嘴有气泡,滴定完成时气泡消失 | ( ) |
| (5)滴定前仰视读数而滴定终了俯视读数 | ( ) |
A 偏高 B偏低
C 无影响
23、(6分)已知氨水的电离度与醋酸的电离度在同温同浓度下相等,醋酸铵溶液呈中性。现向少量的Mg(OH)2悬浊液中,加入适量的值和氯化铵溶液,固体完全溶解。甲同学的解释是:
Mg(OH)2(固) ![]() Mg2++2OH―-----------------------------------------①
Mg2++2OH―-----------------------------------------①
NH4++H2O ![]() NH3·H2O+H+------------------------------------------②
NH3·H2O+H+------------------------------------------②
H++OH- ![]() H2O…………………③
H2O…………………③
由于NH4+水解显酸性:H+与OH-反应生成水,导致反应①平衡右移,沉淀溶解;乙同学的解释是:Mg(OH)2(固) ![]() Mg2++2OH―…………①
Mg2++2OH―…………①
NH4++OH- ![]() NH3·H2O…………………②
NH3·H2O…………………②
由于NH4Cl电离出的NH4+与Mg(OH)2电离出的OH‑结合,生成了弱的电解质NH3·H2O导致反应①的平衡右移,Mg(OH)2沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学的解释只有一种正确,他选用的试剂是 (填写编号)。
A.NH4NO3 B.CH3COONH4 C.Na2CO3 D.NH3·H2O
(2)请你说明丙同学作出该选择的理由
。
(3)丙同学将所选试剂滴入Mg(OH)2的浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理
(填“甲’’或“乙”);完成NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式
24、(8分)为测定人呼出的气体中的二氧化碳的含量,将1000 mL(已按标准状况折算)呼出的气体通入50.0 mL氢氧化钡溶液中,使其完全吸收,过滤后取20.0 mL澄清溶液,用0.100 mol·L-1盐酸滴定,当消耗20.4mL盐酸时恰好完全反应。另取20.0 mL原氢氧化钡溶液,用同种盐酸滴定,耗去36.4 mL盐酸时,恰好反应完全。试求人呼出气体中CO2的体积分数。
7D
16、 1mol/L
0.5mol/L
17、 1︰1;1︰10;10a+b-14;>
18、 ⑴弱电解质稀释10a倍,pH值改变小a ⑵将一定溶液的醋酸稀释到一定量(如100倍)后,测量稀释前后溶液的pH值 ⑶稀释的倍数,稀释前后溶液的pH值。(4)溶液稀释100倍后,溶液的pH的改变小于2;稀释过程中醋酸的电离度增大
(或测出醋酸钠的PH>7)
19、甲基橙,黄,橙,1000W/53V
20、 (1) V1=V2(2) V1>V2(3)C1>C2
21、答案:10-13
(1)1︰10(2)10︰1(3)1︰9
22、(1)A(2)C(3)A(4)A(5)B
23、答:(1)B;
(2)因为CH3COONH4溶液中呈中性,滴入到Mg(OH)2悬浊液中,若Mg(OH)2悬浊
液溶解,则说明乙同学解释正确;若Mg(OH)2不溶解,则甲同学解释正确;
(3)乙;Mg(OH)2+2NH4+→Mg2++2NH3·H2O
24、 Ba(OH)2
+ CO2= BaCO3↓
+ H2O
Ba(OH)2 + 2HCl= BaCl2 + 2H2O
原Ba(OH)2的浓度:
![]() (2分)
(2分)
吸收CO2后Ba(OH)2的浓度:
![]() (2分)
(2分)
n(CO2)= n(BaCO3)=(0.091 mol·L-1-0.051 mol·L-1)×50×10-3 L=0.002mol (2分)![]() (2分)
(2分)